对比分析突破电解质溶液疑难
2019-02-26刘宇
刘 宇
(四川省泸州市泸县第二中学 646106)
一、忽视酸碱溶液的元数
例1 可以判断某酸(HA)是强电解质的是( ).
A.该酸加热至沸腾也不分解
B.该酸可溶解氧化铜
C.该酸可跟石灰石反应放出CO2
D.该酸浓度为0.01 mol·L-1时的pH为2
答案:D
解析酸加热是否分解取决于酸的结构,而与电解质的强弱无关,A项错误;金属氧化物与酸均可反应,B项错误;比碳酸强的酸均可与石灰石反应生成CO2,C项错误;0.01 mol·L-1的一元酸全部电离可得c(H+)为0.01 mol·L-1,pH为2,全部电离即是强电解质,D项正确.
例2 下列说法正确的是( ).
A.酸式盐的水溶液一定显碱性
B.只要酸与碱的物质的量浓度和体积分别相等,它们反应后的溶液就呈中性
C.纯水呈中性是因为水中c(H+)和c(OH-)相等
D.NaHCO3溶液的pH小于Na2SO4溶液的pH
答案:C
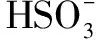
易错点拨关于酸碱的元数、酸碱的强弱、溶液的pH与酸碱性溶液c(H+)的关系:n元强酸能提供的氢离子总数为酸的n倍、n元强酸能提供的氢离子总数小于酸的n倍、酸溶液的pH直接对应现有溶液中的c(H+),与酸的元数、酸的强弱均无关系,碱溶液的规律亦是如此.
二、显性(宏观)粒子与隐性(微观)粒子在电解质溶液平衡体系中的功能
例3 将pH为8的NaOH溶液与pH为10的NaOH溶液等体积混合后,所得的溶液中氢离子浓度最接近于( ).
B.(10-8+10-10) mol·L-1
C.(1×10-14-5×10-5) mol·L-1
D.2×10-10mol·L-1
答案:D
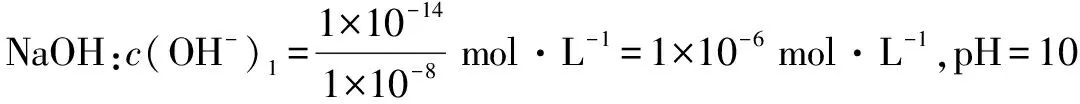

A.稀释溶液,上述可逆反应平衡常数不变
B.通入CO2,溶液pH增大
C.加入NaOH固体,平衡向正反应方向移动
答案:A
能力提升在电解质溶液中,可能存在有多个涉及相同粒子的平衡体系,在体系中相同粒子被不同的平衡体系约束,但是在改变相同量时宏观粒子受到的影响程度较小,因此先对宏观粒子进行处理,在通过平衡影响到微观粒子.
三、混合液酸碱性的判断
例5MOH强碱溶液和等体积、等浓度的HA弱酸溶液混合后,溶液中有关离子的浓度应满足的关系是( ).
A.c(M+)>c(OH-)>c(A-)>c(H+)
B.c(M+)>c(A-)>c(H+)>c(OH-)
C.c(M+)>c(A-)>c(OH-)>c(H+)
D.c(M+)>c(H+)>c(A-)>c(OH-)
答案:C

例6 在25 ℃时,将pH=11的NaOH溶液与pH=3的CH3COOH溶液等体积混合后,下列关系式中正确的是( ).
A.c(Na+)=c(CH3COO-)+c(CH3COOH)
B.c(H+)=c(CH3COO-)+c(OH-)
C.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
答案:D

四、不同溶液中粒子浓度的比较

A.A>B>CB.A>C>B
C.B>A>CD.C>A>B
答案:D


A.a=b=cB.a=c>b
过去十年剖宫产率明显上升,继而出现了剖宫产术后引发的“后遗症“,如瘢痕妊娠、术后粘连、再次妊娠后胎盘植入等,严重影响女性的生殖健康。我院自2015年起采取了一系列措施,收到了一定的效果。现报告如下。
C.b>a>cD.c>a>b
答案:C


五、多元弱酸的酸式酸根离子对应强碱盐溶液的酸碱性判断
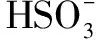
答案:大于
解析在NaHSO3溶液中存在平衡:

例10 现有学生做如下实验:将盛有滴加酚酞的0.1 mol/L NaHCO3溶液的试管微热时,观察到该溶液的浅红色加深;若冷却至室温时又变回原来的浅红色,发生该现象的主要原因是____.(结合化学方程式说明)

六、缓冲体系溶液酸碱性的判断
例11 用物质的量都是0.1mol的CH3COOH和CH3COONa配成1 L混合溶液,已知其中c(CH3COO-)>c(Na+),对该混合溶液的下列判断正确的是( ).
A.c(H+) B.c(CH3COOH)+c(CH3COO-)=0.2 mol·L-1 C.c(CH3COOH)>c(CH3COO-) D.c(CH3COO-)+c(OH-)=0.2 mol·L-1 答案:B 解析在含0.1mol的CH3COOH和CH3COONa的缓冲体系中,CH3COOH的电离与CH3COO-的水解相互抑制,结合“c(CH3COO-)>c(Na+)”知CH3COOH的电离为主,溶液显酸性,c(CH3COO-)>c(CH3COOH),A、C项错误;结合物料守恒,B项正确,D项错误. 例12 常温下,0.1 mol·L-1某一元酸(HA)溶液的pH=3.下列叙述正确的是( ). A.该溶液中:c2(H+)≠c(H+)·c(A-)+Kw B.由pH=3的HA溶液与pH=11的NaOH溶液等体积混合,所得溶液中:c(Na+)>c(A-)>c(OH-)>c(H+) C.浓度均为0.1 mol·L-1的HA和NaA溶液等体积混合,所得溶液中:c(A-)>c(HA)>c(Na+)>c(OH-)>c(H+) D.0.1 mol·L-1HA溶液与0.05 mol·L-1NaOH溶液等体积混合,所得溶液中:2c(H+)+c(HA)=c(A-)+2c(OH-) 解析0.1 mol·L-1某一元酸(HA)溶液的pH=3,说明HA没有完全电离,是一种弱酸.A项,由电荷守恒知,c(H+)=c(A-)+c(OH-),c(H+)·c(A-)+Kw=c(H+)·c(A-)+c(H+)·c(OH-)=c2(H+),错误;B项,由于HA为弱酸,所以pH=3的HA溶液的浓度远大于pH=11的NaOH溶液的浓度,反应中HA过量,溶液呈酸性,错误;C项,应为c(A-)>c(Na+)>c(HA)>c(H+)>c(OH-),错误;D项,溶液中存在以下两个守恒,①c(A-)+c(HA)=2c(Na+),②c(H+)+c(Na+)=c(A-)+c(OH-),①+②×2可得2c(H+)+c(HA)=c(A-)+2c(OH-),正确.答案:D 知识拓展醋酸溶液与醋酸钠溶液(等物质量浓度)的缓冲体系中存在平衡体系也包括: 例13 将0.2 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合,测得混合溶液中c(Na+)>c(A-),则:混合溶液中c(HA)+c(A-)____0.1 mol·L-1. 答案:= 解析通过物料守恒及等体积混合后浓度减半可知,c(HA)+c(A-)=0.1 mol·L-1. 易错点拨对比例11与例13,发现两个物料守恒存在差异,其实只要关注到例11中“0.1mol的CH3COOH和CH3COONa配成1 L”,可知“c2”为0.2 mol·L-1,但例13中HA溶液与不含A元素的溶液等体积混合,该物料浓度减半.


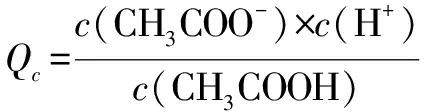
七、物料守恒的正确使用
