浙江地区临床分离粪肠球菌的多位点序列分型及耐药性分析*
2019-02-26陈书韵任绪义
施 宏,陈书韵,杨 狄,任绪义
(杭州迪安医学检验中心,杭州 310000)
肠球菌属(Enterococcus)细菌为兼性厌氧的革兰阳性球菌,目前至少由32个菌种[1]组成,广泛分布于土壤、水和食物中,也是人、犬、禽、猪、马等动物胃肠道正常菌群之一。粪肠球菌是肠球菌属中重要的院内院外感染致病菌。在需氧革兰阳性球菌中仅次于葡萄球菌[2],它不仅可引起尿路感染[3]、皮肤软组织感染[4],还可引起危及生命的菌血症[5]、心内膜炎等[6]。多位点序列分型(multilocus sequence typing,MLST)是一种基于核酸序列测定的细菌分型方法,通过PCR扩增多个管家基因内部片段并测定其序列,可以用于分析菌株的变异,适合全球不同实验室之间的流行菌株数据分析比较[7]。MLST对菌株进行分型鉴定试验,检测流行克隆株的传播途径,大范围长时间内追踪病原菌的遗传谱的变化具有显著优势。对于细菌性疾病的监测,了解传染源、传播途径和预防暴发性传染病的发生有着非常重要的科学意义[8]。本研究利用多位点序列分型(MLST)对浙江省临床分离的74株粪肠球菌菌株进行基因分型,了解浙江地区粪肠球菌的来源和相关的遗传背景。探讨粪肠球菌的流行变化趋势、进化特点及耐药性特征,为本地区粪肠球菌感染的预防治疗提供科学依据。
1 材料与方法
1.1 菌株来源 连续收集2018年1~8月浙江省10个城市28家医院临床分离的粪肠球菌,总计74株。菌株在10个城市的分布如下:杭州27株,湖州5株,宁波6株,绍兴2株,台州3株,衢州1株,丽水2株,舟山6株,桐乡8株,义乌5株,临安9株。菌株经VITEK 2 Compact全自动微生物鉴定药敏分析仪鉴定为粪肠球菌后即可采用。
1.2 试剂和仪器 PCR扩增仪(杭州郎基科学仪器有限公司),全自动凝胶成像系统(上海培清科技有限公司),Vitek-2 Compact全自动微生物分析系统(Biomérieux),恒温金属浴(杭州博日科技有限公司),PCR扩增试剂盒(Takara),细菌培养血平板(Biomérieux)。
1.3 方法
1.3.1 药敏试验:参照美国临床和实验室标准化协会(CLSI)2018年标准,采用梅里埃Vitek-2 Compact全自动微生物分析系统对研究菌株进行鉴定及药敏实验。
1.3.2 细菌核酸抽提:在1.5 ml的EP管中加入300 μl的无菌水,挑取10个左右的单菌落于EP管内,105℃金属浴煮10 min,12 000 r/min离心3 min,取上清于新的离心管中作为细菌核酸模板,于-20℃冰箱保存备用。
1.3.3 MLST基因检测:粪肠球菌的7对管家基因(aroE,gdh,gki,gyd,pstS,xpt,yqiL)PCR扩增所用的引物参照MLST网站(http://www.mlst.net)提供的资料,设计引物后由生工生物工程(上海)股份有限公司合成;PCR反应体系为50 μl:上下游引物浓度均为0.5 pmol/μl,DNA模板为5 μl,10×buffer(含Mg2+)5 μl,dNTP(2.5 mmoL)4 μl,hotTraq酶0.3 μl,ddH2O 34.7 μl。PCR反应条件:95℃变性5 min,然后94℃30 s,退火温度设为51℃40 s,72℃60 s,共扩增40个循环。最后72℃再延伸5 min。扩增产物经电泳检测后直接送生工生物工程(上海)股份有限公司进行测序,测序采用双向测通方法。
1.4 统计学分析 将7个管家基因序列的测序结果在MLST网站数据库进行比对,获得每一管家基因的等位号码,综合所有的等位号码来确定序列型,同时将等位基因谱导入eBurst软件,构建亲缘关系图。另外,依据药敏结果,分析粪肠球菌的耐药与MLST的关联性。
2 结果
2.1 MLST分型结果 见表1。
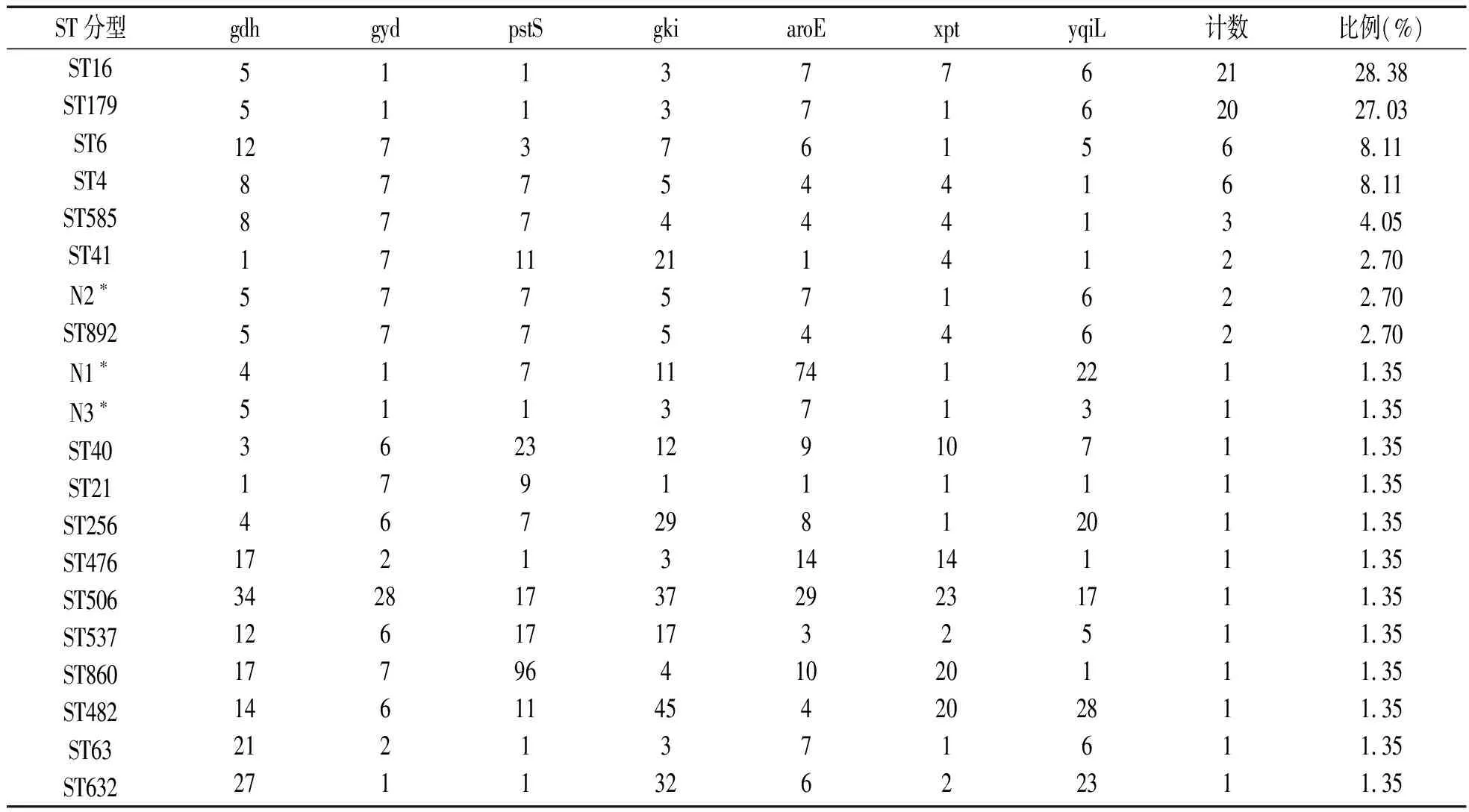
表1 74株粪肠球菌的MLST分型
备注:*表示新的型别,数据库里不包含。
本次实验收集临床分离粪肠球菌菌株中,74株万古霉素敏感粪肠球菌菌株的MLST分型分为20个ST 型,有3个型别是新的型别(数据库里不包含),另外17个型别均是数据库里已知的。在这20个ST型中,其中ST16总数最多,包含21株菌(占28.38%);其次为ST179,包含20株菌(27.03%);再次是ST4及ST6,各包含6株菌(占8.11%);其余ST型只各包含1~3株菌。
2.2 MLST分型亲缘关系分析 见图1。通过MLST分析鉴定,并利用eBurst软件构建菌株进化关系图,发现74株菌株有3个克隆复合体。最普遍流行的克隆复合体是CC16,包含2种ST型(ST16,ST179,其中ST16为原始克隆株),其次为CC4,包含2种ST型(ST4,ST585,其中ST4为原始克隆株),再次为CC6,主要以ST6为主,其它的都是相对零散的克隆复合体。
2.3 药敏试验结果 见表2。本次实验收集的74株临床分离粪肠球菌菌株中,暂未发现万古霉素耐药的菌株,除万古霉素外,最为敏感的抗生素还有替考拉宁、氨苄西林、利奈唑胺及呋喃妥因,敏感率均为100%;耐药程度高的抗生素主要是四环素及红霉素,其耐药率分别为89.2%和73.0%;其次是喹诺酮类药物环丙沙星和左氧氟沙星,其耐药率分别为39.2%和36.5%,再次是高浓度的庆大霉素,耐药率为32.4%;对利福平的耐药率为16.2%,耐药率较低的是青霉素,耐药率为5.4%。
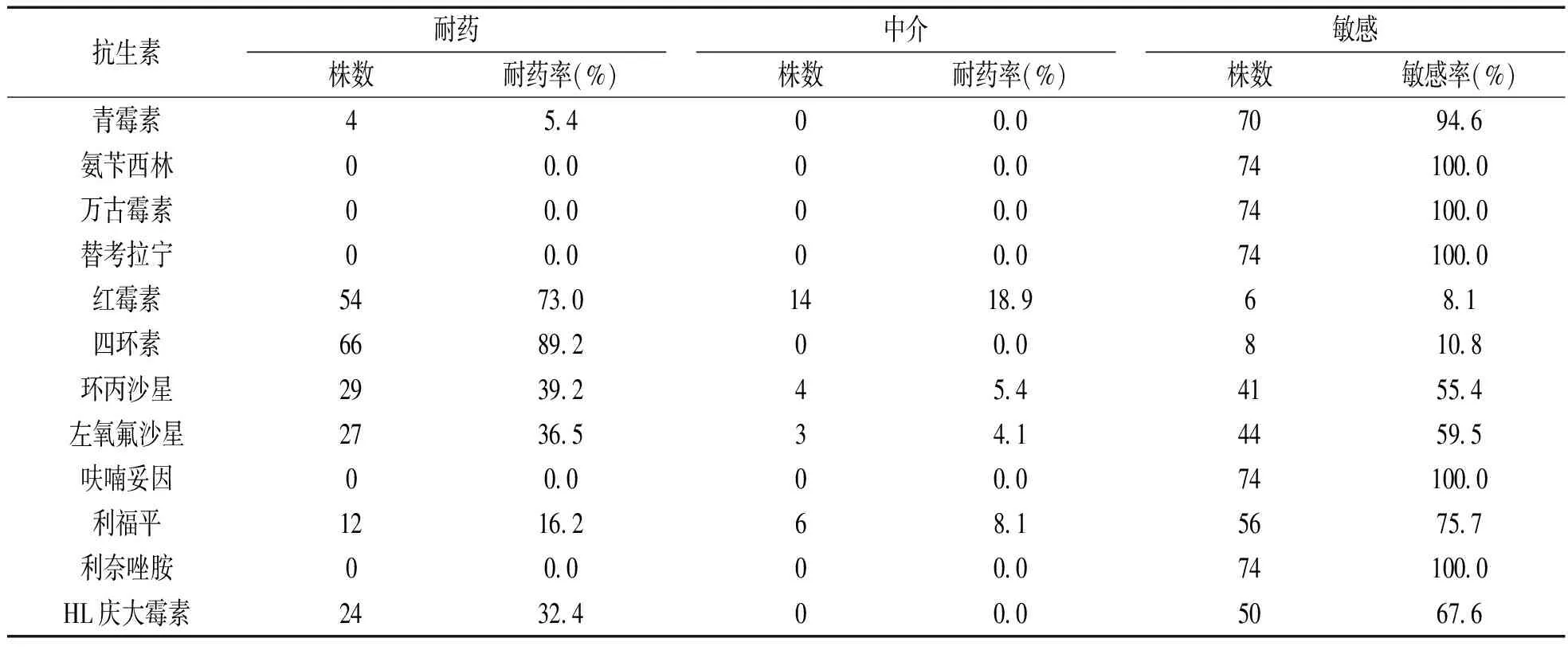
表2 粪肠球菌对抗生素药敏试验结果
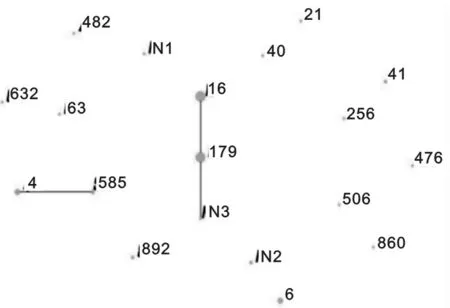
图1 74株粪肠球菌的亲缘关系图
2.4 药物敏感性与MLST分型的相关性 分析优势型别的ST型与药物敏感性的关系,ST16主要是对四环素和红霉素产生耐药,分别是100%和90%,其次是利福平达33%,对高浓度庆大霉素及喹诺酮类耐药,在20%左右;ST179的耐药谱与ST16类似,主要也是对四环素和红霉素产生耐药,分别为100%和95%,其次是高浓度庆大霉素及喹诺酮类耐药,约占35%,但ST179对利福平均表现为敏感。ST6与ST4虽收集的菌株数比较少,分别只有6株,但是6株ST6型菌株对四环素、喹诺酮类药物及高浓度庆大霉素均全部耐药,对红霉素有1株表现为敏感;6株ST4型菌株对红霉素表现为耐药的有5株,对喹诺酮表现为耐药的有4株,对四环素、高浓度的庆大霉素及青霉素表现为耐药的各为3株,在本次实验中,仅发现ST4型的粪肠球菌会对青霉素产生耐药。
3 讨论
肠球菌为临床较常见的一种致病菌。近年来肠球菌引起的医院感染逐渐增多,造成其感染或暴发流行的原因复杂。利用病原细菌分离株的多位点序列分析(MLST),可以发现或证实感染的来源,能够针对一起暴发疫情追踪到病原菌的精细传播链,发现新的传播模式和途径等等,可以对疾病的预防及治疗提供参考依据,但是目前国内对粪肠球菌的基因分型研究相对较少。
本研究中收集了74株粪肠球菌进行MLST分析,均来源于浙江地区的不同家医院,有助于初步了解浙江地区粪肠球菌的遗传背景资料。研究分析的74株粪肠球菌可以分为20个STs,其中优势型别为ST179和ST16,同属于克隆复合体CC16。参考以往文献,从CC16序列型感染和分布情况分析,ST16很可能是一种在不同地区、不同来源间流行的感染菌株,吴敏等[9]人在分析广州地区多重耐药粪肠球菌分离株的ST型,发现ST16最多;邹绍伟等[10]人对包头地区的58株粪肠球菌进行了ST分析,发现ST179为该地区的优势菌株。赵娣等[11]人则在研究动物来源粪肠球菌菌株之间的遗传关系中发现猪病变内脏、生鲜肉样、猪粪、蜂猴和鸡源中均有ST16的分布。另外,在欧洲多个国家及日本的医院和社区分离的粪肠球菌研究[12-13]表明,亦是以CC16(ST16为主要代表)克隆群的多重耐药粪肠球菌为主要感染菌株,在很多医院和社区都有分布。
KUCH等[12]通过MLST分析欧洲收集的386株粪肠球菌分离株,发现由MLST分析和随后的eBURST聚类确定的特定类型主要属于六种克隆复合物(CC2,CC16,CC21,CC30,CC40和CC87)在医院抗生素耐药性的传播中发挥着重要作用,并在一些国家促进了更高的耐药率,这说明粪肠球菌的耐药性与ST之间有一定的相关性。本研究中属于同一克隆复合体CC16的优势菌株ST179与ST16,其两者的耐药谱也很接近,区别仅在于对利福平的耐药程度不一致,ST6型虽只有6株,但均表现为对四环素、喹诺酮类药物及高浓度庆大霉素耐药,这与尼日利亚GHEBREMEDHIN等[12,14]人在粪肠球菌人类分离株中发现高浓度的氨基糖苷类耐药主要集中在ST6分型上的结论相符。ST4属于CC4克隆株,该克隆株虽不属于临床大量出现的菌株,但是此克隆株曾在其他的亚太国家造成严重感染。在孙琅等[14-15]人的研究中,仅有的一株万古霉素耐药粪肠球菌为ST4型。本研究未曾检测出对万古霉素、替考拉宁、氨苄西林耐药的粪肠球菌菌株,但是发现对于青霉素耐药的粪肠球菌只存在于ST4型中。
近年来,由于临床抗生素的大量使用,肠球菌的耐药性也逐渐增强,因此充分了解和掌握肠球菌的耐药机制对防止和控制此类细菌感染的发生、传播具有重要意义。MLST选用7个管家基因,通过基因序列分析的方法,揭示细菌各菌株之间的进化关系,相比于其他分型方法如电泳带型分析,其结果客观、准确,且重复性好,分辨率高。因此本研究课题期望在掌握该方法的同时,继续收集样本建立自己的粪肠球菌库,同时对不同的ST型进行更深一步的研究,比如通过基因组测序考察它们是否携带不同耐药基因,通过质谱仪分析相关代谢产物等,以便长期、大范围地观察和研究粪肠球菌在不同条件下耐药和致病方面发生的变化。
