SIAH2 在卵巢上皮性癌中的表达及意义
2019-02-23甄娟刘玉东宋春红宋敏朱晓艳石家庄市第四医院妇产医院病理科石家庄0500河北省人民医院耳鼻喉科石家庄05005中国医科大学附属第一医院病理科中国医科大学基础医学院病理教研室沈阳000
甄娟 刘玉东 宋春红 宋敏 朱晓艳石家庄市第四医院(妇产医院)病理科(石家庄0500);河北省人民医院耳鼻喉科(石家庄05005);中国医科大学附属第一医院病理科,中国医科大学基础医学院病理教研室(沈阳000)
卵巢癌是我国女性常见的生殖系统恶性肿瘤之一,上皮性癌是最常见的病理类型,其恶性程度高,易发生远处转移,病死率较高,严重威胁着妇女的健康和生命安全。同时由于卵巢深居于盆腔内,病变早期不易被发现,患者就医时大部分已经发展到中、晚期,有的患者手术已经不能将病灶完全切除,直接影响到患者的术后生存率和生存质量[1-2]。因此,寻求有效的肿瘤标志物对卵巢上皮性癌的早期诊断、靶向治疗及预后评估具有非常重要的意义。最新研究报道E3 泛素连接酶SIAH2 参与多种恶性肿瘤的发生发展和转移,然而在卵巢上皮性癌中的研究和作用仍然不明,本研究旨在探讨SIAH2 在卵巢上皮性癌中的表达及临床意义,以及对评估卵巢上皮性癌患者预后的作用。
1 材料与方法
1.1 材料收集石家庄市第四医院(妇产医院)病理科2010-2017年妇科手术切除卵巢标本存档蜡块165 例,卵巢上皮性癌55 例,卵巢交界性肿瘤36 例,卵巢良性囊肿39 例,正常卵巢组织35 例,所有患者术前均未接受放、化疗。年龄29~74 岁(中位年龄55岁)。按WHO组织学分类标准:浆液性癌35 例,黏液性癌9 例,透明细胞癌11 例。低级别癌19 例,高级别癌36 例。按FIGO 分期标准:Ⅰ+Ⅱ期18 例,Ⅲ+Ⅳ期37 例。淋巴结转移33 例,无淋巴结转移22 例。标本均经10%中性甲醛固定,石蜡包埋,HE 常规染色后明确诊断。部分标本离体后取少量立即放入液氮后于-70 ℃冰箱保存,以备Western blot 检测。所有标本的使用均通过了本院伦理委员会审核且患者本人知情同意。
1.2 主要试剂免疫组织化学S-P 检测试剂盒、DAB 酶底物显色试剂盒(DAB-0031,福州迈新生物技术公司);鼠抗人SIAH2 抗体(美国Santa Cruz公司),β-actin 抗体(北京中杉金桥生物技术有限公司)。
1.3 方法
1.3.1 免疫组织化学染色及结果判定组织经中性福尔马林固定、石蜡包埋,制成4 μm 连续切片。按照免疫组织化学S-P 检测试剂盒说明书步骤进行SIAH2(1:200)免疫组织化学染色。PBS 代替一抗作阴性对照,用已知阳性片作阳性对照。SIAH2 判定标准:SIAH2 以细胞核中出现棕黄色颗粒为阳性显色,每张切片随机选取5 个高倍视野(× 400),每个高倍视野计数200 个目的细胞。将表达阳性率分为以下4个等级:≤25%为0分,26%~50%为1 分,51%~75%为2 分,>75%为3 分。根据免疫组织化学染色强度分为4 个等级:无着色计为0 分,浅黄色颗粒计为1 分,棕黄色颗粒计为2 分,黄褐色计为3 分。以SIAH2 表达阳性率和染色强度的分值乘积作为总积分,积分≥4 分者判定为阳性,积分<4 分者判定为阴性。
1.3.2 Western blot收集新鲜卵巢组织,加入裂解液充分裂解,粉碎匀浆后,低温高速离心(4 ℃,12 000 r/min,40 min),提取上清即为总蛋白。经电泳、转印,5%正常小牛血清封闭,抗SIAH2(1∶150)、抗β-actin(1∶200)室温下孵育2 h,ECL发光;拍照及进行计算机图像分析,Image J 软件用于半定量分析特异性条带的光密度值,将目的蛋白与β-actin 光密度值作为相对表达量。实验至少重复3 次,取平均值。
1.3.3 随访卵巢癌患者术后进行5年定期随访,开始时间为接受手术的时间,截止日期为2017年10月31 日,满足5年随访时间的患者有35 例(注:包括满5年随访时间和6 例删失患者)。采用门诊随访及电话随访,平均每6 个月1 次,规定死亡患者死亡时间为终止时间,中途失访者的终止时间为最后1 次随访时间,亦纳入生存分析。
1.4 统计学方法采用SPSS 13.0 统计学软件,进行χ2检验分析SIAH2 与临床病理参数的关系,采用Kaplan-Meier 法绘制生存曲线及Log-rank 检验进行生存分析,Cox 回归分析卵巢上皮性癌患者预后的独立预测因素。定量资料采用F检验(均数±标准差)进行比较。P<0.05为差异有统计学意义。
2 结果
2.1 SIAH2 蛋白在卵巢组织中的表达免疫组织化学结果显示,在165 例卵巢石蜡标本中,SIAH2呈核表达阳性(图1),阳性表达率在正常卵巢组织与卵巢良性囊肿分别为2.86%(1/35)和5.13%(2/39),表达差异无统计学意义(P>0.05);从正常组织和良性囊肿到交界性肿瘤(41.7%,15/36)再到上皮性癌(76.4%,42/55)中SIAH2 的阳性率逐渐升高,差异均有统计学意义(均P<0.05)。SIAH2与卵巢上皮性癌的高级别、高FIGO 分期和淋巴结转移呈正相关(均P<0.05)。见表1。
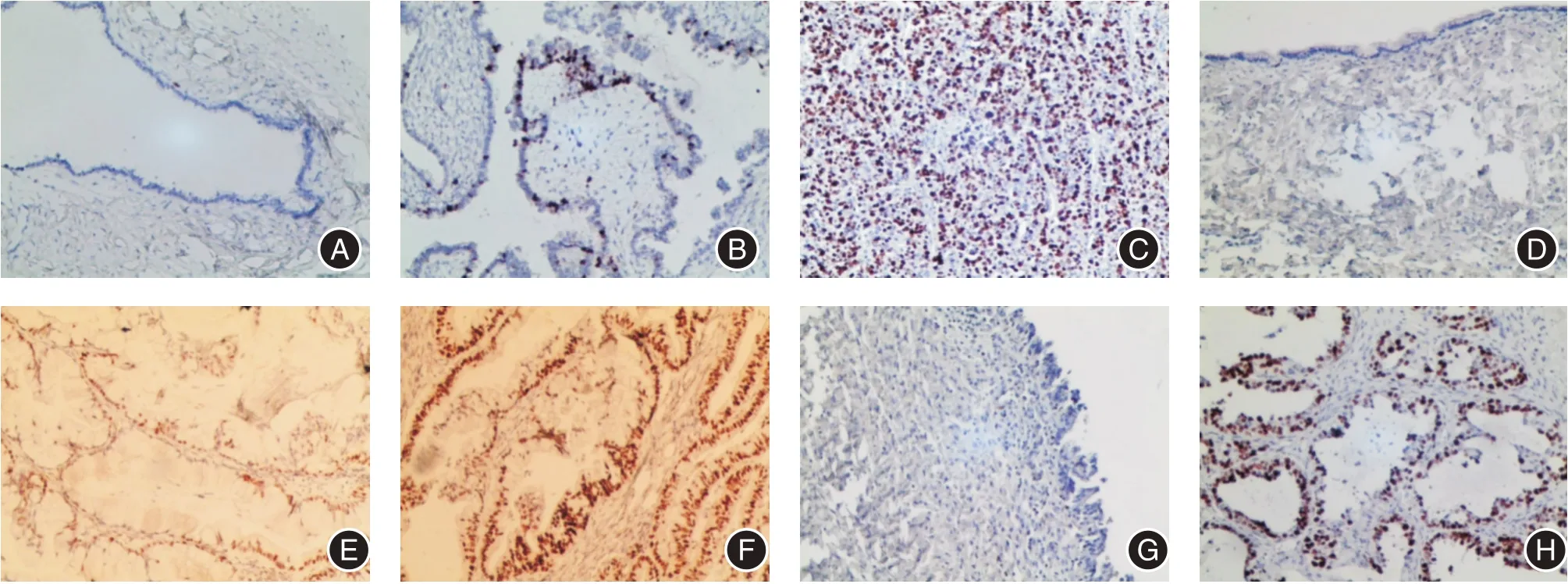
图1 SIAH2 在卵巢组织中的表达(SP×200)Fig.1 Expression of SIAH2 in ovarian tissues

表1 55 例卵巢上皮性癌组织中SIAH2 的表达与临床病理学参数的关系Tab.1 Associations between expression of SIAH2 and clinicopathologic parameters 例
2.2 生存分析35 例患者(满5年随访时间的卵巢癌患者包括6 例删失患者)术后开始随访60 个月,删失6 例,删失患者亦纳入生存分析。SIAH2阳性表达患者平均生存时间为20 个月,中位生存时间为17 个月;SIAH2 阴性表达患者平均生存时间为41 个月,中位生存时间为45 个月。SIAH2 阳性表达患者中位生存时间及总生存率显著低于阴性表达患者,差异有统计学意义(Log-rank 检验Wald=7.443,P=0.006,图2、表2)。对卵巢上皮性癌患者生存时间的单因素和多因素分析结果表明,SIAH2 的表达、肿瘤组织学分级、FIGO 分期与卵巢上皮性癌的生存时间相关(均P<0.05,表2),SIAH2是卵巢上皮性癌预后的独立影响因素(表3)。

图2 SIAH2 的表达与卵巢癌患者总生存率的关系Fig.2 Association between expression of SIAH2 and overall survival(cum survival)
2.3 SIAH2在卵巢上皮性癌组织中高表达Western blot 结果显示,在正常卵巢组织、卵巢良性囊肿、卵巢交界性肿瘤及卵巢上皮性癌中SIAH2 的相对表达量分别是0.12 ± 0.05、0.11 ± 0.04、0.57 ±0.08、1.05 ± 0.10;正常卵巢组织和卵巢良性囊肿SIAH2 的表达差异无统计学意义,从卵巢组织(卵巢良性囊肿)到卵巢交界性肿瘤再到卵巢上皮性癌组织中SIAH2 的表达依次升高,差异均有统计学意义(均P<0.05,图3)。

表2 卵巢上皮性癌患者总生存率的单因素分析Tab.2 Univariate survival analysis of overall survival(OS)in 35 patients月
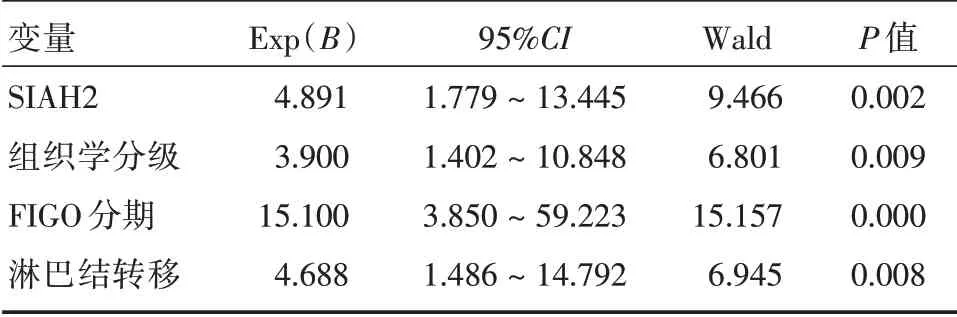
表3 卵巢上皮性癌患者总生存率的多因素分析Tab.3 Multivariate survival analysis of overall survival(OS)in 35 patients

图3 SIAH2 卵巢组织中的表达Fig.3 Expression of SIAH2 in ovarian tissues
3 讨论
卵巢上皮性癌是病死率最高的妇科恶性肿瘤,极易发生扩散和转移,又由于早期缺乏典型的临床症状,导致多数患者就诊时已发生肿瘤播散和(或)转移。尽管随着临床诊断手段和治疗技术的日益发展,卵巢上皮性癌的5年生存率也仅从1975年的36%提高到2011年的46%[3]。目前,生物学治疗作为肿瘤治疗的新模式日益受到重视,越来越多的研究以关键性因子作为切入点,寻求早期诊断卵巢上皮性癌的生物学指标和新的与预后相关的生物学因子,在早期诊治和评估患者预后的同时有助于制定更科学合理的综合治疗方案。
真核细胞内的蛋白质主要通过两种不同的蛋白酶解系统降解:溶酶体途径和泛素-蛋白酶途径,其中80%通过后者降解,E3 泛素连接酶是该系统的重要成分,在细胞凋亡的每个时期都有泛素-蛋白酶体降解途径参与。SIAH2 为高度保守的泛素连接酶,定位于3Q25 号染色体,编码了324 个氨基酸,有2 个外显子被1 个9.8 kb 内含子隔开,起始甲硫氨酸位于外显子1,与siah1 有85%的同一性,与果蝇属sina 有68%的同一性。SIAH2 蛋白经由RING FINGER 区域参与一些蛋白的泛素化和水解作用,通过作用不同的底物从而影响细胞的功能如低氧反应、信号转导通路、细胞生存、线粒体生物合成、脂肪生成、神经中枢调节等[4-6]。近来研究发现,SIAH2 可作为癌基因在多种恶性肿瘤中发挥生物学作用,SIAH2 在前列腺癌[7]、肺癌[8]、乳腺癌[9]、急性T 淋巴细胞白血病[10]等组织中均高表达,并且随着肺癌及乳腺癌恶性程度的增高其蛋白表达水平也逐渐增高,抑制SIAH2 的表达后乳腺癌细胞和肺癌细胞的增殖迁移能力下降[11-12]。本次Western blot 结果显示,SIAH2 在正常卵巢组织和卵巢良性囊肿组织中表达差异无统计学意义,从正常卵巢组织和卵巢良性囊肿组织到交界性肿瘤再到卵巢癌组织中的蛋白表达量逐渐增加,差异均有统计学意义,与此一致的是免疫组化结果发现SIAH2 蛋白的阳性表达率也逐渐升高,差异有统计学意义,可借此推测SIAH2 在卵巢癌的发生、发展过程中起着促进作用。同时统计学分析显示卵巢上皮性癌组织中SIAH2 的阳性表达随着FIGO 分期和病理学分级的增高而增加,且与淋巴结转移呈正相关,这与国外文献的研究结果基本一致[13]。说明了SIAH2 与卵巢上皮性癌的生物学行为密切相关。
最近研究报道SIAH2 能够改变抗癌药物的反应,过表达的SIAH2 能够增强中枢神经系统肿瘤细胞MALME 3m 对抗癌药物的抵抗,下调SIAH2的表达后可以增强肿瘤细胞对抗癌药物的敏感性[14]。由此可见SIAH2 可以用于肿瘤的治疗。WONG 等[15]发现在SIAH2 表达缺失的肿瘤中,可以提高化疗反应和延长生存率。本研究通过生存分析发现,SIAH2 蛋白表达与患者5年总生存率密切相关,SIAH2 表达阳性的患者5年生存率及中位生存时间低于阴性表达的患者,两组生存曲线的分布差异有统计学意义;COX 多因素回归分析结果也表明,SIAH2 蛋白阳性表达是影响患者预后的独立危险因素之一。说明SIAH2 对卵巢上皮性癌具有一定的预后评价作用。
综上,笔者推测SIAH2 可以作为卵巢上皮性癌诊断的生物学标志物和治疗的药物靶点,SIAH2作为一种促癌因子,应用有效的刺激诱导肿瘤细胞中SIAH2 表达水平下调可作为治疗卵巢上皮性癌的新靶点,为卵巢上皮性癌的治疗提供了一个新思路,同时SIAH2 可以作为患者预后的独立预测因素,为临床预后评估提供理论依据。
