FGF23与CKD患者钙磷代谢及心血管疾病关系研究进展
2019-02-22闫奇奇综述审校
闫奇奇 综述 郝 丽,张 森 审校
近年来,慢性肾脏病(chronic kidney disease,CKD)的发病率明显升高,已经严重威胁人类健康。慢性肾脏病患者早期易出现钙磷代谢紊乱,及时检测并纠正其紊乱、维持钙磷代谢平衡对延缓慢性肾脏病进展具有重要意义。研究[1]显示,成纤维细胞生长因子23(fibroblast growth factor 23,FGF23)可能在CKD 2期即出现升高,先于CKD患者甲状旁腺激素(parathyroid hormone,PTH)和磷水平的改变,且FGF23是CKD患者发生心血管事件及死亡的独立危险因素,有效降低FGF23水平或对延缓慢性肾脏病进展、改善患者预后具有重要意义。本文就FGF23基本作用机制、与CKD患者钙磷代谢及心血管疾病关系做一综述。
1 FGF23及Klotho蛋白简介
FGF23是成纤维细胞生长因子家族的一员,是一类主要由骨细胞和成骨细胞产生的多肽。编码蛋白产物包含251个氨基酸,而分泌型FGF23,即成熟全段 FGF23(iFGF23)分子量约32 ku,包含227个氨基酸。分泌过程中iFGF23可被降解成N末端FGF23(nFGF23)和C末端FGF23(cFGF23),但只有iFGF23才具有生物活性。nFGF23具有FGF23受体(fibroblast growth factor receptor,FGFR)结合域,可与FGFR结合,cFGF23则可与Klotho蛋白结合。Klotho蛋白包括α-Klotho、β-Klotho和γ-Klotho 3种,其中α-Klotho蛋白主要表达在肾脏及甲状旁腺,又可分为分泌型α-Klotho蛋白和膜型α-Klotho蛋白。分泌型α-Klotho蛋白作为具有酶活性的内分泌因子发挥作用,而膜型α-Klotho蛋白则作为FGF23与FGFR结合的辅助因子,增强其亲和力[2]。
2 FGF23生理机制及对钙磷代谢的影响
2.1FGF23-Klotho轴肾脏是α-Klotho蛋白的主要表达器官,近几年有关肾脏FGF23-Klotho轴的研究取得了显著进展。在近端肾小管,FGF23能够在Klotho存在时直接激活其上皮细胞中细胞外调节蛋白激酶1/2(extracellular signal-regulated kinase-1/2,ERK1/2)及血清/糖皮质激素调节激酶1(serum/glucocorticoid-regulated kinase-1,SGK1),SGK1的激活进一步导致Na+/H+交换调节辅因子1(Na+/H+exchange regulatory cofactor-1,NHERF-1)磷酸化,并随后抑制钠依赖性磷酸盐转运蛋白2a(NaPi-2a)和钠依赖性磷酸盐转运蛋白2c(NaPi-2c)在细胞膜上的表达。其中FGF23主要通过抑制NaPi-2a表达减少磷酸盐重吸收,NaPi-2c仅起小部分作用。但有一些动物研究显示,NaPi-2c无功能动物模型出现不能由NaPi-2a调节恢复的低磷血症和磷酸盐排泄增加,而NaPi-2a无功能动物模型却不会出现上述改变。这可能是由于物种差异引起,其具体机制有待进一步研究[3]。Han et al[4]研究发现敲除近端肾小管FGFR1的小鼠出现了高磷血症及FGF23抵抗,进一步证实FGF23可直接激活近端肾小管上皮细胞,并提示其受体可能为FGFR1。此外,有动物研究[5]显示,完全消除FGF23抑制磷酸盐重吸收的作用必须敲除FGFR1和FGFR4,提示FGFR4也为其受体之一。而NHERF-1是否为SGK1的直接靶目标以及SGK1激活是否可引起NHERF-1下游目标的磷酸化,目前仍尚未明确。此外,FGF23还可在Klotho存在及FGFR1、3、4参与下激活ERK1/2,从而抑制肾脏1α-羟化酶的表达,尽管ERK1/2下游信号通路目前还不清楚。在远端肾小管,钙的重吸收受上皮细胞钙通道瞬时受体电位香草酸亚型5(transient receptor potential vannilloid-5,TRPV5)开放数目调节。研究[6]显示,FGF23在远端肾小管独立于维生素D水平调节TRPV5,使其开放数目增多。其机制主要是FGF23引起ERK1/2、SGK1及WNK4(with-no-lysine kinase 4)激活,而WNK4不仅是TRPV5等膜蛋白胞内转运的关键酶,还是NCC(Na+Cl-cotransporter)表达数量的关键调节因子。总的来说,FGF23不仅抑制近端肾小管磷酸盐重吸收,也通过激活WNK4调节远端肾小管钙钠转运。
2.2FGF23/OPG轴FGF23在血管平滑肌细胞中的作用机制尚未完全明确,过往研究发现人和小鼠血管平滑肌细胞(vascular smooth muscle cells,VSMCs)没有Klotho mRNA表达,FGF23对钙沉积不起作用。但也有研究[7]显示Klotho mRNA在小鼠血管平滑肌细胞中表达,FGF23通过细胞外信号调节激酶1/2(extracellular signal-regulated kinase 1/2,ERK1/2)信号传导通路促进成骨细胞分化并加速血管钙化。骨保护素(osteoprotegerin,OPG)是一种调节骨形成和血管钙化的分泌蛋白,被认为是核因子κB配体的受体激活剂(receptor activator of nuclear factor κB ligand,RANKL)的受体。RANKL可通过RANK的激活上调骨形态发生蛋白4(bone morphogenetic protein 4,BMP4)的表达,从而促进血管钙化。Nakahara et al[8]在体外研究中发现,水平升高的FGF23会在α-Klotho蛋白存在时激活ERK信号传导并通过FGFR1上调OPG表达,但对RANKL的表达没有影响。OPG/RANKL表达上调进一步抑制MSX2、RUNX2、BMP2、BMP4及ALP等成骨分化基因的表达,并最终抑制血管钙化。这是一种新的机制,但OPG基因在FGF23介导下的具体调控机制以及FGF23/OPG轴在体内对血管钙化的作用尚有待研究。此外,这些研究结果的差异可能与实验采用的血管平滑肌细胞物种不同、培养条件不同以及细胞传代次数不同等有关。
2.3FGF23-Klotho轴/RAAS系统阻断肾素血管紧张素-醛固酮系统(renin angiotensin-aldosterone system,RAAS)可通过降低血压及尿蛋白、抗纤维化等作用延缓慢性肾脏病进展。RAAS和FGF23-Klotho轴之间存在复杂的相互作用机制。FGF23 升高可下调1α-羟化酶表达,导致1,25(OH)2D3水平下降,肾素分泌增加,肾素血管紧张素系统激活,从而使血管紧张素Ⅱ升高,而血管紧张素Ⅱ可下调Klotho蛋白表达,造成 FGF23抵抗,使FGF23 水平进一步升高[9]。FGF23还可干扰RAAS阻断剂的药理作用。此外,有研究[10]表明Klotho蛋白通过抑制Wnt/β Catenin途径参与调节RAAS的激活。
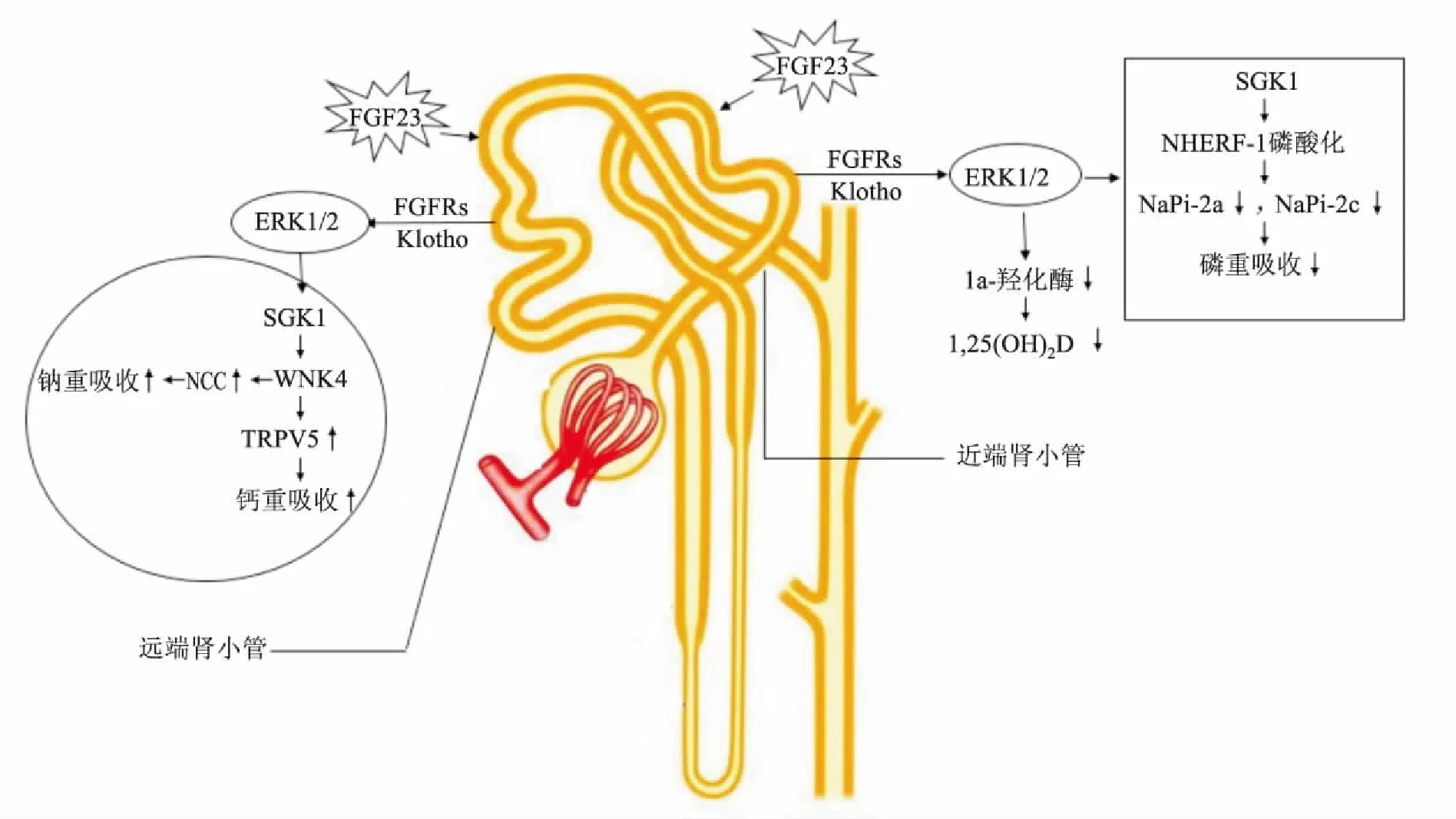
图1 肾脏FGF23-Klotho轴示意图
2.4FGF23对钙磷代谢的影响肾脏是人体维持水、电解质、无机盐平衡,排出代谢废物的重要器官,也是体内1,25(OH)2D3的主要来源。1,25(OH)2D3合成关键酶1α-羟化酶主要在近端肾小管上皮细胞表达,并受PTH、FGF23、1,25(OH)2D调节。FGF23是重要的磷酸盐代谢调节分子,可通过抑制近端肾小管磷酸盐重吸收调节体内磷酸盐稳态。CKD患者肾脏清除能力下降,早期即可出现钙磷代谢紊乱,引起FGF23代偿性升高,以减少肾脏磷的重吸收和1,25(OH)2D3的合成,从而维持钙磷代谢平衡[1]。在CKD晚期,由于肾脏 Klotho合成减少以及靶器官出现FGF23抵抗,高FGF23水平不仅不能有效调节钙磷平衡,反而出现一系列毒性作用,如甲状旁腺功能亢进、佝偻病、左心室肥厚、血管钙化等。
3 FGF23对CKD患者相关靶器官的调节作用
3.1FGF23对甲状旁腺的作用甲状旁腺是FGF23的另一靶器官,可表达FGFR及α-Klotho蛋白。其分泌的PTH是机体调节磷代谢的又一重要调节分子。FGF23在甲状旁腺中的正常生理作用尚未明确,体内外研究表明FGF23可抑制PTH的合成和分泌,但大量实验数据表明FGF23与PTH呈正相关。这种相互矛盾的结果可能与甲状旁腺FGFR及α-Klotho蛋白表达下降、细胞增生标志物Ki67上调、甲状旁腺组织出现FGF23抵抗等有关,其机制有待进一步研究。CKD患者可出现继发性甲状旁腺功能亢进(secondary hyperparathyroidism,SHPT),其机制与FGF23代偿性升高从而抑制1,25(OH)2D3的合成,以及随着CKD进展,FGF23不能有效维持磷平衡以及FGF23-Klotho轴对甲状旁腺功能的抑制作用减弱有关。
3.2FGF23对骨骼系统的作用在骨骼矿化过程中磷不可或缺,FGF23作为磷代谢调节分子,必然也对骨的发育和功能起到一定作用。FGF23过度表达者可出现低磷血症、佝偻病/骨软化等,而FGF23缺乏者可出现高磷、高钙血症及严重骨疾病等。由于FGF23受DMP1、PHEX蛋白、FAM20C激酶、血清磷水平、硬骨素等局部因素和PTH、1,25(OH)2D3等全身因素调节,其对骨矿化的影响可能是通过多种与磷酸盐稳态相关的传导途径相互作用介导。FGF23作为一种局部信号分子,通过促进骨矿化拮抗物的产生发挥其抑制骨矿化的作用。
4 FGF23对心血管系统的作用
FGF23是CKD患者多种心血管事件的危险因素,对预测CKD患者临床终点事件有重要价值。有动物实验表明,FGF23可促进心肌纤维化并加重由心肌梗死或缺血/再灌注引起的舒张功能障碍,这与活性β-连环蛋白和转化生长因子β的上调有关[11]。
4.1血压一项对128例CKD患者的临床研究[12]表明,血清FGF23水平与平均动脉压呈正相关。这提示,FGF23对反映CKD患者血压水平及透析治疗效果有重要临床意义。
4.2房颤房颤(atrial fibrillation,AF)在ESRD患者中发病率更高,并增加了CKD患者进展为ESRD的风险。日本一项研究[13]表明FGF23和房颤患病率独立于肾功能和血清钙磷代谢调节因子呈U型相关,但其机制尚不明确。
4.3左心室肥厚左心室肥厚(left ventricular hypertrophy,LVH)在CKD患者,尤其是ESRD患者中普遍出现,并与CKD患者心血管事件发生率及死亡率密切相关。多项临床研究证实FGF23对LVH具有促进作用。但FGF23与其受体结合需α-Klotho蛋白的参与,心肌细胞中没有α-Klotho蛋白表达,有研究却发现FGF23仍可导致左心室肥厚,提示FGF23可对心脏产生直接毒性作用。Mitsnefes et al[14]在一项对587例CKD儿童研究中发现,对于eGFR≥45 ml/(min·1.73 m2)的患儿,高FGF23水平与高LVH发生率显著相关。Leifheit-Nestler et al也在一项对24例终末期肾病患儿的研究中发现CKD患者FGF23水平和LVH呈强正相关,并提示其信号传导机制可能是FGFR4依赖的PLCγ/钙依赖磷酸酶/NFAT途径的级联型信号传导,但目前尚缺乏数据证实[15]。
4.4血管钙化血管钙化(vascular calcification,VC)在CKD3-5期患者中发病率可达79%,并可用于预测CKD患者死亡率。CKD晚期患者几乎在所有动脉,包括冠状动脉中均出现血管内膜及中膜钙化。FGF23是各阶段CKD患者血管钙化的独立生物标志物。最近一项在对227例维持性血液透析患者的研究也发现FGF23水平与维持性血液透析患者腹主动脉钙化程度独立相关。FGF23在血管钙化中如何发挥作用尚未完全明确,研究[7]表明,FGF23的增加可促进磷诱导的血管钙化。Nakahara et al[8]在一项体外研究中发现FGF23抑制成骨细胞基因表达并诱导人主动脉血管平滑肌细胞中骨保护素的表达,提示FGF23可能通过抗血管平滑肌细胞成骨转化作用抗血管钙化。

图2 FGF23对CKD患者相关靶器官的调节作用示意图
5 降FGF23药物在延缓慢性肾脏病进展中的应用
FGF23是 CKD患者钙磷代谢紊乱、血管钙化、心血管事件的重要生物标志物,也是维持性透析患者死亡的独立危险因素,可能在CKD 2期即出现升高,先于CKD患者PTH和磷水平的改变[1]。CKD早期FGF23水平代偿性升高可维持体内钙磷代谢平衡,但CKD晚期FGF23水平升高明显,促使患者出现各种全身并发症。鉴于FGF23水平升高较早,可早期有效预测CKD患者病情进展,降低FGF23水平可能是延缓慢性肾脏病病情进展,改善预后的有效措施。
5.1降低血磷限制饮食中磷摄入量或使用磷结合剂可以降低FGF23水平[16]。采用不含钙的磷结合剂司维拉姆可降低CKD患者FGF23水平,尽管还没有明确的剂量-反应关系。而含钙的磷结合剂不仅不能降低其水平,甚至可使其水平升高。其机制可能是由于钙被认为是刺激FGF23合成的次要因子。烟酰胺是磷酸盐转运抑制剂,可有效阻断肠道NaPi-2b的表达,导致磷酸盐吸收减少,并可有效降低FGF23水平。
此外,近年来研究[17]显示铁缺乏可刺激FGF23生成,而对于常染色体显性低磷血症性佝偻病以及CKD患者,其FGF23降解功能障碍,最终导致FGF23水平升高。因此,纠正铁缺乏也可能是有效降低FGF23水平的手段之一。含铁磷酸盐结合剂主要包括蔗糖羟基氧化物(sucroferric oxyhydroxide,PA21)和柠檬酸铁复合物两种。PA21与FGF23水平下降相关,提示PA21可降低FGF23水平,但其具体机制目前尚未明确。柠檬酸铁复合物可有效降低非透析CKD患者FGF23水平,在一项对27名铁缺乏的血液透析患者的为期3个月的研究中发现,柠檬酸铁复合物降FGF23效果优于司维拉姆,这种作用独立于血清磷水平[18]。但由于其实验为短期开放标签实验,故长期疗效不能肯定。
5.2拟钙剂一项对49名腹膜透析患者的单中心回顾性研究发现,应用西那卡塞及增加腹膜透析灌注量可降低FGF23水平,提示西那卡塞及特定腹膜透析方案或可有效降低FGF23水平[19]。西那卡塞是一种钙受体增敏剂,其降低FGF23水平的可能机制一方面是直接作用于骨细胞抑制FGF23合成,一方面是通过激活甲状旁腺钙敏感受体降低PTH(已被证实可直接诱导FGF23合成)分泌,从而间接引起FGF23水平下降。
活性维生素D及其类似物已证实可引起FGF23水平升高。Hansen et al[20]研究表明,阿法骨化醇和帕立骨化醇均可使血液透析患者FGF23升高2~3倍,而在清除后恢复基线水平。故避免过度使用活性维生素D及其类似物对降低FGF23水平或可发挥一定作用。
5.3FGF23抗体及FGFR阻断剂FGF23抗体可明显降低FGF23水平,但却可能引起血磷水平升高,增加患者死亡率。故如何在应用FGF23抗体降低CKD患者FGF23水平的同时有效控制磷水平尚有待进一步探索。此外,NVP-BGJ398(一种选择性FGFR阻断剂)能在分子信号传导通路水平上有效阻断FGFR发挥作用[21],但如何在抑制FGF23对心脏等器官的毒性作用的同时不影响其正常生理功能尚有待研究。
5.4甲状旁腺切除术及肾移植对于难治性SHPT,甲状旁腺切除术是一种有效治疗手段。有研究[22]显示,FGF23水平升高与CKD 5期患者心率变异性降低独立相关,而成功的甲状旁腺切除术可以逆转这些异常指标。肾移植作为终末期肾病的治疗手段,也可显著降低FGF23水平。Coskun et al[23]在一项对106例肾移植患者和30例CKD患者的研究中则发现肾小球滤过率相同时其血清FGF23水平无明显差异。
6 展望
FGF23作为CKD患者发生心血管事件及死亡的独立危险因素及预测CKD进展的早期指标,有效降低FGF23水平对延缓慢性肾脏病进展、改善预后具有重要意义。限制磷摄入、降低磷水平、应用拟钙剂、合理应用活性维生素D、应用FGF23抗体及FGFR阻断剂等是降低血清FGF23水平的有效措施,但仍有许多问题,如FGF23应控制在何种水平、FGF23抗体和FGFR阻断剂应用时机及安全性等尚有待更多研究。
