siRNA可降低IL-1β刺激椎间盘细胞所致凋亡敏感性
2019-02-22韩敦富尹荷珊王鹏云
韩敦富,尹荷珊,王 延,王鹏云,汪 震,魏 超,时 明
炎症因子特别是IL-1β在椎间盘退变过程中发挥了很大的促进作用,涉及到诸多方面[1-2]。最近的研究[3]表明,IL-1β不仅能够导致营养缺乏状态下椎间盘细胞的凋亡,而且还可以大大提高椎间盘细胞对Fas Ligand介导的凋亡敏感性[4]。Cui et al[4]研究同时还发现,IL-1β可以上调死亡受体Fas mRNA 的表达。然而,关于IL-1β预刺激增强了椎间盘细胞对Fas L的凋亡敏感性的原因却未作深究。
该研究力图利用RNAi的方法对这一原因进行探讨并检验能否利用这一技术降低椎间盘细胞对炎性因子刺激而导致的凋亡敏感性,并对其机制作初步探讨。为保持与Cui et al[4]实验结果的一致性,本部分实验仍然采用了SD大鼠椎间盘内层纤维环+髓核交界区细胞。
1 材料与方法
1.1实验动物3月龄SD大鼠,雌雄不限(中山大学动物实验中心提供)。
1.2主要试剂及仪器DMEM-F12培养基(美国Gibco公司);特优级胎牛血清(美国Hyclone公司);重组大鼠Fas Ligand(美国R&D Systems公司);Fas-siRNA(广州市锐博生物科技有限公司);RT-PCR试剂盒(PrimeScriptTMRT-PCR Kit,日本TaKaRa公司,);PCR 引物(上海生工生物工程公司);β-actin单克隆抗体、Fas单克隆抗体 (anti-Rat)、蛋白 Marker(美国Newmarker公司);碘化丙啶、Annexin V-FITC (奥地利Bender MedSystems公司);流式细胞仪(EpicsALtra,美国Beckman CouLter公司)。
1.3SD大鼠椎间盘细胞分离和培养按Cui et al[4]培养方法,10%水合氯醛麻醉SD大鼠,取L3-L6 椎间盘,显微镜下分离取出内层纤维环 +髓核交界区组织,PBS缓冲液冲洗、切碎、转移、胰蛋白酶消化、过滤、离心,最后以1×106/ml 在37 ℃、5%CO2培养箱中培养,鉴定结果见图1。
1.4细胞准备和siRNA转染
1.4.1Fas-siRNA序列 采用已被验证能有效沉默Fas mRNA的序列:ACCAAAUGCAAGAAACAAA dTdT(正义链) dTdT UGGUUUACGUUCUUUGUUU(反义链)[5]。
1.4.2转染细胞 转染前1 d将铺满培养瓶 80%~90%原代SD大鼠椎间盘细胞进行传代,以2×105~4×105/孔的密度接种于6孔板中。采用Lipofectamine 2000+ Opti MEM I脂质体转染法转染。采用阴性对照siRNA,转染后48 h培养基更换培养基,在37 ℃、5%CO2培养箱中培养。
1.5实验分组及细胞处理
1.5.1IL-1β(10 ng/ml)在不同时间点对阴性siRNA转染的大鼠椎间盘细胞Fas表达的影响 转染后48 h的椎间盘细胞,共设5组均更换为1% FBS培养基,加10 ng/ml IL-1β分别培养0、4、8、16、32 h, RT-PCR检测Fas mRNA表达,Western blot检测Fas蛋白表达水平。
1.5.2IL-1β刺激后的椎间盘细胞与FasL共培养后Fas表达及凋亡情况观察 转染后48 h的椎间盘细胞分为5组: N:作为对照组,阴性对照siRNA转染细胞不加FasL培养在1%FBS培养基中(在8 h后重新更换1%FBS培养基);N-20 ng:阴性对照siRNA转染细胞加1%FBS培养基中培养8 h后,重新更换1%FBS培养基,加入终浓度为20 ng/ml FasL;N-IL:阴性对照siRNA转染细胞与10 ng/ml IL-1β预培养8 h后(1%FBS培养基),重新更换1%FBS培养基,加入终浓度为20 ng/ml FasL;Si-20 ng:Fas-siRNA转染细胞加1%FBS培养基中培养8 h后,重新更换1%FBS培养基,加入终浓度为20 ng/ml FasL;Si-IL:Fas-siRNA转染细胞与10 ng/ml IL-1β预培养8 h后(1%FBS培养基),重新更换1%FBS培养基,加入终浓度为20 ng/ml FasL;加入终浓度为20 ng/ml FasL后再共培养24 h。即siRNA转染后80 h后,细胞进行Annexin V-FITC/碘化丙啶双染或提取总RNA和总蛋白,分别检测以下指标。同时采用Hochest 33258染色评估细胞凋亡情况,以相互验证细胞凋亡评测情况。
1.6检测指标及方法
1.6.1RT-PCR检测Fas的mRNA表达水平 TRIzoL法提取总RNA,两步法RT-PCR进行扩增,收集PCR产物用于琼脂糖凝胶电泳,凝胶成像系统进行拍照,图像分析软件进行光密度扫描分析。Fas上、下游引物为5′-GCATCTTTGAGGGTTTGGA-3′,5′-CATTTGGTGTTGCTGGTTC-3′;退火温度50 ℃,产物长度409 bp。
1.6.2Western blot检测Fas的蛋白表达水平 于各时间点用RIPA裂解液分别提取总蛋白备用;制备凝胶、上样、电泳、转膜;免疫杂交:转膜后PVDF膜孵育Fas一抗4 ℃过夜 (稀释度均为1 ∶1 000);1×PBST洗涤,室温孵育β-actin二抗(抗稀释度1 ∶1 000) 1 h;曝光显影、照像留底;图像分析系统计算条带的灰度×面积值。各组Fas条带值同相应的β-actin条带值的比值表示目的蛋白的表达水平。
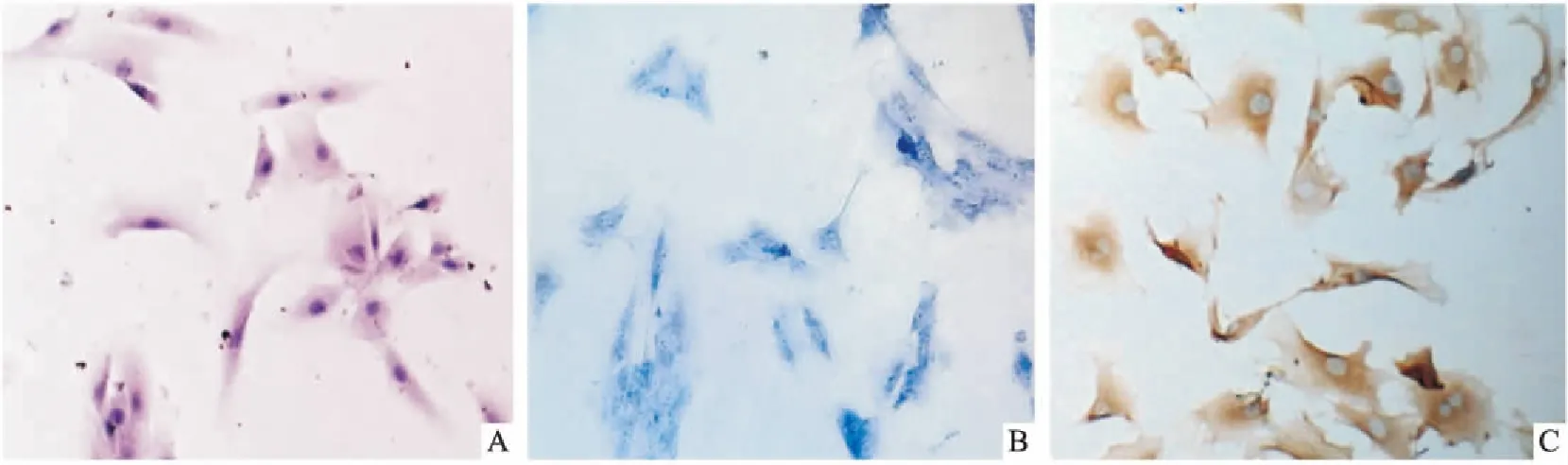
图1 原代内层纤维环+纤维环与髓核交界区细胞鉴定 ×100
A:HE染色显示细胞呈多角形或短梭形,核为圆形或椭圆形,位于胞质中央,呈蓝紫色;B:甲苯胺兰染色显示基质蓝染,核仁亦呈蓝色着色;C:Ⅱ型胶原免疫细胞化学染色显示细胞质染成棕黄色,细胞核基本不着色
1.6.3流式细胞仪测定细胞凋亡率 用Annexin V-FITC/碘化丙啶双染,流式细胞仪分析凋亡率。胰酶消化收集细胞,PBS 洗涤2次,离心收集全部细胞,每管加入膜联蛋白结合缓冲液 195 μl,5 μl Annexin V-FITC 混匀后,再加入10 μl 碘化丙啶,混匀,避光、室温反应5 min,EpicsALtra流式细胞仪分析得到细胞凋亡率。

2 结果
2.1IL-1β(10ng/ml)在不同时间点对阴性对照siRNA转染的大鼠椎间盘细胞Fas表达的影响RT-PCR结果显示,10 ng/ml的IL-1β和阴性对照siRNA转染的大鼠椎间盘细胞共培养,在4 h开始Fas mRNA就有所上调,但仅32 h时和对照相比有统计学差异(图2)。Western blot法检测Fas蛋白表达水平无明显差异,可见 10 ng/ml的IL-1β对阴性对照siRNA转染的大鼠椎间盘细胞Fas蛋白表达影响作用不明显。

图2 RT-PCR法检测IL-1β(10ng/ml)在不同时间点对阴性对照siRNA转染的大鼠椎间盘细胞Fas mRNA表达的影响
2.2IL-1β刺激后的椎间盘细胞与FasL共培养后Fas表达及凋亡情况
2.2.1RT-PCR检测Fas 的mRNA表达水平 10 ng/ml IL-1β刺激8 h后,和20 ng/ml FasL共培养24 h,RT-PCR检测结果显示,Si-20 ng、Si-IL组较对照组Fas mRNA的表达分别降低了70%、40.6%;而N-20 ng、N-IL组较对照组Fas mRNA的表达均升高,分别是对照组的1.53倍、1.99倍。各组之间比较差异均有统计学意义(图3) (P<0.05)。
图3 RT-PCR检测FasL对转染细胞Fas mRNA的表达影响
2.2.2Western blot检测Fas的蛋白表达水平 10 ng/ml IL-1β刺激8 h后,和20 ng/ml FasL共培养24 h,Western blot检测结果显示,Si-20 ng、Si-IL组较对照组Fas 蛋白的表达分别降低了37.8%、25.8%;而N-20 ng、N-IL组较对照组Fas 蛋白的表达均升高,分别是27.9%、37.2%。 Si-20 ng、Si-IL、N-20 ng、N-IL组与对照组之间比较差异均有统计学意义(图4、表1),结果与RT-PCR结果相一致。

图4 Western blot法检测FasL对转染细胞Fas 蛋白表达变化的影响

表1 Western blot检测Fas的蛋白表达水平的组间比较统计分析结果
与N组比较:*P<0.05;与Si-IL组比较:#P<0.05
2.2.3流式细胞仪测定细胞凋亡率 Fas-siRNA转染后的细胞Si-20 ng、Si-IL组较相同FasL浓度共培养的N-20 ng、N-IL组凋亡率明显降低(图5);但Fas-siRNA转染后的细胞Si-20 ng组与Si-IL组之间、Si-20 ng组与对照组之间细胞凋亡率统计分析仍然存在差异 (表2)。
3 讨论
既往研究[5-9]表明,Fas/FasL凋亡系统是椎间盘细胞的主要凋亡途径,并且该凋亡途径的启动是受多种因素影响的。Fas、FasL的表达部位(正常/非正常)、表达形态(膜态还是可溶性态)、表达水平、二者的多态性,细胞所处的微环境状态、是否有外源因子的存在等等都有可能导致启动结果的不同。本实验结果也支持这一观点。实验显示,在两组未沉默Fas基因的椎间盘细胞中,经IL-1β预处理的细胞较未经IL-1β预处理的细胞凋亡率明显增高,差异有统计学意义;而在两组沉默Fas基因的椎间盘细胞中,经IL-1β预处理的细胞较未经IL-1β预处理的细胞凋亡率增高幅度明显减小,两组的细胞凋亡率差异无统计学意义。同时,作者还发现,椎间盘细胞与FasL共培养,无论是否沉默Fas基因,其细胞凋亡率和对照组比较均有升高,而未沉默 Fas基因的椎间盘细胞凋亡率升高更明显;使用RT-PCR和Western blot分别在mRNA 和蛋白两个水平检测到Fas的表达变化与椎间盘细胞的这种凋亡率具有明显相关性。但是,本研究显示,用10 ng/ml IL-1β和阴性对照siRNA转染的大鼠椎间盘细胞进行共培养,在8 h时Fas mRNA和蛋白检测却都没有发现明显上调;而与FasL共培养后,椎间盘细胞的Fas表达反而升高。这一现象表明椎间盘细胞在经IL-1β预处理后的确增加了对FasL应答的敏感性,但导致这种凋亡敏感性增加的确切机制尚不明确。该结果同时也再次验证了FasL具有上调椎间盘细胞凋亡受体Fas表达的作用[5]。
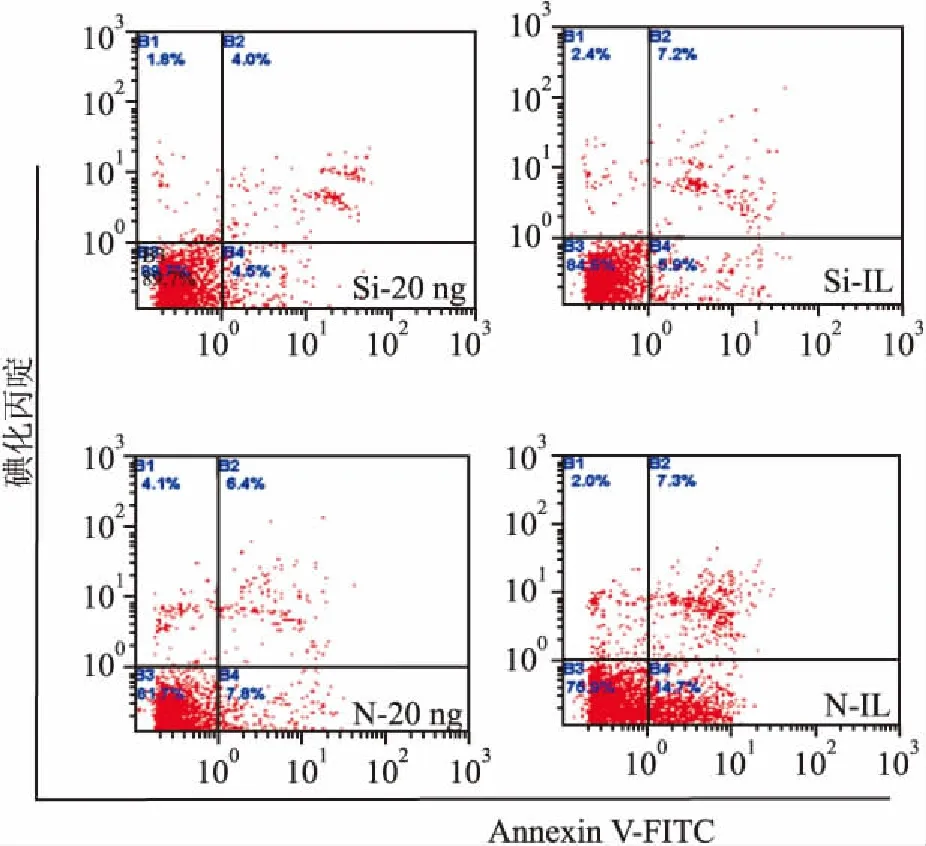
图5 流式细胞仪检测FasL对转染细胞凋亡率的影响

表2 流式细胞仪测定细胞凋亡率
与N组比较:*P<0.05;与Si-IL组比较:#P<0.05
实验中通过对Fas mRNA和蛋白表达结果检测虽未能完全明确经IL-1β预处理后增加了对FasL应答敏感性的确切机制。但这一结果提示了IL-1β可能是通过改变Fas受体的应答状态而不是上调Fas受体的表达而增加椎间盘细胞对FasL凋亡应答敏感性的,正是这种Fas受体应答状态的变化导致了椎间盘细胞在低水平的FasL作用下就会产生高水平的凋亡。而后期细胞凋亡的增加则是凋亡受体Fas表达增加的原因,因为FasL本身就具有上调Fas表达的作用。但这种凋亡敏感性可被Fas-siRNA所抑制。这就为利用RNA干扰的方法抑制椎间盘退变性疾病提供了可能。
Fas的表达易受各种因素影响,异常机械应力、过度负荷、创伤等均可上调Fas的表达水平从而增加了椎间盘细胞的过度凋亡[10-12]。综合以前研究结果显示,IL-1β不仅能够上调Fas的表达水平,而且可以改变Fas受体应答状态,从而产生超常的凋亡作用,导致椎间盘组织中细胞数量的减少。本实验从另一个侧面说明了炎性环境对椎间盘细胞超常凋亡的加速作用[8]。减轻或者抑制椎间盘部位的炎性反应对延缓椎间盘退变可能有着重要作用。
