磁共振声辐射力成像技术研究进展
2019-02-21许宗为乔阳紫赵书俊
许宗为,乔阳紫,邹 超,刘 新,赵书俊
(1.郑州大学物理工程学院,河南 郑州 450001;2.中国科学院深圳先进技术研究院生物医学与健康工程研究所保罗·C·劳特伯生物医学成像研究中心,广东 深圳 518055)
声辐射力脉冲(acoustic radiation force impulse, ARFI)成像技术利用脉冲式聚焦超声的辐射力,使生物黏弹性组织局部区域产生微米级位移,通过接收到的超声射频信号计算位移,从而间接反映组织弹性变化[1-2]。1998年,Sarvazyan等[3]报道,通过检测到的MRI信号相位变化,可对声辐射力引起的组织局部位移进行估算。2008年,McDannold等[4]首次提出磁共振声辐射力成像(magnetic resonance acoustic radiation force imaging, MR-ARFI)概念,并将其用于定位高强度聚焦超声(high intensity focused ultrasound, HIFU)的焦点。作为一种新兴的HIFU治疗监控技术,MR-ARFI能够通过探测组织内的微小位移而间接反映组织弹性,具有安全、简便、无须其他激励装置等优点。本文对MR-ARFI技术的原理、相关序列及其应用的研究进展进行综述。
1 MR-ARFI的原理
在MR序列中添加运动编码梯度,可将组织中氢质子的宏观位移转化为质子共振频率的改变量,在MR相位图中产生累积相位(Δφ)[5]。
(1)

在典型的MR-ARFI序列(图1)中,运动编码梯度在回聚脉冲前后各施加1次,2次的持续时间和幅度完全相同。HIFU脉冲只在其中一段时间施加。不受HIFU作用的静止组织的相位由于回聚脉冲作用而被抵消为0;在HIFU焦域附近,脉冲作用引起组织位移,质子由位置x0快速到达稳定位置x0+Δx,因此会累积相位[4]。根据图像相位差,可对组织内HIFU引起的位移进行定量。
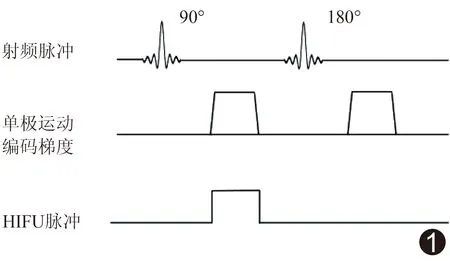
图1 典型的MR-ARFI序列 运动编码梯度在回聚脉冲前后各施加1次,2次的持续时间和幅度完全相同;HIFU脉冲只在其中一段时间施加
Δφ=γGeτΔxcosα
(2)
其中,γ为旋磁比,Δx为组织位移,α为运动编码梯度向量和位移之间的夹角,Ge为运动编码梯度幅值,乙为运动编码时间。
2 常见的MR-ARFI序列
2.1 基于 SE序列的MR-ARFI SE序列是经典的MR序列,该序列被90°脉冲激发后,可利用180°聚焦脉冲抵消横向磁化矢量的衰减,具有较高的SNR[6]。


图2 基于一维SE序列的MR-ARFI扫描示意图 90°激发平面与180°回聚平面的重叠部分(即黑色菱形部分)是能够被采集的信号
2.1.2 二维SE成像序列 二维SE成像序列在MR-ARFI中应用最广泛,其优点是具有良好的SNR,对磁场的不均匀度敏感性低;但该序列采集时间较长,对运动敏感。Paquin等[7]提出将动态对比增强成像中的k空间共享技术——匙孔引入MR-ARFI,通过降低相位编码采集线数,加速序列采集过程,认为匙孔技术可在实现快速、无畸变的位移检测的同时降低HIFU能量沉积,并显著提高图像的SNR。
2.1.3 三维SE成像序列 目前的三维SE成像序列主要是与不对称的双极运动编码梯度相结合,实现安全、快速的三维位移成像及HIFU精准定焦[8]。三维SE序列图像采集是针对整个容积进行激发和采集,在SNR方面具有明显优势;但由于采集时间较长,对运动更敏感。三维SE成像需要多次HIFU脉冲激励,如何保证HIFU定焦过程中的安全性,避免引起不必要的温度升高是需要考虑的问题。de Bever等[8]在三维SE序列图像采集过程中使用KZRF的欠采技术,使组织温度升高幅度降低51%。

2.3 平面回波成像(echo planar imaging, EPI)快速采集序列 由于EPI采集速度非常快,SE-EPI或GRE-EPI序列特别适用于快速图像反馈,如颅脑内焦点定位。Hertzberg等[12]对比GRE-EPI与一维SE序列的成像速度,发现同等条件下一维SE序列线性扫描需要31 s,GRE-EPI扫描仅需1 s。此外,采用EPI的MR-ARFI序列所需的HIFU能量沉积较小,Kaye等[13]使用SE-EPI序列以焦点声强为620 W/cm2的HIFU脉冲激励,3 000次MR-ARFI采集仅在体模内引起4℃的温度升高。虽然EPI序列的采集速度很快,但伪影种类很多,图像畸变严重,且EPI的 TE为k空间中心线的TE,时程长,导致图像分辨率及SNR降低[14]。将EPI采集与并行成像技术相结合,在相位编码方向可将 FOV缩小至原来的1/2甚至1/4,有效抑制图像畸变、提高图像SNR。
2.4 基于平衡稳态自由进动(balanced steady-state free precession, bSSFP)序列的MR-ARFI Zheng等[15]将运动编码梯度插入到MR-ARFI的bSSFP序列中,利用在bSSFP过渡带中图像相位的放大效应,将微小位移引起的相位变化放大,使ARFI序列对组织位移的敏感度提高。bSSFP序列将超声脉冲缩短至1.45 ms,在测量过程中未见温度显著升高。但是,该序列对磁场的均匀性要求较高,且对运动敏感。
3 MR-ARFI的应用
3.1 焦点定位 焦点区域存在明显的组织位移,通过计算相位差可获得组织位移图,即焦点定位。应用MR-ARFI进行焦点定位的可行性已在羊肝[9]、小鼠[16]等在体实验中得到验证。基于MR的焦点定位技术还包括MR温度成像(MR thermometry, MRT)。MRT是通过温度升高改变质子共振频率的相位成像技术[17],需要施加一个较大的HIFU功率以引起局部温度变化,对组织有一定损伤,且易受到运动和磁化率伪影等因素的干扰。
3.2 HIFU自动对焦 经颅聚焦超声是很有前景的治疗脑部疾病的无创技术,然而声波通过颅骨时路径会发生改变(焦点偏移),影响治疗效果。目前常采用CT检测颅骨厚度,以相关声参数[18]来评估相控阵阵元间的相位偏移,以此判断焦点偏移,并对超声焦点进行矫正。但CT具有辐射性,且X射线传播与超声传播的差异使矫正结果并不完全准确。
MRI-ARFI偏移矫正的基本假设是能量与检测到的组织位移之间存在线性关系,通过振元的相位控制使焦点位移达到最大,即认为由颅骨造成的声反射、折射等均已得到校正。Hertzberg等[12]以人颅骨覆盖的体模为研究对象,经CT参数矫正后,焦点的最大位移增加8%,经MR-ARFI调整后焦点位移增加27%。Marsac等[19]以尸体为研究对象,对头颅进行偏移矫正,证实基于MR-ARFI的偏移矫正可获得比基于X线矫正高1.5倍的声强。Liu等[20]使用随机测量的优化技术降低MR-ARFI的经颅校准次数,使校准过程更快。
3.3 弹性检测 传统医学的触诊是通过触摸组织的软硬度来判断病变弹性[2]。MR-ARFI利用声辐射力,通过探测组织内位移的改变来反映组织弹性变化,间接判断是否有硬块存在。经过偏移矫正之后的MR-ARFI可探测到脑组织的钙化点。脑组织存在钙化可导致局部能量异常吸收,引起钙化点组织截面温度升高[19]。在传统GRE T2WI上,钙化点和脑出血点均表现为高信号,难以区分。Bitton等[21]提出,将MR-ARFI与SWI序列结合,先通过SWI确定钙化点的位置区间,再对该区域进行MR-ARFI扫描,由于钙化点位移比周围组织大,可进一步确定钙化点位置。Bitton等[22]对尸体胸部组织进行HIFU加热,并采用MR-ARFI检测组织弹性,结果显示胸部组织的最大位移由加热前的(4.41±1.48)μm减小至(1.99±0.82)μm。Vappou等[23]以HIFU对离体猪肉组织进行加热,数秒后组织弹性模量出现不可逆性增大。
3.4 其他 Auboiroux等[9,24]使用GRE-EPI序列同时实现MR-ARFI和MRT检测。Kaye等[25]在90°和180°射频脉冲之间添加1个读出梯度,在SE-ARFI中实现了MRT,但是额外添加的编码梯度可能增加不必要的扩散效应[6],影响图像SNR。Liu等[16]在7.0T场强下采用双极性的SE序列实现了对组织位移及剪切波的同时测量,其中剪切波对于评价组织病变程度及HIFU治疗效果具有重要意义。
4 问题与展望
MR-ARFI作为在HIFU治疗过程中、尤其是在HIFU经颅治疗过程中的一种重要的监控技术,已展现出巨大的潜力。MR-ARFI检测所需能量小、作用时间短、与其他射频信号无相互干扰,已成为需要精准定位、又不希望造成温度升高的过程监控的首选方法,如药物的控制释放、靶向治疗及血栓溶解等[26]。但是,MR-ARFI也存在不足,主要表现为:只能检测HIFU作用区域的组织位移;对于温度不敏感组织,与基于温度升高的定焦方法相比其优势不明显;EPI等快速成像方法存在各种类型的伪影,而SE序列成像速度较慢。相信随着HIFU治疗及MR技术的发展,上述问题将会逐步解决,MR-ARFI将在临床发挥更加重要的作用。
