艾拉莫德对类风湿关节炎外周血破骨细胞分化及破骨细胞相关基因表达的影响
2019-02-20冯佳龚书识夏燕田瑞杨年安赵小丹蔡德慧向阳袁林
冯佳 龚书识 夏燕 田瑞 杨年安 赵小丹 蔡德慧 向阳 袁林*
1. 湖北民族学院风湿性疾病发生与干预湖北省重点实验室,湖北 恩施 445000 2. 湖北民族学院附属民大医院,湖北 恩施 445000
类风湿关节炎(rheumatoid arthritis,RA)是一种以滑膜炎、软骨和骨破坏为特征的慢性炎症性自身免疫性疾病[1]。RA发病后半年内即可发生不可逆的关节滑膜损伤,并出现炎性关节附近的骨量丢失,两年内即可出现软骨下骨质的破坏及全身范围的骨量流失,逐渐发展为关节活动受限[2]。研究发现,在RA患者和CIA关节炎大鼠骨质破坏处发现大量活化的破骨细胞和成熟破骨细胞[3],提示破骨细胞的分化和成熟可能是导致RA骨破坏的重要环节。艾拉莫德(Iguratimod)是一种新型小分子缓解病情抗风湿药物[4],研究认为其通过抑制细胞免疫及体液免疫,达到治疗RA的疗效,在临床得到广泛使用。近年来发现艾拉莫德还可以改善RA患者的骨代谢状况:Shin D[5]等运用动物模型、Gan K[6]等以RAW264.7细胞模型进行研究发现艾拉莫德通过抑制核因子-κB(nuclear factor kappa B,NF-κB)的激活促进骨形成和抑制骨破坏。本研究通过观察不同浓度艾拉莫德对RA患者外周血单个核细胞(Peripheral blood mononuclear cell,PBMC)所诱导破骨细胞的分化与骨吸收的影响,探讨破骨细胞在RA骨质破坏中的作用及艾拉莫德防治RA可能的分子机制,为RA的治疗提供新途径、新思路。
1 材料与方法
1.1 病例资料
选取2017年3月至2017年10月在湖北民族学院附属民大医院风湿科住院治疗的RA患者20例,女性17例,男性3例,年龄46±14岁。诊断均符合2010年欧洲抗风湿联盟/美国风湿病协会(EULAR/ACR)分类标准。且患者均未接受过艾拉莫德治疗,均无合并严重心、肝、肾疾病、恶性肿瘤、糖尿病等疾病。本研究经医院医学伦理学委员会批准,所有研究对象均签署书面知情同意书。
1.2 药物与试剂
艾拉莫德(先声药业公司)每片25 mg,溶解在1 mL的DMSO中,使用时用1640培养基稀释。RANKL及M-CSF均购自美国Pepro Tech公司,用含10%FBS的1640培养基配成浓度为100 ng/mL RANKL和50 ng/mL M-CSF的诱导培养液。Ficoll-paque PLUS及TRAP染色试剂盒购自GE公司,RPMI 1640培养基、胎牛血清购自美国GIBCO公司,Cell Counting Kit-8(CCK-8)购自东仁化学科技有限公司,TRIzol Reagent购自Ambion公司,Prime Script RT reagent kit with gDNA Eraser(Perfect Real Time)及 SYBR Premix Ex Taq(Tli RNase H Plus)购自TaKaRa公司,引物由上海生工生物工程技术服务有限公司合成。
1.3 实验仪器
OD-1000+超微量分光光度计、LC480实时荧光定量PCR仪购自Roche公司,BX50荧光显微镜购自Olympus公司。
1.4 试验方法
1.4.1外周血单个核细胞(PBMCs)的分离及破骨细胞的诱导
采患者空腹静脉血5 mL入肝素抗凝管中,采用Ficoll密度梯度离心方法分离外周血单个核细胞,用含10%FBS的1640培养液将细胞浓度调整为2×106/mL。将收集的PBMCs细胞悬液接种于24孔培养板中,每孔加入0.5 mL悬液。在细胞培养箱培养24 h后,轻轻吸除培养孔中培养液,沿孔壁缓慢加入0.5 mL诱导培养液,隔两天换1次诱导培养液,连续培养14天。
1.4.2破骨细胞的鉴定
显微镜下观察贴壁细胞的生长形态、细胞分化融合形成多核细胞的情况。按照TRAP 染色试剂盒说明书进行染色。显微镜下观察含有3个及以上细胞核且TRAP染色阳性的多核巨细胞为破骨细胞。200倍光镜下随机选l0个视野,计数破骨细胞数量,结果用个/10个视野表示,每孔重复计数3次,取其均数。
1.4.3CCK-8 检测艾拉莫德对PBMC的毒性作用
将分离的RA患者PBMCs 用培养液配制成5×105/mL的细胞悬液,接种于96孔培养板中,37 ℃,5%CO2培养箱中培养过夜。待细胞贴壁后,去除培养基,分别加入含不同浓度艾拉莫德的培养基各100 μL,在培养24、48、72 h后,向每孔中加入10 μL CCK-8溶液,将培养板在培养箱内孵育1.5 h。用酶标仪测定各组在450 nm波长处的吸光度OD值,计算细胞活力。
1.4.4艾拉莫德对RA患者PBMC生成破骨细胞的影响
将收集的RA患者PBMCs配制成2×106/mL细胞悬液,接种于24孔培养板中,每孔加入0.5 mL,37 ℃,5%CO2培养箱内培养24 h。分为4组:对照组、艾拉莫德25μg/mL实验组、艾拉莫德12.5μg/mL实验组、艾拉莫德6.25μg/mL实验组,艾拉莫德各实验组加入含不同浓度艾拉莫德的诱导培养液培养,对照组为不含艾拉莫德的诱导培养液,隔两天换1次诱导培养液,连续培养14天。TRAP染色。
1.4.5艾拉莫德对RA患者外周血破骨细胞TRAP、CTSK、RANK、AP-1 mRNA表达的影响
收集各组细胞,按照TRIzol Reagent说明书提取RNA,测定RNA纯度及浓度,A260/A280比值为1.8~2.0。合成cDNA: 5×gDNA Eraser Buffer 2 μL、gDNAEraser 1 μL、总RNA 1μg,42 ℃ 2 min; 5 × Prime Script Buffer 4 μL、Prime Script RT Enzyme Mix I 1 μL、RT Primer Mix 1 μL、无RNA酶dH2O 4 μL,37 ℃ 15 min,85 ℃ 5s; cDNA储存于-20 ℃。实时荧光定量RCP检测TRAP、CTSK、RANK、AP-1 mRNA的表达,GAPDH为内参基因。反应体系10 μL:SYBR Premix Ex Taq 5 μL、上游引物0.3 μL、下游引物0.3 μL、模板1 μL、dH2O 3.4 μL。反应条件:95 ℃ 预变性30 s、95 ℃变性5 s、55 ℃退火30 s、72 ℃延伸30 s,40个循环。基因表达量以2-△△CT表示实验组目的基因表达相对于对照组变化的倍数。
1.4.6统计学分析
2 结果
2.1 破骨细胞诱导形态学观察
PBMCS培养24 h后,部分细胞贴壁,为单核细胞(见图1 A);诱导培养第3天,出现少数单个核成纤维样细胞生长(见图1B);培养第8天,成纤维样细胞明显增多,可见少数多核细胞,圆形或不规则形(见图1C);培养第14天出现较多多核细胞,胞体较其他细胞大,折光性强,形似油煎蛋形样或长条状(见图1D)。

图1 显微镜下细胞形态观察(200×)A: 24小时 B: 第 3 天 C: 第 8 天D: 第14天Fig.1 Observation of the cell morphology (200×)A: 24 h; B: the 3nd day; C: the 8th day; D: the 14th day
2.2 破骨细胞鉴定结果
将诱导培养14天的细胞进行TRAP染色,显微镜下可见大量多核细胞, 胞核3~20个不等,胞质内有紫红色颗粒样沉淀,即为破骨细胞。(见图2)

图2 破骨细胞 TRAP 染色(A: 100倍 B: 200倍)Fig.2 TRAP staining of the osteoclasts (A: 100×; B: 200×)
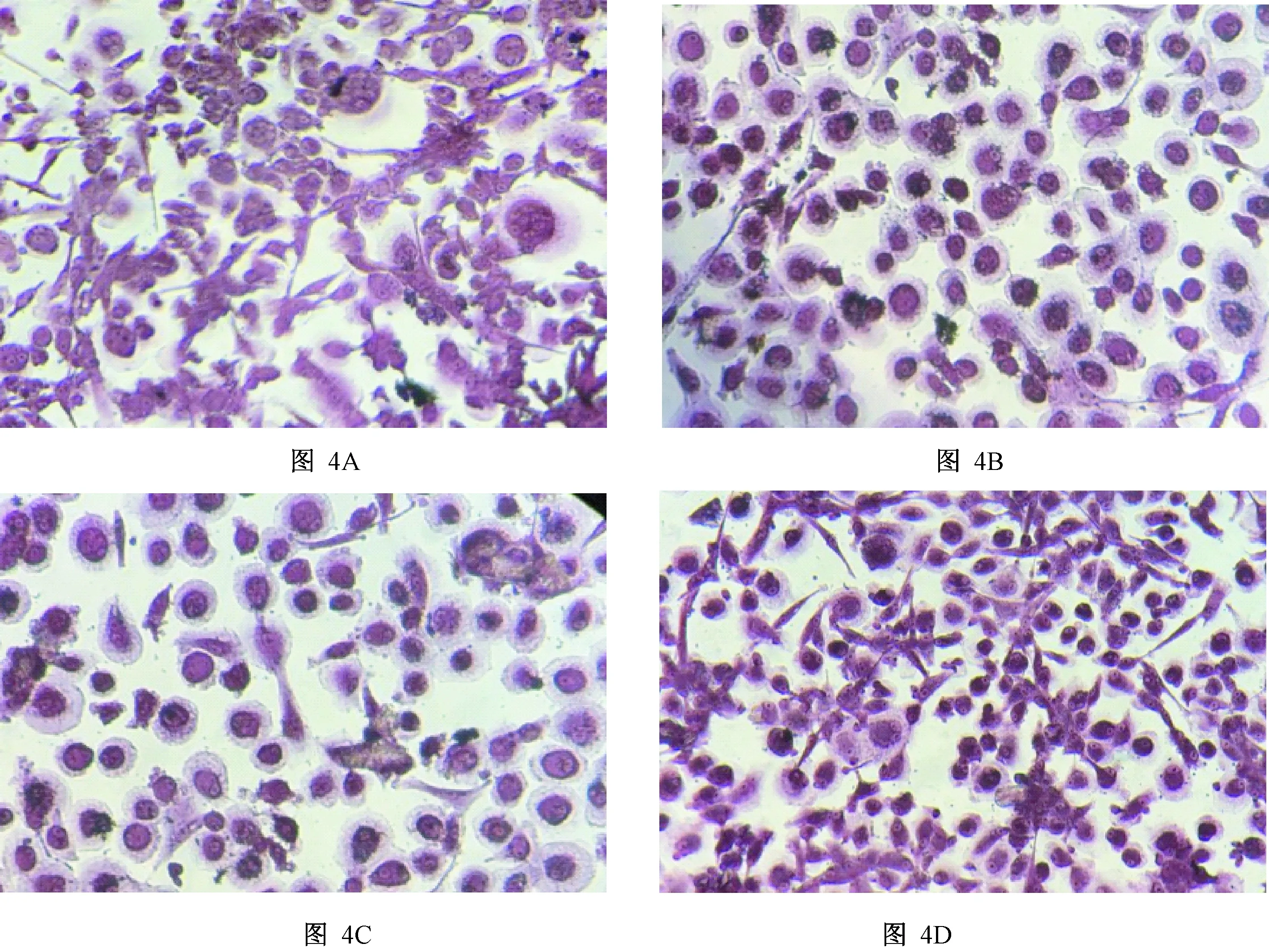
图4 不同浓度艾拉莫德对RA患者破骨细胞的影响A.对照组;B.艾拉莫德25μg/mL组;C.艾拉莫德12.5μg/mL组;D.艾拉莫德6.25μg/mL组Fig.4 Effects of different concentrations of Iguratimod on osteoclasts in RA patientsA. Control Group; B. Iguratimod 25μg/mL Group; C. Iguratimod 12.5μg/mL Group; D. Iguratimod 6.25μg/mLGroup
2.3 艾拉莫德对PBMCs的毒性作用
CCK-8检测结果显示艾拉莫德25μg/mL、12.5μg/mL、6.25μg/mL三个浓度对PBMCs细胞活力无明显影响(图3所示)。
2.4 艾拉莫德对RA患者PBMCs生成破骨细胞的影响
不同浓度艾拉莫德干预RA患者PBMCs生成破骨细胞,结果显示艾拉莫德6.25 μg/mL组、12.5 μg/mL组、25 μg/mL组的破骨细胞数量均明显低于对照组(P<0.05)。(图4,图5所示)

图3 艾拉莫德对PBMCs细胞活力的影响Fig.3 The effect of Iguratimod on the activity of PBMCs
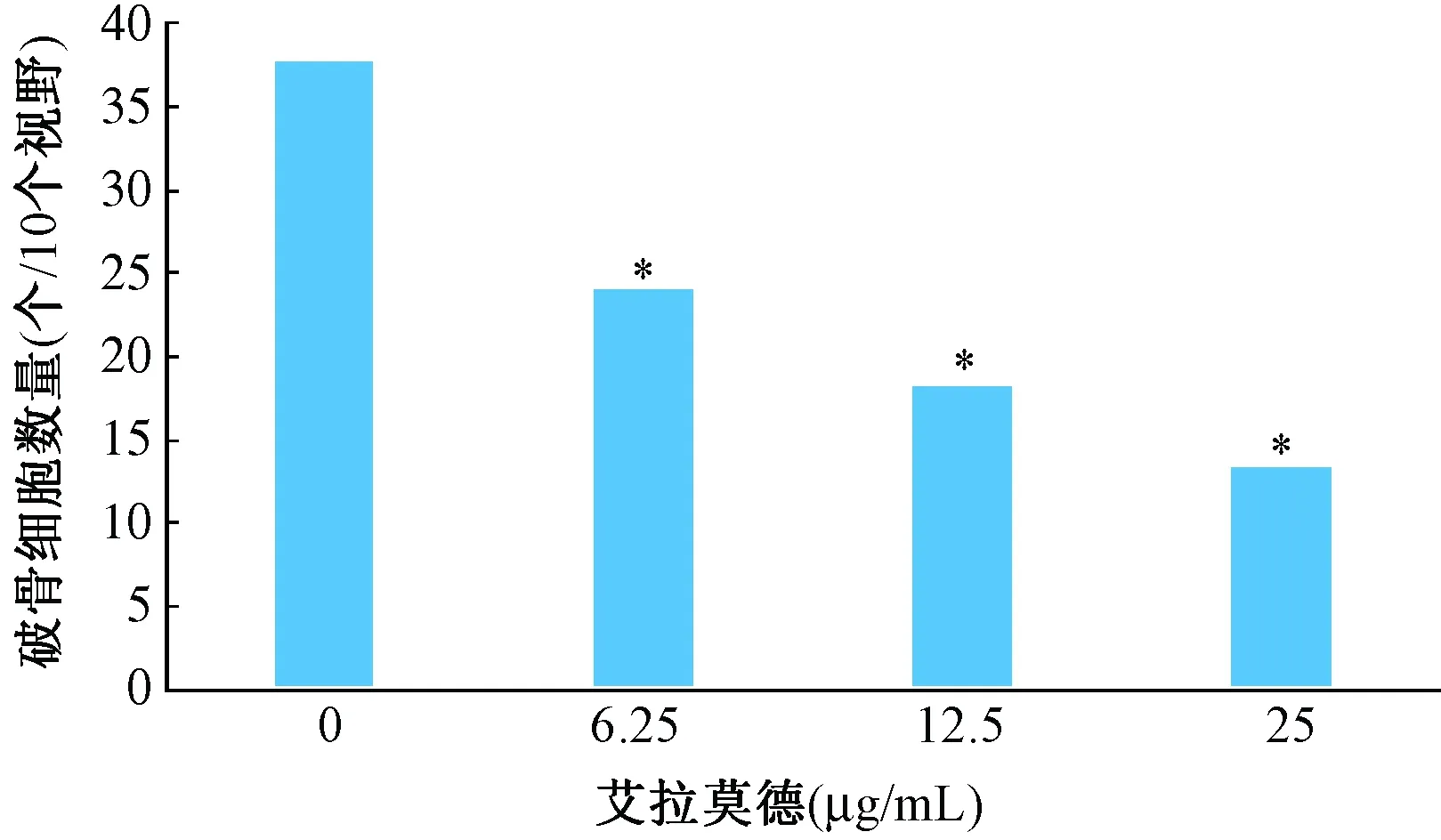
图5 艾拉莫德对RA患者破骨细胞数量的影响注:* P<0.05Fig.5 The effect of Iguratimod on the number of osteoclasts in RA patients. Note:* P<0.05
2.5 艾拉莫德对RA患者外周血破骨细胞TRAP、CTSK、RANK、AP-1 mRNA表达的影响
艾拉莫德6.25 μg/mL组、12.5 μg/mL组、25 μg/mL组破骨细胞TRAP mRNA表达分别为对照组的0.4271、0.1468、0.1306倍;CTSK mRNA表达分别为对照组的0.812、0.106、0.0957倍;RANK mRNA表达分别为对照组的0.891、0.538、0.411倍;AP-1 mRNA表达分别为对照组的0.736、0.1083、0.0957倍。说明艾拉莫德能抑制TRAP、CTSK、RANK、AP-1 mRNA的表达水平,且随艾拉莫德浓度的升高抑制作用越明显,与对照组相比,差异均具有统计学意义(P<0.05)。(图6所示)

图6 艾拉莫德对RA患者外周血破骨细胞相关基因表达的影响A.TRAP mRNA B.CTSK mRNA C.RANK mRNA D.AP-1 mRNA注:*P<0.05Fig.6 Effect of Iguratimod on the expression of osteoclast-related genes in RA patientsA. TRAP mRNA; B. CTSK mRNA; C. RANK mRNA; D. AP-1 mRNANote:*P<0.05
3 讨论
骨侵蚀是RA的主要特征,而破骨细胞是骨侵蚀发生的关键环节[7]。破骨细胞是一种终末分化的多核巨噬细胞,来源于单核/巨噬细胞系统[8]。单核巨噬破骨细胞前体细胞和部分外周血单核细胞在骨组织中被激活,聚集并粘附于骨表面, 各种细胞因子和自身抗体刺激破骨细胞的活化,并通过分泌酸和溶解酶来降解骨基质, 从而促进骨吸收[9]。RANKL和M-CSF是破骨细胞形成的主要细胞因子,RANKL调节破骨细胞的分化和激活,促进破骨细胞迁移;M-CSF与受体c-fsm结合,促进破骨前体细胞的再生[10]。TRAP是破骨细胞特有的一种酶,破骨细胞溶酶体膜有较高的TRAP作用,在含酒石酸的酸性条件下,将产生的萘酚磷酸盐水解物与染色剂结合,在酶的活性部位形成不溶的红色沉淀,TRAP染色阳性为破骨细胞的典型标志[11]。研究发现[12]RA患者外周血生成破骨细胞的数量显著高于健康对照组,RA患者的骨吸收活性也明显高于对照组,认为外周血破骨细胞可能是反映RA患者关节骨质破坏的重要指标。本实验使用100 ng/mL RANKL和50 ng/mL M-CSF诱导破骨细胞的形成, 在第8天出现少数多核细胞,第14天出现较多多核细胞,TRAP染色阳性,成功将RA患者PBMCs诱导为破骨细胞。
艾拉莫德是由国家食品药品监督管理局临床批准的Ⅰ类新药,用于治疗成人活动性RA[13]。多项基础研究发现,艾拉莫德通过抑制与RA病情活动密切相关的促炎因子,起到控制RA及RA引起骨流失的双重效果,艾拉莫德还能显著抑制CIA大鼠模型骨吸收和关节破坏,证实艾拉莫德具有减轻RA骨破坏的作用[14]。本实验使用不同浓度艾拉莫德作用于PBMCs,发现艾拉莫德25 μg/mL、12.5 μg/mL、6.25 μg/mL三个浓度对PBMCs细胞无明显细胞毒性作用,在此基础上,使用上述三个浓度艾拉莫德干预RA患者PBMCs生成破骨细胞,结果显示艾拉莫德实验组均能抑制破骨细胞的生成,其中艾拉莫德25 μg/mL组抑制作用最为显著。
Rank是肿瘤坏死因子受体超家族成员之一,表达于破骨细胞及前体细胞膜表面,与成骨细胞产生的RANKL结合,启动下游信号转导,刺激破骨细胞前体细胞分化为破骨细胞,促进骨吸收。转录因子AP-1是破骨细胞分化的主要调节因子[15],调整破骨细胞相关基因的表达,如TRAP, CTSK等,在破骨细胞活化中起重要作用[16]。研究表明RA患者破骨细胞活性增加对全身性骨量丢失发挥着重要作用[17]。本实验通过观察不同浓度艾拉莫德对RA患者外周血破骨细胞相关基因表达的影响,发现艾拉莫德能抑制TRAP、CTSK、RANK、AP-1 mRNA的表达水平,且随艾拉莫德浓度的升高抑制作用越明显,与显微镜下观察结果一致。
综上,艾拉莫德具有体外抑制RA患者PBMCs向破骨细胞分化的作用,能够抑制RA患者外周血破骨细胞TRAP、CTSK、RANK、AP-1 mRNA的表达,且均呈浓度依赖性。RA骨平衡的紊乱主要是由破骨细胞所驱动, 艾拉莫德通过抑制破骨细胞,阻止RA骨质破坏,成为RA临床治疗的新选择。
