表皮生长因子和表皮生长因子受体与大鼠自然妊娠和早产的关系▲
2019-02-19甘国才李慕军
甘国才 李慕军 吴 浪
(广西医科大学第一附属医院生殖医学研究中心,南宁市 530021,电子邮箱:652913935@qq.com)
早产是指妊娠满28周至不足37周分娩者,早产儿各项身体机能尚未发育成熟,易导致新生儿残疾和死亡。早产导致的新生儿死亡率高达5%~15%,其中约15%的早产儿死于新生儿期,在新生儿死亡中位居第二位[1-4]。因此,预测和预防早产,改善早产儿的预后和治疗是妇产科学的研究热点之一。目前,关于早产预测因子的研究有很多,包括宫颈评价、胎儿纤维连接蛋白、各类细胞因子、基质金属蛋白酶、胰岛素样生长因子结合蛋白、促肾上腺皮质激素释放激素和C反应蛋白等[5-6]。但尚无明确的指标及统一的标准预测早产。本研究通过建立SD大鼠妊娠和早产模型,探讨孕鼠模型血清、羊水表皮生长因子(epidermal growth factor,EGF)水平和胎盘表皮生长因子受体(epidermal growth factor receptor,EGFR)相对含量对早产的预测价值,为临床早产的预防和治疗提供参考。
1 材料和方法
1.1 实验动物 选取16只12~15周龄SD雌性大鼠和8只18~20周龄SD雄性大鼠,均购自广西医科大学实验动物中心,动物许可证号:SYXK桂2016-0005。雌鼠体质量300~380 g,雄鼠体质量450~500 g。所有大鼠均饲养在广西医科大学实验动物中心,由专门饲养员喂养,饲养温度22℃~28℃,湿度适中,保持良好的通风环境。
1.2 分组 采用数字表法将雄鼠随机分为两组,两组轮流与雌鼠交配,同一组雄鼠的两次交配间隔时间均为3 d。交配成功后,将16只SD雌性大鼠按不同孕龄分为A、B、C、D 4个组,每组4只,其中A组为中孕组(孕12 d),大鼠编号依次为A1~A4,B组为晚孕组(孕17 d),依次编号为B1~B4,C组为妊娠组(孕21 d),依次编号为C1~C4,D组为早产组(孕17 d),依次编号为D1~D4。在大鼠背部和四肢用结晶紫标记。
1.3 主要试剂和仪器 脂多糖购自北京Solarbio科技有限公司(批号:L8880);RNA保护液购自北京Solarbio科技有限公司(批号:SR0020);酶联免疫吸附测定试剂盒购自杭州联科生物技术股份有限公司(批号:239380441);RNA反转录盒购自Thermo Scientific(批号:00621709);TRIzol试剂购自Invitrogen公司(批号:180401);荧光定量PCR试剂盒购自QIAGEN(批号:154045739)。PCR仪购自美国Applied Biosystems(型号:7500)。引物的设计和生产均购自维尔凯生物科技有限公司,引物信息见表1。
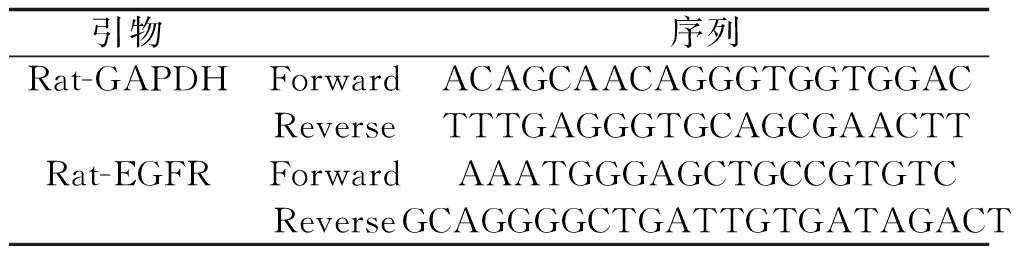
表1 引物信息
1.4 实验方法
1.4.1 造模方法及造模成功评价标准:把大鼠按雌雄2 ∶1合笼,合笼时间为18:00到第二天9:00。检查交配情况:(1)第二天9:00查看阴栓的同时进行阴道涂片,染色风干后立即进行镜下观察,若雌鼠阴道口有乳白色阴栓,或阴道涂片后可镜下观察到精子则视为交配成功;(2)在孕中期(孕10~14 d),可通过深触诊摸到雌鼠下腹部串珠样胚胎,则可视为交配成功并受孕。交配成功当天视为怀孕的第1天。早产组在孕17 d的时候,给予0.04 mg/ml脂多糖腹腔注射,注射量为400 μg/kg,每3 h观察1次,若发现阴道流液或流血则视为早产。
1.4.2 标本采集:中孕组于孕第12天、晚孕组于孕第17天、妊娠组于孕第21天、早产组于孕第17天收集胎盘、羊水及静脉血标本:在解剖孕鼠取胎盘和羊水之前,先用毛细玻璃管在孕鼠眼眶内眦静脉各取静脉血2 ml;取静脉血后,经孕鼠下腹部解剖孕鼠,用5 ml注射器各抽取羊水2 ml,然后打开子宫,取胎盘若干。获取标本后,静脉血即用干燥管收集,羊水即用15 ml离心管收集,均分别于24 h内3 500 r/min离心15 min,取上层血清,分装至若干EP管后,置于-80℃冰箱保存备用。胎盘用生理盐水冲洗,立即放入RNA保护液浸泡,于24 h后取出,置于-80℃冰箱保存备用。用于苏木精-伊红(hematoxylin-eosin,HE)染色的胎盘则立即放入10%福尔马林溶液中浸泡,并放置于4℃冰箱保存,直至行HE染色处理。
1.4.3 检测方法:采用双抗夹心法分别检测羊水和血清中的EGF水平,实验步骤严格按照试剂盒说明书进行。采用芬兰Thermo Scientific公司生产的Multiskan GO全波长酶标仪检测吸光度,绘制标准曲线后计算待测标本含量。采用实时荧光定量PCR(realtime quantitative PCR,RT-qPCR)检测各组胎盘组织中EGFR基因含量,采用美国Applied Biosystems公司生产的PCR仪(型号:7500)检测样本中EGFR的相对表达量,采用2-ΔΔCt法计算相对定量结果。2-ΔΔCt值反映各样品相对空白组样品目的基因的相对表达水平:ΔCt=目的基因Ct值-内参基因Ct值;ΔΔCt=各样品ΔCt值-空白组ΔCt值的平均值。
1.5 统计学分析 采用SPSS 22.0 软件进行统计分析。计量资料以(x±s)表示,多组间比较采用方差分析,相关性分析采用Pearson相关分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 胎盘HE染色结果 早产组和妊娠组可见明显的血管充血,在早产组中血管之间和绒毛之间可见明显的炎症细胞浸润,表现出绒毛膜炎的病理改变。中孕组和晚孕组血管充血不明显,中孕组可见硕大的滋养叶细胞。见图1~4。
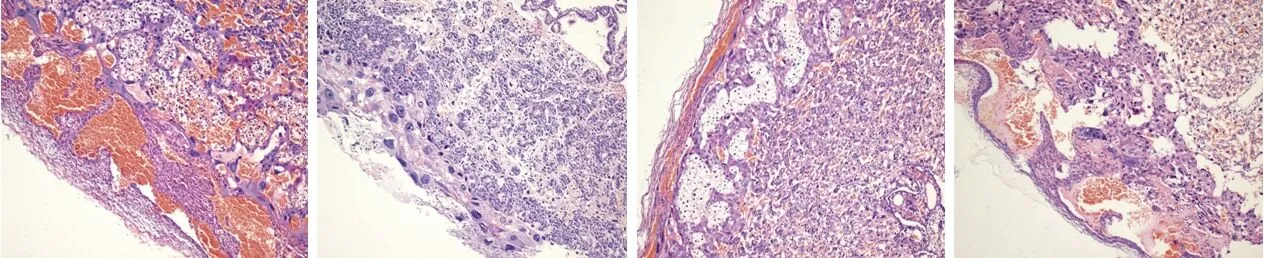

图1 早产组(HE染色,×10)图2 中孕组(HE染色,×10)图3 晚孕组(HE染色,×10)图4 妊娠组(HE染色,×10)
2.2 4组大鼠血清和羊水EGF水平比较 4组大鼠血清EGF水平比较,差异有统计学意义(P<0.05),其中妊娠组血清EGF水平均高于早产组、中孕组和晚孕组(均P<0.05),早产组、中孕组和晚孕组比较,差异均无统计学意义(均P>0.05)。4组大鼠羊水EGF水平比较,差异有统计学意义(P<0.05),其中早产组和中孕组均低于晚孕组和妊娠组(均P<0.05),但早产组和中孕组比较、晚孕组和妊娠组比较,差异均无统计学意义(均P>0.05)。见表2。
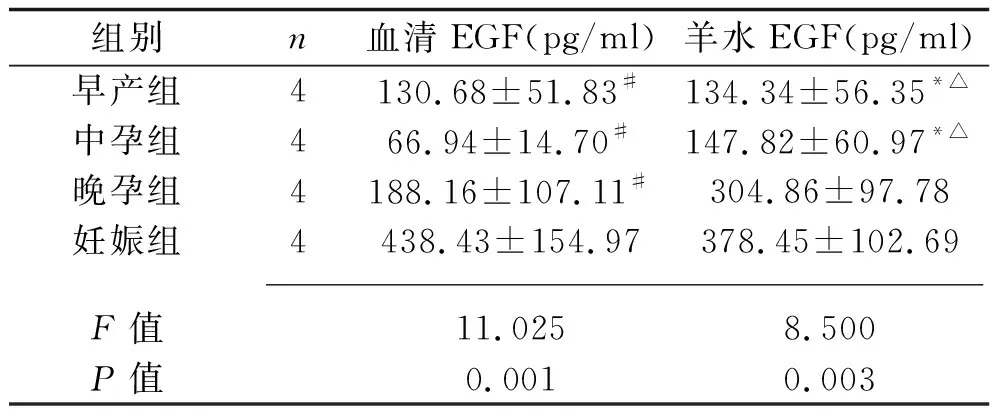
表2 4组大鼠血清、羊水EGF水平比较(x±s)
注:与妊娠组比较,#P<0.05;与晚孕组比较,*P<0.05;与妊娠组比较,△P<0.05。
2.3 4组大鼠胎盘EGFR相对表达量比较 4组的胎盘EGFR相对表达量比较,差异有统计学意义(P<0.05),其中妊娠组均高于早产组、中孕组和晚孕组(均P<0.05),但早产组、中孕组和晚孕组比较,差异均无统计学意义(均P>0.05)。见表3。
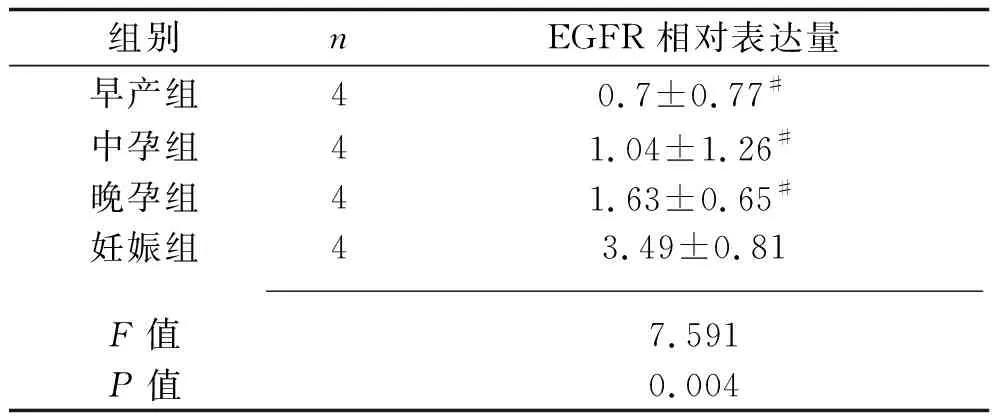
表3 4组大鼠EGFR相对表达量比较(x±s)
注:与妊娠组比较,#P<0.05。
2.4 血清、羊水EGF及胎盘EGFR的相关性分析 大鼠胎盘EGFR相对表达量与血清EGF水平呈正相关(r=0.759,P=0.001),与羊水EGF水平也呈正相关(r=0.590,P=0.016);血清EGF水平与羊水EGF水平呈正相关(r=0.570,P=0.021)。
3 讨 论
早产是引起新生儿死亡的主要原因之一[7],部分发达国家中,约75%的新生儿第一个月的死因为早产[8],因此,如何科学准确地预测早产是当前妇产科医生面临的主要问题之一。EGF是一种通过与细胞表面受体结合而促进细胞有丝分裂、细胞分化和胎儿肺表面活性物质合成的重要调节剂,在促进胎儿肺成熟的发育过程中具有重要作用[9]。EGF存在于大多数组织和体液中[10],随着妊娠的进展,母体中的EGF不断变化,其在各个组织中的表达也不相同。生殖系统中的EGF及其受体EGFR由自分泌、旁分泌和内分泌途径产生,对生殖器官及生殖激素产生调控作用,从而影响性腺功能、胎儿发育及胎盘功能等。EGFR在孕早期广泛分布于胎盘的滋养层细胞中,并且通过EGFR信号通路调节人胎盘滋养层细胞增殖[11]。目前,EGF被广泛应用于流产和子宫肌瘤的研究,但EGF在预测早产方面却鲜有报道。
有研究发现,与孕中期相比,孕晚期羊水中的EGF水平增高,但在尿液中结果却相反,因此认为羊水中的EGF来源与尿液中的EGF来源是相互独立的[12]。但在本研究中,无论是血液还是羊水,妊娠组大鼠的EGF水平均高于中孕组,即越接近临产,EGF的水平反而越高,考虑可能与标本来源不同或检测方法不同有关。有研究显示,EGF、催乳素、4-羟基雌二醇联合治疗可改善小鼠胚泡植入率,但单独使用其中一个因素却无效[13]。这表明EGF在孕早期需联合其他因子一起激活相关途径才能产生生物学效应。Allen等[14]对马的妊娠过程进行研究发现,从妊娠第20天开始子宫内膜腺和内膜上皮中EGF的表达便显著增加,其受体EGFR在滋养细胞表面强烈表达,因此认为在马的妊娠过程中,母体生长因子EGF与母体和胎儿分泌的雌激素协同作用,可促进胎盘的快速生长,并且这种因子在妊娠期间持续分泌,使马能在足月时生产出较为成熟的新生儿驹。因此,无论是在羊水还是血液,EGF的含量均应逐渐升高,以促进胎盘和胎儿的不断成熟。在本研究中,我们以SD大鼠为实验对象,通过实验干预造成晚孕期大鼠早产,然后收集各组标本进行实验室检测。结果显示,妊娠组血清EGF水平均高于早产组、中孕组和晚孕组(均P<0.05),而早产组、中孕组和晚孕组血清EGF比较差异无统计学意义(P>0.05)。早产组和中孕组羊水EGF水平均低于晚孕组和妊娠组(均P<0.05),而早孕组和中孕组以及晚孕组和妊娠组比较,差异均无统计学意义(均P>0.05)。妊娠组胎盘EGFR相对表达量均高于其他3组(均P<0.05),结果与血清EGF的检测结果相近。这表明EGF和EGFR在妊娠的维持和发展中扮演着十分重要的作用,随着妊娠的发展,血液、羊水和胎盘中的EGF及其受体均逐渐升高。但当早产发生时,这种趋势却会发生改变。Armant等[15]研究结果显示,当EGF下降导致EGF信号调节系统失调时,会引起滋养细胞不能顺利侵入和重塑子宫螺旋动脉,并且会引起EGF受体拮抗剂的过表达,进而引起相关的围生期疾病。但本研究中晚孕组羊水EGF水平和妊娠组的比较却没有差异,这很可能是由于从晚孕期开始,胎儿快速走向最后的成熟阶段,使得胎儿分泌EGF增多并且逐渐接近分娩期浓度。Villanueva-García等[16]研究显示,孕19 d胎鼠的EGFR信号传导对肺成熟起重要作用,EGF及EGFR配体在肺成纤维细胞中大量表达并通过激活特异性蛋白激酶C促进胎鼠肺成熟。考虑可能由于孕晚期胎儿肺成熟需要,使羊水中的EGF含量升高甚至接近于分娩期,因此晚孕组羊水EGF水平与妊娠组水平无明显差异,而由于胎盘屏障作用,羊水中的EGF很难影响到母体血液中的EGF水平。胎盘中EGFR相对表达量与静脉血EGF浓度相近,可能提示胎盘EGFR的表达主要受血液EGF浓度的影响。
本研究中,大鼠血清EGF水平、羊水EGF水平及胎盘EGFR相对表达量之间均呈正相关(均P<0.05)。国内有研究报道,在人工流产和自然流产血清和胎盘中EGF和EGFR水平均呈同步性,即自然流产的EGF和EGFR均比人工流产低,当发生自然流产时,血液EGF含量和胎盘EGFR水平均同步下降[17-19]。有研究报道,在早产和早产性先兆子痫血清中的EGF和其配体EGFR会显著下降,这可能是机体对于早产的一种保护性反应[20]。
综上所述,EGF和EGFR在整个妊娠发展过程中不断变化,但其在不同的组织中的变化不同。在孕晚期血液和胎盘中的EGF和EGFR水平出现异常降低可能预示着早产。本研究仅在大鼠模型中进行,且样本量有限,结论具有一定的局限性,EGF和EGFR与自然妊娠和早产的关系还有待进一步研究阐明。
