成人单侧隐睾症恶变一例报告并文献复习
2019-02-19王亚楠马新龙丁永强李荣欣杨小刚董治龙
王亚楠 马新龙 丁永强 李荣欣 杨小刚 董治龙*
1. 兰州大学第二医院泌尿外科(兰州 730000)
正常人群中睾丸肿瘤的发病率为0.002%, 而不育症和隐睾症患者精原细胞瘤的发病率显著增加。 隐睾是精原细胞瘤的一个危险因素, 隐睾患者的睾丸肿瘤发病率是非隐睾人群的5~10 倍[1]。2018 年10 月我科收治了1 例成人隐睾症患者, 术后病理检查结果回报为精原细胞瘤,现报告如下。
一般资料
患者,男,44 岁,因发现右侧阴囊内空虚40 余年于2018 年10 月30 日入院。 患者自幼发现右侧阴囊空虚,未触及睾丸,无疼痛,未予重视。 入院前1 个月患者出现右侧腹股沟区间断性疼痛,呈胀痛,无红肿及破溃。 遂就诊于当地医院,诊断为“右侧隐睾、右侧腹股沟疝”。 入院体检:体温36.7℃,呼吸20 次/min,脉搏81 次/min,血压117/71mmHg。体质量65kg,体型正常。皮肤黏膜无黄染及皮下出血点,浅表淋巴结未触及肿大,心肺听诊无异常;腹平软,肝脾肋缘下未扪及,肝区无压痛、叩击痛。专科查体:双肾区无隆起,无叩击痛;沿双侧输尿管走行区无压痛点;耻骨上膀胱区无隆起,压痛。 阴茎成人型,尿道口无红肿及脓性分泌物。 阴囊皮肤正常,右侧阴囊空虚,未触及睾丸,左侧阴囊及睾丸无异常。 右侧腹股沟区可扪及大小约4.0cm×3.0cm×2.0cm 包块, 质地中等、较柔韧,无触痛。 平卧位包块不缩小。 实验室检查:AFP 0.92ng/mL,HCG <1.00mIU/mL,LDH 128U/L。B 超提示:左侧睾丸位置正常,左侧大小约3.7cm×3.1cm×1.6cm,形态正常,包膜光滑完整,实质回声均匀,内未见占位性改变。 右侧腹股沟区探及大小约3.2cm×2.0cm×1.1cm 的似睾丸样声像图,实质回声减低,内可探及数个强回声,较大者长约0.2cm,后伴“彗星尾”征。精索区未探及迂曲扩张的血管结构。 CDFI:睾丸、附睾内血流信号未见异常。右侧腹股沟探及前后径约1.0cm 的液性暗区。 超声诊断:右侧隐睾,睾丸微石症;左侧睾丸鞘膜积液;右侧腹股沟区积液(图1)。

图1 彩超图示
入院后完善各项相关检查, 于2018 年11 月1 日在腰麻下行右侧隐睾切除术,单侧腹股沟疝修补术,术中见右侧睾丸位于腹股沟区, 腹股沟区淋巴结未见肿大。 高位游离精索并完整切除右侧睾丸及附睾,并行右侧腹股沟疝后壁加强术。 术后病理检查:(1)肉眼所见灰黄色睾丸1 个,大小5cm×4cm×3cm,切面灰红,质软。(2)镜下所见 肿瘤细胞形态一致,被纤维分隔成片状、条索状结构,瘤细胞圆形或多角形,包膜清晰,胞浆透明,核圆形,核浆比增大,核仁清楚,可见核分裂象,伴多灶坏死,肿瘤间质伴淋巴细胞浸润(图2)。(3)病理诊断(隐睾)精原细胞瘤,瘤组织未侵及附睾。 (4)免疫组化染色 瘤细胞示PLAP (+),CD117 (+),D2-40(+),CD10(+),CD30(-),CD20(-),CK 广(-),Vimentin(-),Ki67 阳性细胞70%。
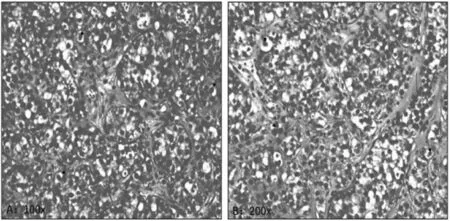
图2 隐睾免疫组化染色
讨 论
一、流行病学和病因学
隐睾症是男性生殖系统最常见的先天性畸形之一,隐睾症包括睾丸下降不全、睾丸异位和睾丸缺如,隐睾通常单侧发病,双侧隐睾发生率为10%~25%[1]。 其发病率在生长发育中逐渐降低, 其发病率在未成熟儿中占9.2%~30%, 成熟儿中占3.4%~5.8%,1 岁时约占0.7%~0.8%[2]。 大约70%的未降睾丸可以在出生后第一年内自然下降,然而大约1%的患者将始终保持隐睾状态。 隐睾患者有效保留生育能力的理想年龄是出生后12~24 个月,出生后睾丸自行下降可发生于6 个月内,之后可能性减少,1 岁后已无可能自行下降[3-4]。 睾丸肿瘤是20~35 岁男性最常见的恶性肿瘤, 是导致该年龄段男性死亡的重要原因。 近30 年来,其全球发病率有逐年增加趋势,特别是在西方国家。 其中约95%为睾丸生殖细胞瘤, 而睾丸精原细胞瘤是最常见的生殖细胞肿瘤,约占生殖细胞瘤的55%[5]。 其发病年龄相对较大,集中在30~50 岁。该病多为单侧发生,偶见双侧[6]。睾丸肿瘤的确切病因不清楚,但隐睾与之有关,其发生睾丸肿瘤的几率是正常睾丸的20~40 倍, 临床隐睾发生恶变的年龄多在20 岁以后, 本患者癌变估计在40 岁左右。 即使将睾丸复位也不能完全防止发生恶变,但有助于肿瘤早期的发现,其他引起睾丸肿瘤的因素可能与种族、遗传、化学致癌物质、损伤、感染、内分泌等有关[7]。
二、诊断与鉴别诊断
临床诊断一般根据隐睾病史,阴囊空虚,隐睾包块进行性增大且质地坚硬等特点确诊,B 超、CT 等影像学检查有助于临床分期。 最终确诊需要依靠术后的组织病理学检查。 对于怀疑隐睾恶变的患者,临床上采取外周血查AFP、β-HCG 和LDH, 几乎所有的卵黄囊瘤患者的血清AFP 都升高,而纯精原细胞瘤中AFP 一般是正常的,如果精原细胞瘤患者AFP 升高,可能提示肿瘤中含有非精原细胞瘤成分。 β-HCG 在正常的胚胎发育中是由胚胎滋养层组织分泌, 睾丸肿瘤患者的β-HCG由睾丸合体滋养层细胞产生, 而纯精原细胞瘤中β-HCG 一般是正常的,如果精原细胞瘤患者β-HCG 升高,可能提示肿瘤中含有合体滋养层细胞成分。LDH 特异性不高,与肿瘤体积相关,80%的进展性睾丸肿瘤中有LDH 的升高,因此LDH 更多用来预测转移和复发[8]。超声能显示睾丸肿瘤的发生部位、大小、形态、内部回声及与周围组织结构的关系, 对睾丸肿瘤的早期诊断有重要意义。 精原细胞瘤多呈均匀性低回声,胚胎癌及混合性生殖细胞瘤多呈混杂不均回声或伴强回声,畸胎瘤于混杂不均回声中出现强回声及声影。 超声还可显示腹膜后及肾蒂周围有无转移灶, 有助于判断分期及预后,但有假阳性。 CT 对睾丸肿瘤的诊断和临床分期具有重要的价值,可行胸腹部CT 检查,有助于诊断淋巴结或远处转移, 有神经系统症状的患者可行颅脑MRI 检查[9]。 本患者术前AFP、β-HCG、LDH 等均正常。B 超提示:右侧隐睾,睾丸微石症。
三、治疗
隐睾症治疗的目的是保全患者的生育能力, 避免患者精神、心理的不良影响,防止性功能降低,预防并发症的发生。 隐睾手术矫正宜早不宜迟,目前公认的最佳手术年龄为18 个月之前行睾丸引降固定术。 对于成人隐睾的处理意见:(1)凡睾丸位置低,如腹股沟管型、阴囊上型, 睾丸萎缩不明显, 术中冰冻切片提示无恶变,患者坚决不同意切除隐睾者,可给予保留并行睾丸引降固定术。 但应向患者交代清楚随访和酌情复诊工作。 (2)对于位置高、睾丸明显萎缩、活检有恶变趋势、已婚已育的各型隐睾患者, 特别是腹内型应积极采取切除术[10]。
目前, 对睾丸精原细胞瘤分期普遍采用美国癌症联合委员会的肿瘤、淋巴结、远处转移和血清肿瘤标志物分期系统,即TNMS 分期系统,根据临床特征分为临床Ⅰ期(ⅠA 和ⅠB 期)、Ⅱ期(ⅡA、ⅡB 和ⅡC 期)和Ⅲ期。 隐睾继发精原细胞瘤的治疗与其他睾丸肿瘤相似,一经发现, 通常采取睾丸切除术, 根据临床分期确定是否根治性淋巴结清扫及后续结合放疗或者化疗。 对于Ⅰ期精原细胞瘤患者, 单纯行睾丸切除术与手术+放疗疗效相当,在行睾丸切除术后,可仅严密随访,或者辅助性的放疗或化疗1~2 个疗程。 对于Ⅱa 及Ⅱb 患者,因为精原细胞瘤对放疗极为敏感,在行睾丸切除术加腹膜后淋巴结清扫术后, 可行单纯放疗即可获得良好的效果。 对于Ⅱc 及以上的患者,在根治性睾丸切除术后应结合放疗和化疗,化疗可采取BEPP(博来霉素、依托泊苷和顺铂) 方案5 周期, 放疗剂量一般在30~36Gy[8]。本病例患者术后病理检查结果为:(隐睾)精原细胞瘤,瘤组织未侵及附睾。 肿瘤分期为Ⅰ期精原细胞瘤,建议术后1 个月内进行低剂量(20~30Gy) 腹主动脉旁加或不加同侧盆腔淋巴结区域放疗。 研究表明一侧隐睾肿瘤治疗后,对侧阴囊内睾丸发生癌肿机会较正常人群高,建议该患者对对侧睾丸进行随访监测。 欧洲肿瘤内科学会(ESMO)临床实践指南指出,治疗正确及时,Ⅰ期肿瘤患者5 年生存率达99%,在肿瘤伴转移情况下,预后好、预后一般及预后差的患者5 年生存率分别为91%、79%、48%[11]。 针对临床Ⅰ期患者,术后选择积极密切监测也许是对患者最有利的治疗方案。
作者认为男性新生儿都应普查有无隐睾, 隐睾与睾丸肿瘤发生的密切关系应该引起人们的普遍关注,隐睾手术矫正宜早不宜迟, 通过治疗可保全患者的生育能力,避免患者精神、心理的不良影响,避免性功能降低,预防其恶变的发生。
