中国部分地区黑胸大蠊遗传多样性与系统发育地理结构研究
2019-02-15徐永媛陈艳艳陈善元
徐永媛,李 蓉,陈艳艳,陈善元,肖 蘅
(云南大学 生命科学学院,昆明 650091)
黑胸大蠊(Periplanetafuliginosa)隶属于节肢动物门(Arthropoda),昆虫纲(Insecta),蜚蠊目(Blattodea),蜚蠊科(Blattidae),大蠊属(Periplaneta)[1],为杂食性昆虫,以动、植物食料为食,其主要生活于厨房、卫生间及垃圾桶周围。黑胸大蠊具有较强的适应性及行动能力,常会携带多种病原体[2-5],是人类疾病病菌的潜在携带者。研究表明,黑胸大蠊中有52种细菌寄生,可通过机械性传播病原体或取食时污染食品传播和导致多种疾病[6-7]。
近年来随着分子生物学的发展和应用,分子标记被广泛运用于昆虫的遗传研究。在众多的分子标记技术中,由于线粒体DNA(mtDNA)具有分子结构简单、无重组、进化速率快、多拷贝及严格的母系遗传等特点[8-10],被广泛用于昆虫的系统进化及系统地理学的研究。其中线粒体细胞色素氧化酶亚基I(Cytochrome coxidase subunit I,COI)基因运用较为广泛。例如,杨小强[11]通过对中国东南地区14个地理种群的116头马六甲肉食螨(Cheyletusmalaccensis)的COI基因序列片段进行了系统地理结构的研究,发现马六甲肉食螨种群存在来自种群内部的遗传分化,但遗传距离与地理距离无明显的相关性,即无明显的系统地理结构。任秋平[12]运用COI基因与AL31、AL51、AL65核基因位点对中国南部11个不同地理种群的106个双纹小蠊(Blattellabisignata)的种群结构研究表明,地理、气候等因素可能影响双纹小蠊的种群结构。王红等[13]基于COI基因序列对中国东北大豆食心虫(Leguminivoraglycinivorella)种群间的遗传多样性、基因流和分子变异进行分析显示,各种群间的遗传距离与地理距离之间无显著相关性,且种群间的基因交流未受地理距离的影响。
目前对黑胸大蠊的生物学特性、形态学、药用价值等方面进行了深入的研究[14-17]。对于其系统发育和系统地理学的研究也有相关报道。例如,陈壮志等[18]基于COI与细胞色素b (Cytb)基因片段对黑胸大蠊等6种蜚蠊物种进行系统发育分析显示,两基因联合能将蜚蠊物种区分开,并且黑胸大蠊和美洲大蠊(Periplanetaamericana)的亲缘关系较近。陈壮志等[19]基于COI基因片段的保守性对蜚蠊科6种昆虫研究发现,COI基因适合用于蜚蠊物种的分类鉴定与系统进化分析。Cho等[20]对蜚蠊目的黑胸大蠊、美洲大蠊、日本大蠊(Periplanetajaponica)、德国小蠊(Blattelagermanica)物种的COI基因序列构建NJ系统发育树显示,黑胸大蠊和美洲大蠊互为姐妹群,说明同美洲大蠊、日本大蠊、德国小蠊3种蜚蠊物种相比,黑胸大蠊与美洲大蠊的亲缘关系较近。但目前未见利用线粒体COI基因片段作为分子标记对黑胸大蠊的遗传多样性和系统发育地理结构进行研究。因此,本研究首次利用线粒体COI基因,对采自中国浙江、湖南、贵州和云南4个省份9个地区共计88个黑胸大蠊样本的序列,进行遗传多样性、遗传分化、系统发育地理结构等分析,为探讨中国部分地区黑胸大蠊的遗传多样性与系统发育地理结构及黑胸大蠊的有效防治策略提供分子生物学的理论基础。

表1 黑胸大蠊样本信息与多样性指数Table 1 Sample information and diversity index of Periplaneta fuliginosa used in this study
Code:种群代码Population code;N:样本数Number of samples;H:单倍型数Number of haplotypes;Hd:单倍型多样度Haplotype diversity;Pi:核苷酸多样Nucleotide diversity;Lng(E):经度Longitude;Lat(N):纬度Latitude
1 材料与方法
1.1 材料
本研究的材料为2015年7月—2016年3月采自浙江省宁波市、湖南省长沙市、贵州省毕节市、云南省昆明市等4省7市共9个地理种群的88个黑胸大蠊样本(表1)。采样时为保证样本的完整性,采用药物进行捕获,将捕获到的黑胸大蠊标本分别储藏于无水乙醇的标本管中,-80℃冰箱保存备用。
1.2 方法
1.2.1 总DNA提取
取约30 mg黑胸大蠊的腹胸部肌肉组织并剪碎,用双蒸水将其处理为细胞悬液,参照血液/细胞/组织基因组DNA提取方法提取总DNA。但在方法上做了一定的改进,如根据样品量的多少适量增减蛋白酶K的量和适当延长消化时间,使样品充分溶解;采用缓冲液TE洗脱时,洗脱2~3次,以提高DNA原液的浓度等。将提取的DNA原液存于-80℃冰箱备用。
1.2.2 PCR扩增与序列测定
PCR扩增使用COI基因通用引物:LCO1490 5′-GGT CAA CAA ATC ATA AAG ATA TTG G-3′和HCO2198 5′-TAA ACT TCA GGG TGA CCA AAA AAT CA-3′[21]。PCR总反应体系为35 μL:ddH2O 21.65 μL,TaKaRa ExTaq(Mg2+free Buffer)Buffer 1.5 μL、25 mmol/L MgCl23.5 μL、25 mmol/L DNTP mixture 2.8 μL、10 μmol/L正反引物各0.7 μL、5 U/μL TaKaRa ExTaq酶0.15 μL,模板DNA 4 μL。PCR反应程序:94℃预变性4 min;94℃变性1 min,40℃~44℃退火1 min,72℃延伸30 s,30个循环;72℃再延伸5 min。每次PCR扩增均设置空白作为阴性对照。对扩增的PCR产物在1.2%的琼脂糖凝胶(含1%核酸染料)中进行检测后,将扩增条带单一的PCR产物送往昆明硕擎生物技术有限公司,使用ABI3730测序平台进行双向测序。
1.2.3 数据分析
利用DNASTAR软件包中的SeqMan和EditSeq程序对序列进行拼接和校对,手动删除序列两端的引物区,获得长度相同的有效序列片段。利用MEGA 6.06软件对有效序列片段进行排序,构建NJ系统发育树,树上各分支的支持率由Bootstrap重复1000次所得。利用DnaSP v5软件计算遗传多样性指数、Tajima′sD中性检测值、遗传分化系数(Gst)、基因流(Nm)。利用POPART[22]软件构建单倍型网络图。采用Arlequin3.5软件进行AMOVA分子变异分析。利用IBDWSv3.23软件对遗传距离与地理距离之间的Mantel相关性进行分析。
2 结果与分析
2.1 COI基因序列特征与单倍型分析
通过PCR扩增和序列测定共获得黑胸大蠊9个地理种群88个个体的线粒体COI基因序列,其长度均为658bp,且未发现碱基的插入或缺失。碱基A、T、C、G的平均含量为32.1%、35.3%、16.7%和15.9%,A+T碱基含量(67.4%)明显高于G+C含量(32.6%)。所有COI基因序列中共检测到11个变异位点,9个简约信息位点,7个单倍型(Hap1-Hap7,GenBank登录号:MG021442~MG021449)。单倍型Hap3为9个地理种群所共享,包含72个个体;单倍型Hap6由来自云南省曲靖市陆良县的1个个体,昆明市五华区的1个个体、西山区的3个个体,安宁市的1个个体所共享;单倍型Hap1、Hap2和Hap4由来自昭通市绥江县的3个、3个和2个个体所共享;单倍型Hap5仅由来自云南省昆明市五华区的1个个体所共享;来自云南省昆明市盘龙区的1个个体形成了单倍型Hap7。除浙江省宁波市、湖南省长沙市和贵州省毕节市的3个地理种群只包含Hap3一个单倍型外,其余6个地理种群均包含2~4个单倍型。
2.2 遗传多样性、遗传分化与基因流分析
利用DnaSPv5软件计算相关指数,其结果显示:9个地理种群的单倍型多样度为0.327,核苷酸多样度为0.0017,Tajima′sD中性检验值为-1.2743(P>0.05),遗传分化系数(Gst)为0.1060,基因流(Nm)为4.22。而不同地理种群的单倍型多样度(Hd)为0.000~0.667,平均值为0.313;核苷酸多样度(Pi)为0.0000~0.0050,平均值为0.0011(表1)。
2.3 系统发育地理结构分析
选取美洲大蠊(Periplanetaamericana)的COI基因序列(GenBank登录号:JQ350707、KM576931、GU947663)为外群,同本研究黑胸大蠊7个单倍型序列构建系统发育树(图1)。结果显示,黑胸大蠊各单倍型序列都明显与外群分开。7个单倍型形成了两个较为明显的分支,其中单倍型Hap3-Hap7的序列聚为分枝I,支持率为66%,单倍型Hap1与Hap2聚为分枝II,支持率为94%。分枝I和分枝II互为姐妹群聚为单系枝,其支持率为100%。此外,发现距离较远的地理种群ZJNB的单倍型Hap3与地理种群KMAN的单倍型Hap6聚为一枝;距离较近的地理种群KMWH、KMPL的单倍型Hap6、Hap7聚为一枝,并未反映出与地理位置相关的信息。
为了进一步了解单倍型之间的关系,利用POPART软件采用中间结合法(Median-joining)构建了黑胸大蠊的单倍型网络图(图2),结果显示,单倍型Hap1和Hap2关系较为紧密,但与其他单倍型有明显分支,而单倍型Hap3为72个个体9个地理种群的共享单倍型。各个黑胸大蠊地理种群的所有单倍型并没有单独聚在一起,而是被来自其它地理种群的单倍型相互隔开。
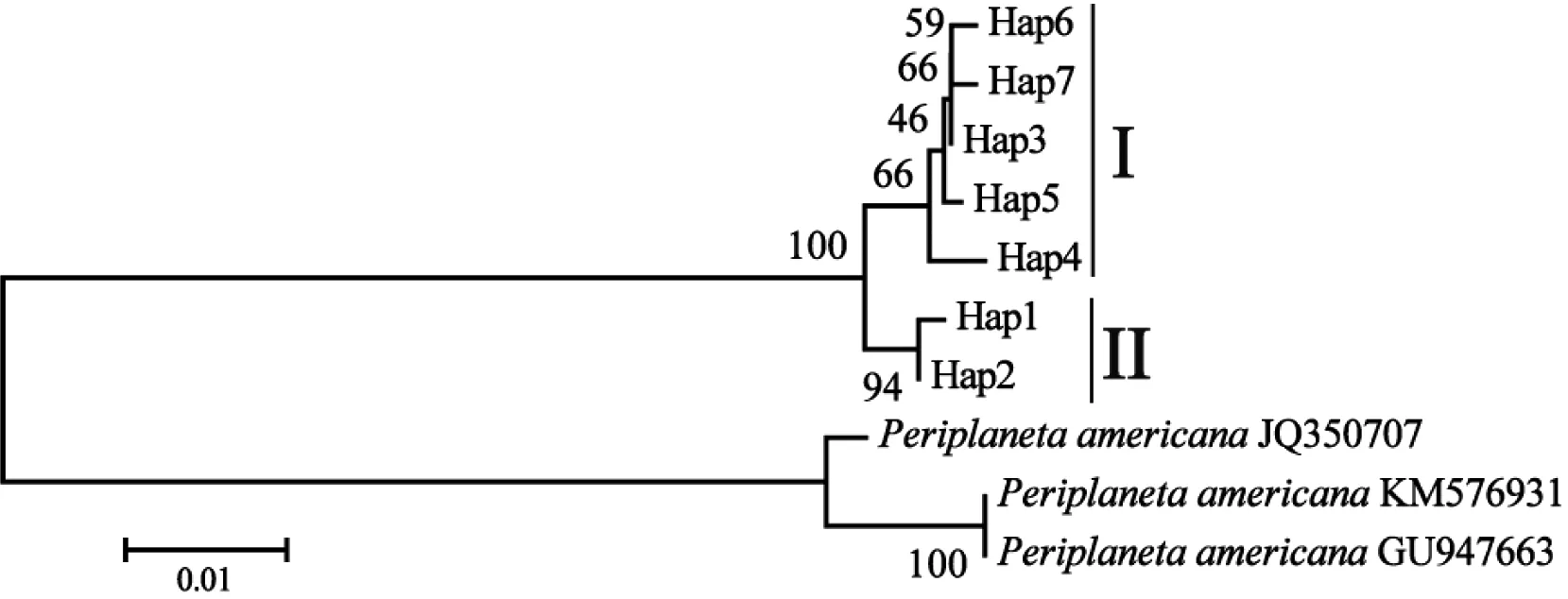
图1 基于COI基因序列构建的黑胸大蠊不同地理种群的NJ系统发育树Figure 1 Phylogenetic tree of different geographic populations of Periplaneta fuliginosa with COI sequences using NJ method
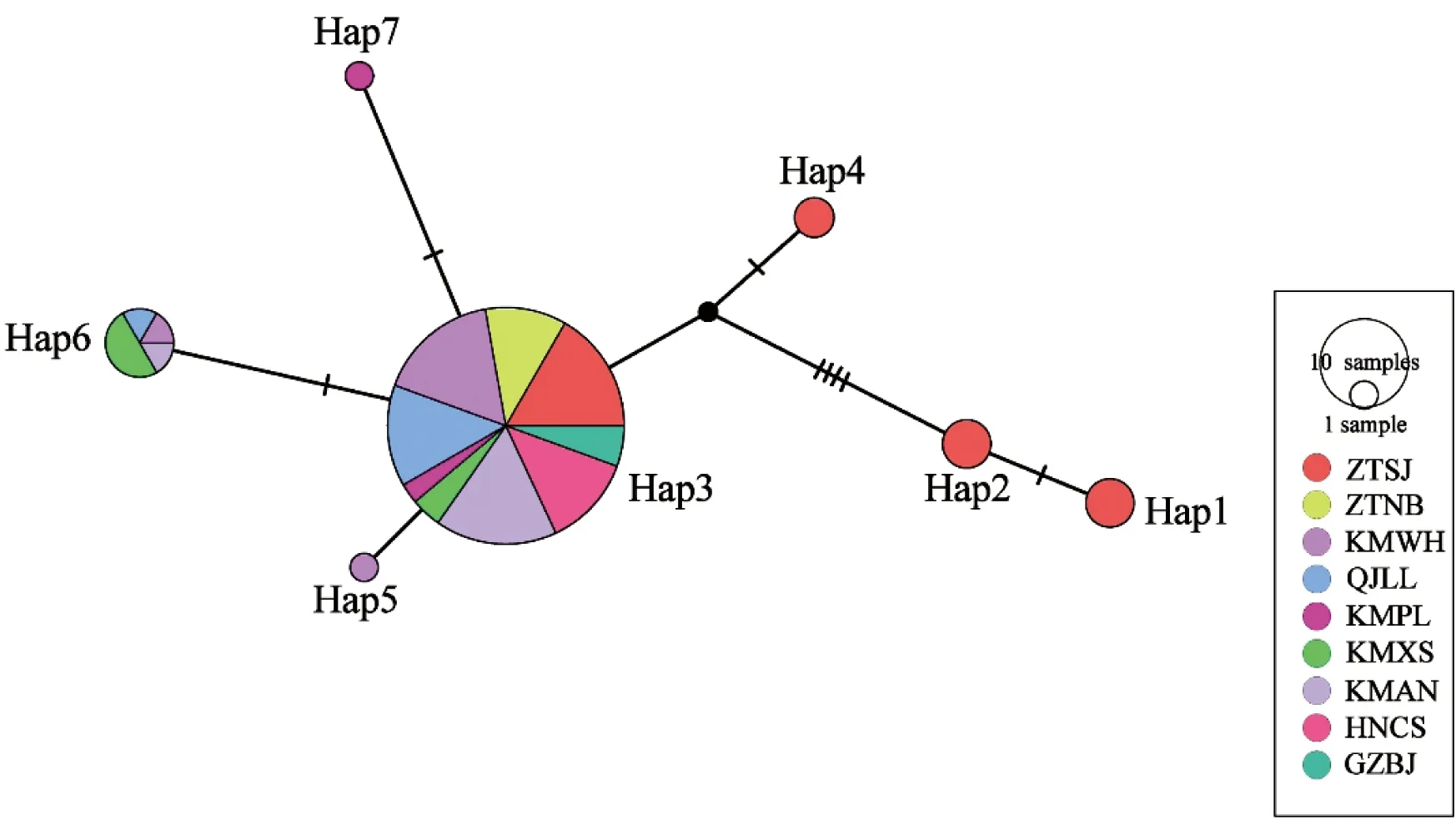
图2 基于COI基因构建的黑胸大蠊的单倍型网络图Figure 2 The haplotype network of Periplaneta fuliginosa based on COI gene sequences
AMOVA分子变异分析显示,9个地理种群间的方差组分为0.120 72,占方差比率的20.55%;种群内的方差组分为0.466 66,占方差比率的79.45%。种群内的方差比率明显高于种群间的方差比率。
不同地理种群间的遗传距离与地理距离的自然对数值分别为0.0000~0.0040,1.4669~7.5809(表2)。Mantel相关性分析(图3)显示,遗传距离与地理距离两个矩阵的相关系数R为0.0038,P=0.5670,说明遗传距离与地理距离间无显著相关性。以上结果一致显示黑胸大蠊种群间没有显著的系统发育地理结构。
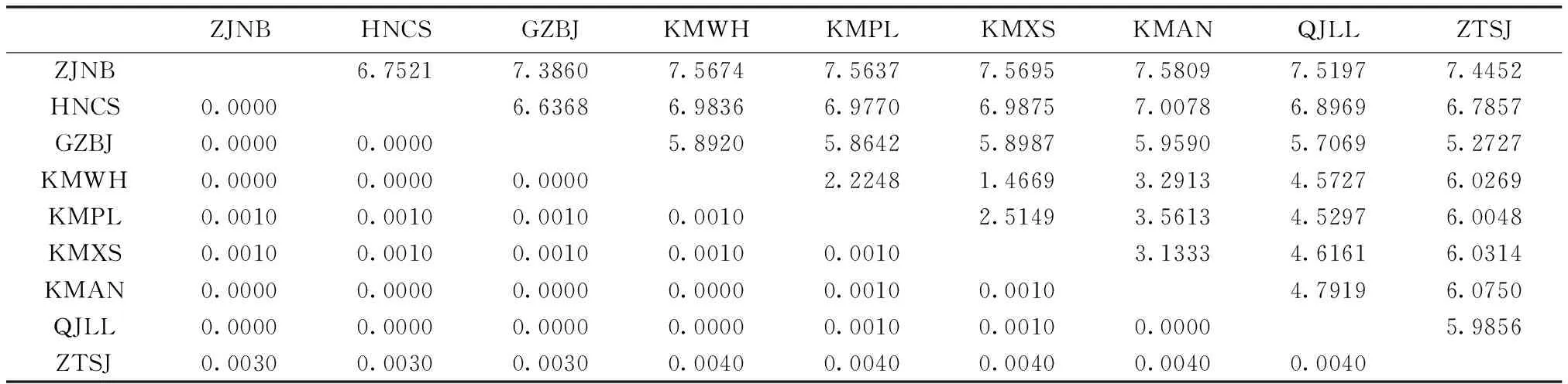
表2 黑胸大蠊种群间的遗传距离(下三角)与地理距离的自然对数值(上三角)Table 2 The pairwise genetic distance (below the diagonal) and the natural logarithm of geographical distance (above the diagonal) among Periplaneta fuliginosa populations

图3黑胸大蠊种群间的遗传距离与地理距离的Mantel相关性
Figure 3 Mantel test between genetic distance and geographic distance amongPeriplanetafuliginosapopulations
3 讨论
线粒体DNA因具有拷贝数量大、独立于细胞核DNA等特点,被广泛用于物种的分子鉴定与系统发育的研究[20,23],除此之外,还被广泛用于地理种群遗传多样性研究[21]。线粒体COI基因序列的碱基组成具有明显的偏好性。本研究中,黑胸大蠊COI基因的碱基A+T含量(67.4%)明显大于G+C含量(32.6%),符合昆虫线粒体COI基因的序列特征[18,24]。黑胸大蠊7个单倍型中单倍型Hap3和Hap6为共享单倍型,说明这两个单倍型可能是黑胸大蠊群体中相对原始、稳定且能够适应环境变化选择的单倍型。而其余单倍型为各地理种群的独享单倍型,说明各地理种群具有一定程度上的遗传分化和存在一定的基因交流。
物种进化潜力、生活习性、对环境的适应能力及历史因素等对物种遗传多样性都具有一定的影响[25-26]。本研究中,黑胸大蠊的单倍型多样度(0.327)与核苷酸多样度(0.0017)同任秋平等[12]基于COI基因对11个双纹小蠊种群的遗传多样性(Hd=0.966,Pi=0.0299)进行比较,显示了黑胸大蠊种群相对较低的遗传多样性,说明黑胸大蠊对不同的生存环境的适应能力相对较弱。这一结论与魏中华等[27]认为黑胸大蠊生存及适应环境能力较强的结论相矛盾,这可能与黑胸大蠊的某些生物学特性有关。据相关研究显示黑胸大蠊在每年3—5月份及6—8月份生殖产卵及卵胚发育较好,生长较为迅速[15-16]。而本研究中,黑胸大蠊的采样时间为2015年7月—2016年3月,处于黑胸大蠊繁殖、生长发育程度相对低的时期,且就室内生长的黑胸大蠊而言,其食物和食性较为相似。本研究中的样本虽分属于9个地理种群,但均为室内采样,较少有野外样品。因此,虽为随机采样且采样点各不相同,因其生存环境较为相似,所以黑胸大蠊遗传多样性较低。这一结论与李春选等[28]认为昆虫遗传多样性在不同生态环境下具有一定的差别相符。黑胸大蠊总种群的中性检验Tajima′sD检验不显著,表明黑胸大蠊在较近的历史时期未经历种群扩张和持续增长的现象,种群大小较为稳定。
基因流(Nm)可以揭示种群间可能存在的基因渗透现象[29]。当Nm<1时,种群间遗传分化的主要因素为遗传漂变,当Nm>4,说明种群间存在较强的基因流[30-31]。本研究中,黑胸大蠊9个地理种群的基因流Nm为4.22>4,表明种群间存在较强的基因交流,在一定程度上阻碍了群体的遗传分化。系统发育和单倍型网络图分析中黑胸大蠊各地理种群的单倍型并没有单独聚在一起,部分单倍型被来自不同地理种群的个体所共享。根据AMOVA分析可知黑胸大蠊遗传变异主要来源于种群内部,由此可见黑胸大蠊地理种群间基因交流频繁并遗传分化程度较低,说明为使种群在自然选择作用下稳定存在,需在种群内通过遗传变异抵御外界环境的变化。本研究分析的9个地理种群间存在一定的距离跨度,但Mantel相关性检测显示遗传距离与地理距离没有显著相关性,说明种群间的地理距离与地理隔离无关。以上结果一致表明黑胸大蠊种群间无显著的系统发育地理结构。究其原因可能是由于黑胸大蠊种群间存在较高的基因交流。王红等[13]基于线粒体COI基因的分析可知,昆虫种群间的基因交流程度并不是完全取决于其迁飞能力,而迁飞能力弱或无迁飞能力的昆虫,也可通过其他方式进行基因交流。黑胸大蠊的迁飞能力虽然弱,但多寄居于轮船、火车、飞机等交通工具及人类居住的环境内,会因交通工具和人为因素而进行迁移扩散,进而增强了物种内的基因交流,这一结果同上述基因流分析的结果相吻合。
本研究的结果在一定程度上为黑胸大蠊地理种群遗传多样性的研究提供了一定的理论依据。但基于本研究的采样地点仅限于中国的浙江、湖南、贵州、云南的部分地区,且部分地区种群包含的样本数量较少。只利用了线粒体COI基因的部分序列片段,并不能获取完整的遗传信息。因此,若要全面了解中国的黑胸大蠊遗传多样性及系统发育地理结构,还需扩大样本的采集范围和样本量。同时考虑全长序列的分析及结合更多的分子标记进行进一步分析,从而更加全面地了解黑胸大蠊各种群间的系统发育地理关系及遗传机制,为黑胸大蠊的有效防治策略提供理论依据。
