肿瘤免疫中的“猫鼠游戏”
——浅析2018年诺贝尔生理学或医学奖的发现
2019-02-15李想
李 想
(西北大学 生命科学学院,西安 710069)
恶性肿瘤是机体正常细胞恶变的产物,具有不断增殖并有可能在体内转移的特点。为了生存和生长,肿瘤细胞能够采用不同策略抑制人体的免疫系统,使其不能正常地杀伤肿瘤细胞,从而在抗肿瘤免疫应答的各阶段得以幸存。人体免疫系统中负责监督和杀伤肿瘤细胞的主要细胞亚群包括杀伤性T细胞和NK细胞,当肿瘤细胞在人体内无序分化并不受控制地增殖,而杀伤细胞活性减弱,不能有效地清除肿瘤细胞,重大疾病就发生了。
人类对付肿瘤的传统手段包括手术切除、放射治疗以及化学药物治疗。随着生物技术的迅猛发展,科学家已经可以在细胞分子水平上针对已经明确的致癌位点设计相应治疗药物,使肿瘤细胞特异性死亡。虽然利用靶向药物可以对癌细胞进行准确杀伤,但肿瘤细胞一直在跟免疫系统玩“猫鼠游戏”,“狡猾”的癌细胞具有一定的适应能力,以逃逸免疫监视和攻击。例如:免疫细胞表面表达PD-1蛋白,肿瘤细胞则会表达一个免疫球蛋白样的分子PD-L1。这两个分子相互结合后,产生的信号被免疫细胞接收,使免疫细胞的活性降低,从而使得癌细胞逃过免疫细胞的追捕(评论:对应于猫鼠游戏的说法)。因此,调动体内免疫系统来杀伤肿瘤细胞是肿瘤治疗的新手段,其机制是活化包括T细胞和NK细胞在内的杀伤性淋巴细胞,靶向清除肿瘤细胞,激活患者体内抗肿瘤免疫系统的应答。肿瘤免疫治疗能明显减少毒副作用,显著提高治疗效率,在替代放化疗药物上具备明显优势,将为治愈肿瘤提供新手段。2018年的诺贝尔生理学或医学奖颁发给对肿瘤免疫治疗有杰出贡献的美国科学家詹姆斯·艾利森(James P.Allison)和日本科学家本庶佑(Tasuku Honjo)。其中Allison 教授因发现了CTLA-4可以作为免疫系统的“刹车分子”并将它应用于治疗肿瘤而获奖。Honjo教授因发现免疫检验点PD-1及提出PD-1也可以作为免疫“刹车分子”而获奖。本文将对PD-1/PD-L1和CTLA-4的发现与作用机制进行阐述,并简要介绍PD-1/PD-L1相关抑制剂的研发及临床应用。
1 PD-1、PD-L1及CTLA-4的发现
早在1992年,Tasuku Honjo研究组首次从凋亡的小鼠B细胞系中克隆到PD-1基因,PD-1全称是程序性细胞死亡因子1 (Programmed cell death 1,PD-1,又称CD279)[1]。7年之后,该课题组发现PD-1是一种相对分子量为55 000~60 000的I型跨膜蛋白,主要表达于活化的CD4+T细胞、CD8+T细胞、B细胞、NK细胞、单核细胞和树突状细胞等免疫细胞中,促进T细胞的成熟[2]。正常情况下,PD-1通过调节外周组织中T 细胞的分化方向进而调控机体对外来或自身抗原的免疫应答反应,防止免疫过激的发生[2]。PD-1基因敲除的小鼠会发生一些自身免疫疾病性状,表明PD-1具有抑制免疫的功能[2]。
1999年,华裔科学家陈列平教授课题组首次报道了PD-1配体B7家族的第三个成员B7-H1(也就是PD-L1),并发现B7-H1与B7家族的其他成员不同,B7-H1不能结合CTLA-4和CD28,但是可以促进诱导白介素10 (IL-10)的分泌;由于IL-10具有免疫抑制作用,因此该报道明确提出B7-H1是一个对免疫系统起负调节作用的蛋白[3]。PD-L1是I型跨膜蛋白,主要表达于抗原递呈细胞、B细胞、T细胞、上皮细胞、肌细胞、内皮细胞和肿瘤细胞中,并参与肿瘤相关的免疫应答反应。更重要的是,2002年陈列平教授课题组证明PD-L1在人的正常组织中表达量很低,但是在肺癌、结直肠癌、卵巢癌等癌症中表达量非常高,并且γ-干扰素能够诱导PD-L1的表达[4]。与此同时,这篇文章明确提出将B7-H1抗体用于杀死肿瘤细胞的免疫治疗方法具有光明的前景[4]。
CTLA-4的发现最早始于1987年法国免疫学家Pierre Golstein课题组,他们报道了小鼠T淋巴细胞相关抗原4(cytotoxic T lymphocyte-associated antigen-4,CTLA-4)。CTLA-4又名CD152,该基因定位于小鼠1号染色体C带,编码233个氨基酸,属于免疫球蛋白超家族成员[5]。1988年法国Marie-Paule Lefranc课题组克隆了人源CTLA-4基因[6]。随后证实CTLA-4是一种白细胞分化抗原,是T细胞上的一种跨膜受体,与CD28共同享有B7分子配体,而CTLA-4与B7分子结合后诱导T细胞无反应性,参与免疫反应的负调节[7-9]。 1996年,James P.Allison课题组证明使用CTLA-4抗体可以增强免疫抑制肿瘤的发生发展[10],这个发现为James P.Allison获得2018年诺贝尔奖奠定了重要基础。
2 PD-1/PD-L1和CTLA-4的作用机理
肿瘤细胞表面 PD-L1 分子表达上调后能与T细胞和B 细胞上的PD-1 结合,使PD-1分子位于胞质区的ITSM(Immunoreceptor tyrosine-based switch motif)被磷酸化,之后招募蛋白酪氨酸酶1(SHP-1)和蛋白酪氨酸酶 2(SHP-2),从而阻断磷脂酰肌醇3-激酶(PI3K)的激活,随之细胞内的葡萄糖代谢和Akt活性均被抑制,T细胞增殖和细胞因子分泌能力大大降低,造成肿瘤细胞周围的T细胞丢失,最终导致肿瘤细胞逃逸免疫防御和监视[11-12]。还有研究显示,PD-L1和PD-1的结合能引起E3泛素化酶CBL-b的表达升高,从而造成CD8+T细胞中T细胞受体(T-cell receptor,TCR)表达降低[13]。综上,这一系列反应打破了免疫细胞自身的免疫检查,抑制了免疫T细胞的活化和增殖并诱导其凋亡,从而使免疫抑制性微环境形成,逃避免疫监控和杀伤。
虽然CTLA-4也是通过抑制Akt磷酸化导致T细胞失活,但蛋白磷酸酶2A(PP2A)是主要的参与分子,这与PD-1/PD-L1的作用不同[11]。另外,PD-1抗体主要诱导耗竭型CD8+T细胞亚群的扩增,而CTLA-4抗体在诱导耗竭型CD8+T细胞亚群扩增的同时,还可诱导ICOS+Th1样的CD4+T细胞亚群扩增。此外,研究发现CTLA-4抗体还可以抑制调节型T细胞,促进T细胞浸润肿瘤组织,调节免疫记忆等[11,14]。
目前,国内PD-1/PD-L1的研究也是如火如荼。Zhang课题组调查了104个肺癌病人中PD-L1的表达,发现PD-L1的表达与预后成负相关,提示在肺癌中可针对PD-1/PD-L1通路进行免疫治疗[15]。Chu课题组在小鼠胶质瘤模型和人胶质瘤样本中发现肿瘤微环境中的IFN-γ是引起PD-L1表达的关键因素,提示在进行PD-1/PD-L1抗体治疗胶质瘤时应同时检查IFN-γ的表达情况[16]。
3 PD-1/PD-L1及CTLA-4抑制性抗体的现状
近年来,已有多种PD-1/PD-L1单克隆抗体应用于肿瘤免疫治疗的临床研究,且发展迅猛,它们的作用原理如图1所示。目前PD-1抑制剂Pembrolizumab和Nivolumab已被FDA批准用于晚期黑色素瘤、非小细胞肺癌、霍奇金淋巴瘤和头颈鳞癌等,Nivolumab还被FDA批准可用于治疗肾癌和尿路上皮癌等。Nivolumab是一种完全人源化的 IgG4 单克隆抗体,通过阻断PD-1与其配体PD-L1或PD - L2的结合,逆转肿瘤免疫逃逸的状态,恢复T细胞杀伤肿瘤的活性,达到抑制肿瘤生长的目的[17]。Nivolumab是最早进入Ⅰ期临床试验的抗 PD -1 的抗体药物,目前应用较为广泛,在多种恶性肿瘤的治疗中也已显示较好的治疗效果。Pembrolizumab是美国FDA 批准用于治疗晚期黑色素瘤的药物之一,这是一种抑制PD-1 的人源化单克隆 IgG4 抗体,与PD-1有着高亲和力,几乎去除了免疫原性和毒副作用[18]。单独使用Pembrolizumab治疗非小细胞肺癌,证实其毒副反应较轻,肿瘤晚期患者的耐受性良好[18],Pembrolizumab也被应用于其他类型肿瘤的治疗研究。
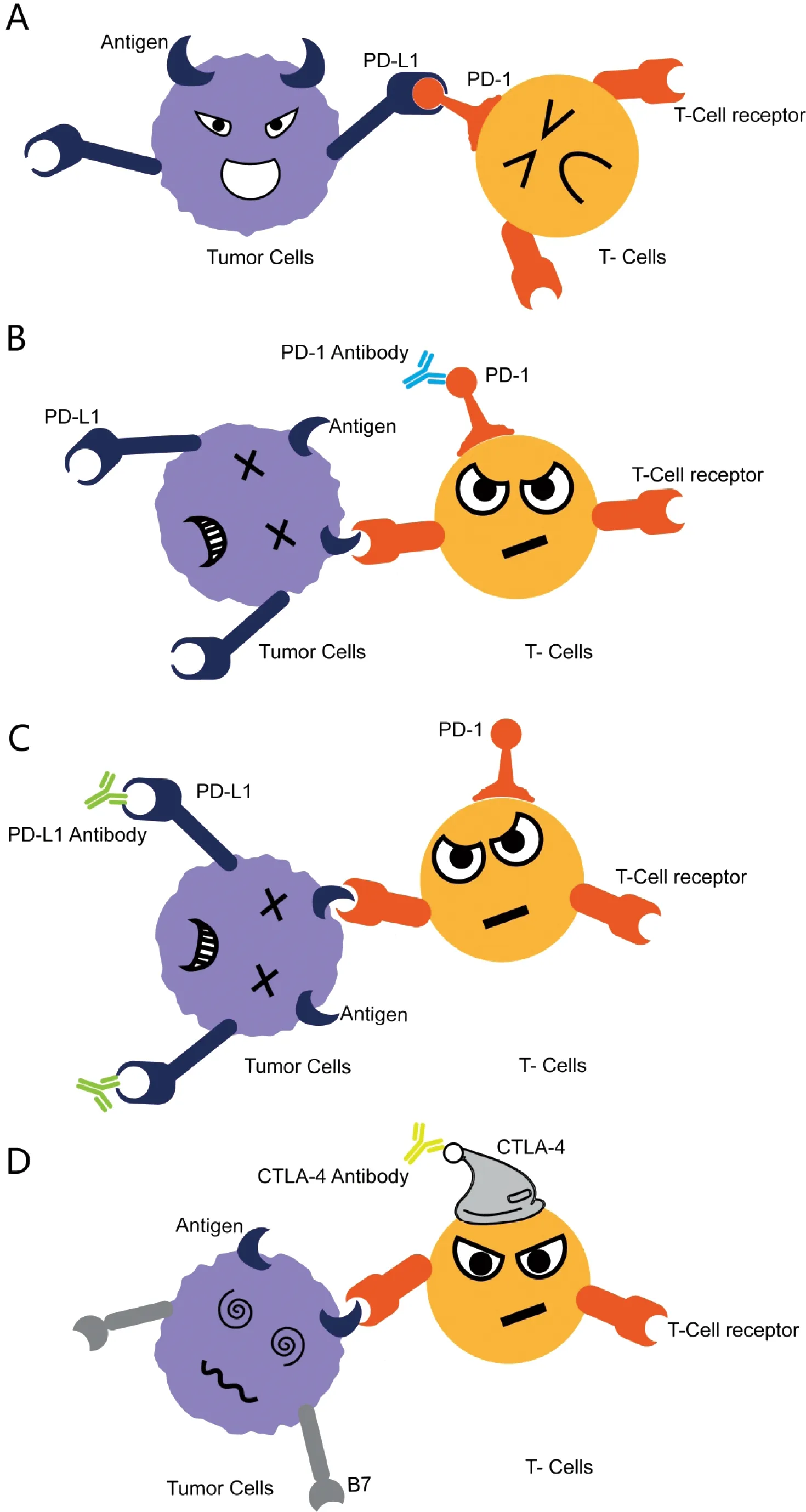
A:PD-1/PD-L1的作用原理;B、C和D: PD-1、PD-L1 和CTLA-4抑制剂的作用原理
图1 PD-1/PD-L1作用原理及PD-1 、PD-L1和CTLA-4抑制剂的工作原理示意图
Figure 1 Mechanism of action of PD-1/PD-L1 and PD-1,PD-L1 and CTLA-4 inhibitors
此外,开发识别和结合 PD-L1的单抗,也能取得与PD-1单抗类似的效果。这些单克隆抗体包括了Atezolizumab、Durvalumab、MPDL3280A(RG7446)、AMP-514 和 AMP-22等,也多已进入III期临床研究中,覆盖了非小细胞肺癌、黑色素瘤、膀胱癌等多个病种。其中,Atezolizumab是一个单克隆抗体,可结合至PD-L1,阻断与PD-1/PD-L1两者的相互作用。在小鼠肿瘤模型中,Atezolizumab可以阻断PD-L1活性导致肿瘤生长减慢[19]。Atezolizumab由Genentech公司生产,现用于治疗局部晚期或转移性尿路上皮癌。2017年7月由阿斯利康发布的Durvalumab也是以 PD-1/PD-L1 通路为靶向目标,通过阻断蛋白质之间的相互作用,促进自身免疫系统杀死癌细胞[20]。这两种免疫疗法的作用机制并不重叠,所以治疗肿瘤时,这二者联合治疗比单药治疗更为有效。迄今为止,PD-1和PD-L1抗体获得的适应证包括晚期黑色素瘤、头颈鳞癌、非小细胞肺癌、尿路上皮癌、霍奇金淋巴瘤、默克尔细胞癌和微卫星不稳定实体瘤。
CTLA-4抑制剂Ipilimumab是一种抗 CTLA-4 的全人源单克隆抗体,首先被用于黑色素瘤治疗,由于其具有较好的疗效,已于 2011 年 3 月被 FDA 批准用于治疗晚期黑色素瘤[21]。但由于单独使用Ipilimumab的疗效有限,现在多使用Ipilimumab联合其他治疗方案,治疗效果更为突出[22-23]。其他 CTLA-4 抑制剂,如 Tremelimumab的临床试验也正在积极开展中[24]。其中,Tremelimumab用于治疗黑色素瘤的临床试验已处于Ⅱ期[25]。 另外,CTLA-4的联合治疗展现出比单独使用更好的效果。比如,Ipilimumab联合BRAF激酶抑制剂,二者同时使用能明显提高转移性黑色素瘤的生存期[26]。
目前,中国企业开发的PD-1/PD-L1项目共计42个,包括20个PD-1单抗,14个PD-L1单抗和8个PD-1/PD-L1双抗项目。信达生物在2017年12月提交了PD-1单抗药物(IBI-308)上市的申请,并于2018年获得许可,现已进入临床研发后期阶段[27]。国内其余PD-1项目基本处于II期阶段;值得注意的是,Xu和Hu课题组检测了36名接受IBI-308治疗的晚期消化道肿瘤患者用药前后的循环肿瘤细胞(CTC),并评估了CTC 上PD-L1蛋白的表达水平,发现用药前PD-L1high的CTCs可以预测PD-1药物的效果,PD-L1high的CTCs比例对免疫治疗的效果极具参考价值[28]。而在众多的PD-L1项目中,康宁瑞杰/思路迪公司研发的PD-L1抗体KN035已进入临床后期开发阶段,其中针对胆管癌的III期临床试验和MSI-H实体瘤的II期临床试验已经在中国展开;而与PD-1/PD-L1有关的双向特异阻断的药物开发在我国还处于早期阶段。
4 展望
自2011年美国FDA批准了全球第一个真正意义上的肿瘤免疫治疗药物——百时美施贵宝ipilimumab(抗CTLA-4单抗)上市,已有多种免疫检测点阻断剂和靶向性免疫细胞药物在恶性肿瘤治疗中取得了较好的临床疗效,极大地推动了肿瘤免疫治疗的临床前研究和临床应用。与常规化疗和放疗相比,阻断PD-1/PD-L1的免疫治疗在部分患者中产生了明显的疗效,现已成为肿瘤综合治疗的一个重要部分,肿瘤免疫治疗也从辅助性治疗方式发展成为最有潜力治愈恶性肿瘤的手段。但在临床实践中,PD-1/PD-L1 抑制剂的应用尚存在一系列亟待解决的问题,譬如如何确定最佳的治疗模式,如何降低抑制剂的不良反应,如何明确耐药机制等。为了取得更好的临床疗效,研究人员应深入探索PD-1/PD-L1是否还存在其他作用机制,从而明确肿瘤逃逸的原理并加以阻断。另外,还要探索PD-1/PD-L1 的联合治疗模式,把原来不合适PD-1抑制剂治疗的病人转化成为可以从中获益的人群。比如,PD-1抑制剂联合放疗,PD-1 抑制剂联合靶项药物或联合溶瘤病毒,PD-1抑制剂联合个性化肿瘤疫苗等。随着二代测序技术和生物信息学的不断进步,研究人员还应重视个体化治疗,这将有助于临床医生有效地筛选抗PD-1/PD-L1治疗的潜在获益患者。总之,PD-1/PD-L1阻断疗法已经为治疗癌症打开了一扇大门,而开发出具有个体化的治疗方案才是通往这扇门的最佳途径。
