抗氧化胡萝卜籽肽的分离鉴定及活性表征
2019-02-15王惠敏户佩蔡甜甜徐淑丽洪晶汪少芸
王惠敏,户佩,蔡甜甜,徐淑丽,洪晶,汪少芸
(福州大学 生物科学与工程学院,福建 福州,350108)
自由基理论指出,活性氧自由基及其他自由基会对DNA、蛋白质和其他大分子如脂类产生氧化损伤[1],还有诱发多种疾病如糖尿病、心血管疾病甚至癌症等的发生[2]。因而抗氧化剂对清除人体自由基以及预防和治疗各类疾病具有重要意义。目前市场上以化学合成的抗氧化剂如BHT、BHA应用最为广泛,抗氧化效果良好,但有研究表明BHT、BHA等化学合成的抗氧化剂对人体肝脏、脾肺有潜在的毒性作用[3],因而其使用量有严格限制。所以开发高效无毒的抗氧化剂已成为国内外的研究热点。
抗氧化肽具有清除自由基活性和抑制脂质过氧化的作用,同时抗氧化肽又可以为人体提供额外的营养价值。目前已有很多研究者从各类动植物源蛋白中提取并纯化得到特定氨基酸序列的抗氧化肽,如HIMANI等[4]从珍珠栗蛋白中提取并纯化得到抗氧化肽SDRDLLGPNNQYLPK;赵晓蕾等[5]从大米渣中提取并纯化得到氨基酸序列为LQPY的抗氧化肽;DAVALOS等[1]通过水解鸡蛋白得到抗氧化肽YAEERYPIL,具有良好的活性氧自由基清除活性。
本文以胡萝卜籽蛋白为原料,通过酶解法制备获得较高活性的抗氧化肽,采用Sephadex G-25 凝胶过滤色谱和反向高效液相色谱对胡萝卜籽抗氧化肽进行分离纯化,测定其氨基酸序列,并对其抗氧化活性进行了研究。研究结果为胡萝卜籽的综合开发利用提供了理论依据。
1 材料与方法
1.1 实验材料与试剂
胡萝卜籽,购于福州种子市场;碱性蛋白酶,购于Notlas生物科技有限公司;1,1-二苯基-2-三硝基苯肼(DPPH),2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS),购于美国Sigma公司;谷胱甘肽(GSH),乙腈,三氟乙酸,购于国药集团;Sephadex G-25常压凝胶色谱柱,购于美国GE Healthcare公司;半制备型C18高效液相色谱柱,购于上海通威公司。
1.2 实验仪器
数显恒温水浴摇床(HH-4),国华电器有限公司;高速冷冻离心机(XZ21K),长沙湘智离心机仪器有限公司;pH计(pH700),美国Eutech公司;自动收集器(BS-160A),上海沪西分析仪器厂有限公司;真空冷冻干燥器(FD-1C-50),北京博医康试验仪器有限公司;高效液相色谱系统(LC-20A),日本岛津;质谱仪(Aglient 6500),美国安捷伦科技有限公司。
1.3 实验方法
1.3.1 胡萝卜籽蛋白含量的测定及提取
采用凯式定氮法测定胡萝卜籽中总蛋白含量,参照户佩等[6]研究得出的最优提取工艺制备胡萝卜籽蛋白。
1.3.2 胡萝卜籽抗氧化肽的制备
以胡萝卜籽蛋白为原料,利用碱性蛋白酶进行酶解制备抗氧化肽。酶解工艺流程为:胡萝卜籽蛋白溶液→调pH→酶解→灭酶→离心取上清→真空冷冻干燥→抗氧化肽。
配制质量浓度为5.28%的蛋白质溶液,调pH为10.0,添加酶量为419.36 U/g,45 ℃水浴酶解3.5 h,酶解结束后于沸水浴灭酶10 min,迅速冷却至室温,于4 ℃条件下12 000 r/min离心30 min。
1.3.3 胡萝卜籽抗氧化肽的分离纯化与结构鉴定
1.3.3.1 Sephadex G-25 凝胶过滤色谱分离
将Sephadex G-25凝胶进行预处理后装柱(大小Φ100×2.0 cm),抗氧化肽冻干粉以超纯水复溶,配制为50 mg/mL的溶液,经0.22 μm微滤膜过滤后上样,以超纯水为流动相以0.3 mL/min的速度洗脱,每10 min收集1管。洗脱液于220nm波长处测定吸光值,绘制洗脱曲线,收集各洗脱组分,真空冷冻干燥备用。
1.3.3.2 反相高效液相色谱(RP-HPLC)
将Sephadex G-25分离组分中有较高活性的组分以超纯水复溶,经0.22μm微滤膜过滤,通过半制备型C18反相高效液相色谱柱(10 mm×250 mm)进行进一步分离纯化,采用分析型C18反相高效液相色谱柱对组分进行纯度鉴定。液相色谱洗脱条件:洗脱液A为超纯水(含0.05%体积分数三氟乙酸);洗脱液B为乙腈(含0.05%体积分数三氟乙酸);0~5 min,5%乙腈水溶液;5~55 min,5%~40%乙腈水溶液;55~65 min,40%乙腈水溶液;流速为2 mL/min;检测波长为220 nm。收集具有较高活性的洗脱峰,真空冷冻干燥备用。
1.3.3.3 氨基酸序列测定与分析
经RP-HPLC纯化后的样品,采用液相色谱-串联质谱联用法(HPLC-ESI-Q-TOF/MS)进行氨基酸序列测定及分析。色谱条件为:色谱柱为BEH C18(Φ2.1 mm×100 mm);流动相为100%乙腈;流速:0.3 mL/min;检测波长为220nm。质谱参数:离子方式为ESI+;锥孔电压为40 V;毛细管电压为3.5 kV;检测器电压为1 700 V;碰撞能量为6 eV;质量范围为200~3 000m/z。
1.3.4 抗氧化活性检测
1.3.4.1 DPPH自由基清除活性检测
DPPH自由基清除活性参考ASOODEH等[7]描述的方法稍作修改。以无水乙醇配制DPPH溶液(0.1 mmol/L),取500μL样品溶液与等体积的DPPH自由基溶液混合,常温避光反应30 min,于517 nm波长处测定吸光值。分别以水和GSH为空白对照和阳性对照,同时设置内参对照组。DPPH自由基清除率计算公式如下:
(1)
式中:Ai为样品组(自由基+样品);Aj为内参对照组(乙醇+样品);A0为空白对照组(自由基+水)。
1.3.4.2 ABTS自由基清除活性检测
ABTS自由基清除活性参照AHMED等[8]报道的方法进行测定。7 mmol/L的ABTS溶液与2.45 mmol/L 的过硫酸钾溶液以体积比1∶1混合,室温避光反应12~16 h产生ABTS自由基离子,以磷酸盐溶液(5 mmol/L,pH 7.4)稀释至于734 nm波长处的吸光值为0.7±0.02,将稀释液与样品溶液等体积混匀反应10 min后于734 nm波长处测定吸光值,分别以水和GSH为空白对照和阳性对照。ABTS自由基清除率计算公式为:
(2)
式中:As为样品组;A0为空白对照组。
1.3.4.3 超氧阴离子自由基清除活性检测
超氧阴离子自由基清除活性参考SISWOYO等[9]描述的方法。采用邻苯三酚法进行测定。样品与Tris-HCl缓冲液(50 mmol/L,pH 8.3)等体积(400 μL)混匀,于25 ℃条件下静置10 min,加入100 μL的焦棓酸溶液(1.5 mmol/L,溶于1.0 mmol/L的HCl中)反应5 min。于320 nm处测定吸光值,每隔30 s测定1次,分别以水和GSH作为空白对照和阳性对照。超氧阴离子自由基清除活性的计算公式如下:
超氧阴离子自由基清除率/%=

(3)
式中:ΔAo/min为空白组的吸光值曲线斜率;ΔAs/min为样品组的吸光值曲线斜率。
1.3.4.4 抑制亚油酸过氧化能力
亚油酸自氧化体系建立参照ZHANG等[10]的方法稍作修改,以无水乙醇配制亚油酸(体积分数为2.5%),将1.0 mL的多肽样品(1.0 mg/mL)、1.0 mL亚油酸、2.0 mL磷酸盐溶液(50 mmol/L, pH 7.0)和1.0 mL超纯水置于具塞试管中,于37 ℃条件下,避光反应7 d,分别以水和Vc作为空白对照和阳性对照。每隔1 d测定1次亚油酸的氧化程度,亚油酸氧化程度依照硫氰酸钾(FTC)法[11]测定。
2 结果与讨论
2.1 胡萝卜籽蛋白含量测定结果
采用凯式定氮法测得胡萝卜籽中总蛋白含量为(23.57±0.14)%。
2.2 Sephadex G-25 凝胶过滤色谱分离
胡萝卜籽抗氧化肽冻干粉用超纯水复溶,采用Sephadex G-25 凝胶过滤色谱初步分离,分离后的洗脱峰曲线及各洗脱峰的抗氧化活性如图1所示[12],胡萝卜籽抗氧化肽粗品被分为4个组分(F1,F2,F3,F4),其中组分F1的DPPH自由基清除活性最高,组分F3次之。由于组分F1收集液颜色较深,推测其中可能含有其他物质具有较高的抗氧化活性,而组分F3在柱中保留时间较长,其分子质量较小,有报道指出,小分子多肽具有更强的抗氧化活性[13],故收集组分F3进行进一步的高效液相色谱分离。

A-抗氧化肽粗品Sephadex G-25色谱图;B-各组分DPPH自由基清除率图1 抗氧化肽粗品Sephadex G-25色谱图以及各组分DPPH自由基清除率Fig.1 Separation of peptide by Sephadex G-25 and DPPH radical scavenging activity of fractions obtained by gel filtration chromatography
2.3 组分F3高效液相色谱分离
采用半制备型C18柱RP-HPLC色谱对组分F3进一步分离纯化,结果见图2。
组分F3成分复杂,对各洗脱峰进行活性测定,结果表明其中有2个洗脱峰活性较高,分别将其命名为F3-a、F3-b。当样品质量浓度为0.5 mg/mL时, F3-a和F3-b的DPPH自由基清除率分别为(90.66±2.71)%、(84.47±0.19)%。此外,经分析型C18RP-HPLC进行纯度鉴定得F3-a和F3-b呈单一峰(图3),说明已达到色谱纯,故收集F3-a和F3-b两个洗脱组分进行氨基酸序列分析。
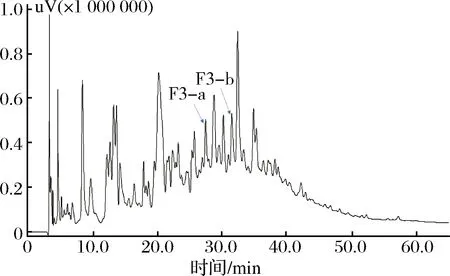
图2 组分F3高效液相色谱图Fig.2 RP-HPLC chromatogram of component F3

图3 组分F3-a和F3-b纯度鉴定Fig.3 Evaluation the purity of fraction F3-a and F3-b from RP-HPLC
2.4 抗氧化肽的分子质量及序列测定
采用液质联用仪对组分F3-a和F3-b进行分子质量及氨基酸序列的测定,质谱图结果如图4所示。
由质谱图分析得:F3-a为一个六肽,氨基酸序列为Lys-Asp-Asn-Phe-Leu-Phe(KDNFLF),分子质量为782.32 Da;F3-b为一个二肽,氨基酸序列为Leu-Phe(LF),分子质量为278.16 Da。有研究指出,含2~20个氨基酸的活性肽可以穿过膜屏蔽并在组织水平上发挥多种生物活性[14]。分子质量越小越容易穿过屏障,靠近缺电子基团,增强肽的活性[15-16]。有报道表明分子质量小于1 kDa的肽表现出较强抗氧化活性[17],JE等[18]以阿拉斯加鳕鱼蛋白为原料进行酶解得到的抗氧化肽,发现分子质量小于1 kDa的多肽抗氧化活性最强。本文从胡萝卜籽蛋白中分离鉴定得到的两条肽链KDNFLF和LF分子质量均小于1 kDa,因而可能具有较强的抗氧化活性。此外,抗氧化肽的活性大小也受其氨基酸组成的影响,有研究认为,一些具有特殊结构的氨基酸对抗氧化活性贡献最大,如芳香族氨基酸(Phe,Tyr,Trp),侧链含咪唑基的组氨酸(His),以及含硫的氨基酸(Cys,Met)等[11,19-20]。本文中的2条多肽均在C端含有一个Phe, Phe侧链含有苯环使得Phe具有供氢能力,增强了多肽的抗氧化活性。

A-KDNFLF;B-LF图4 抗氧化肽质谱图及结构式Fig.4 Mass spectra of antioxidant peptides and their structural formula
2.5 合成肽的体外抗氧化活性检测
由质谱鉴定得到的抗氧化肽KDNFLF和LF委托上海吉尔生化公司合成,其纯度达98%以上。以还原型谷胱甘肽(GSH)为阳性对照,考察KDNFLF和LF的抗氧化活性,结果见图5。
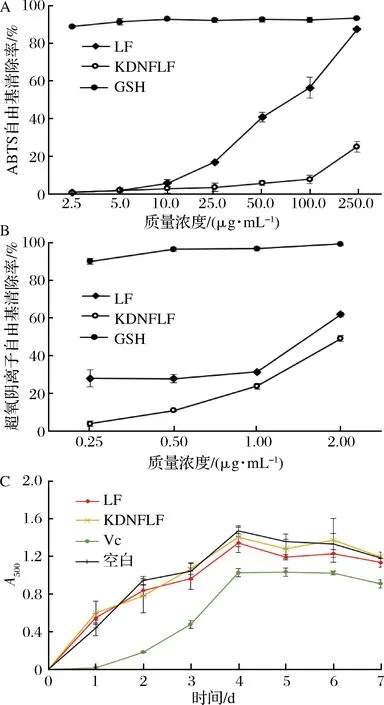
A-ABTS自由基清除活性;B-超氧阴离子自由基清除活性;C-抑制亚油酸氧化能力图5 抗氧化肽的活性表征Fig.5 Activity characterization of antioxidant peptides
图5-A、图5-B分别为不同浓度多肽对ABTS自由基及超氧阴离子自由基的清除活力,多肽对自由基的清除活性均具有浓度依赖性,浓度增大抗氧化活性也随之增加。结果表明与KDNFLF相比,LF具有更强的抗氧化活性。LF的ABTS自由基清除率为(87.38±0.25)%(250 μg/mL),活性接近阳性对照GSH(93.21±0.46)%,超氧阴离子自由基清除率为(61.84±0.029)%(2 mg/mL)。SUETSUNA等[21]对抗氧化活性肽段YFYPEL进行不同结构设计,发现二肽EL的活性要高于原活性肽段,本实验结果与之相似。这可能是因为较大分子质量的多肽与自由基反应时存在空间位阻,导致多肽的抗氧化活性下降。KDNFLF的C端含有LF肽段,说明LF肽段组合在自由基清除中起重要作用,与长肽链相比,短肽具有更强的抗氧化活性。
图5-C为抑制亚油酸自氧化能力的测定结果,由图可知,在第2天到第7天肽LF对亚油酸的氧化抑制效果微弱,与空白组无显著性差异(P>0.05),而肽KDNFLF几乎不具备脂质过氧化抑制能力。有研究指出疏水性氨基酸能够加强肽与脂质中自由基的相互作用,阻断脂质自氧化的链式反应[21]。本研究实验结果中,LF为疏水性多肽,脂质过氧化抑制能力却较弱。说明抗氧化肽对脂质过氧化的抑能力除与肽的疏水性有关外,还与氨基酸组成和顺序有关。
3 结论与展望
本文以胡萝卜籽蛋白为原料,以DPPH自由基清除率为指标,采用碱性蛋白酶进行酶解制得抗氧化肽;通过Sephadex G-25 凝胶过滤色谱、半制备型RP-HPLC对制得的抗氧化肽进行分离纯化,最终筛选出2个抗氧化肽F3-a和F3-b。利用液质联用仪对F3-a和F3-b进行分子质量及氨基酸序列测定,测定结果为:F3-a,序列为Lys-Asp-Asn-Phe-Leu-Phe(KDNFLF),分子质量为782.32 Da;F3-b,序列为Leu-Phe(LF),分子质量为278.16 Da。通过ABTS自由基清除率和超氧阴离子自由基清除率2个指标检测2个肽的抗氧化活力,同时考察了2个肽的脂质过氧化抑制能力。结果表明LF和KDNFLF均具有较强的自由基清除活性,LF表现出微弱的脂质过氧化抑制效果。LF的抗氧化活性高于KDNFLF,说明肽段LF组合在抗氧化中起重要作用。
本文仅研究了胡萝卜籽抗氧化肽的体外模型的抗氧化活力,可进一步将纯化肽进行动物体内模型试验,更全面体现抗氧化肽的抗氧化活力,为胡萝卜籽抗氧化肽在医药及食品中的应用提供一定的科学依据。
