原因不明复发性自然流产患者外周血pDC、miR-6165水平变化及其调控机制
2019-02-15郑象昭尹训强王东梅张云虹张振魏然朱肖肖郭强周宪宾褚楚赵霖李霞
郑象昭,尹训强,王东梅,张云虹,张振,魏然,朱肖肖,郭强,周宪宾,褚楚,赵霖,李霞
(1 济南大学 山东省医学科学院医学与生命科学学院,济南250200;2 山东省医学科学院基础医学研究所;3 济南市章丘区中医医院;4 山东中医药大学附属医院)
复发性自然流产(RSA)是指妊娠20周内连续发生两次或两次以上的自然流产,约占妊娠总数的3%[1,2]。RSA病因复杂,但其中约80%病因仍不明确,称为原因不明复发性自然流产(URSA)[3]。随着生殖免疫学研究的不断深入,母胎免疫耐受机制在URSA发病中的作用日益受到关注。妊娠时子宫蜕膜树突状细胞(DC)数量增加,通过表达主要组织相容性复合体Ⅱ类分子、共刺激分子和黏附分子,调节T细胞亚群平衡维持母胎免疫状态,对正常妊娠的建立和维持具有重要意义[4]。DC可分为经典DC(cDC)和浆细胞样DC(pDC)。cDC激活后产生大量白细胞介素12(IL-12),促使T细胞分化为Th1细胞,进而诱导免疫应答;pDC能够诱导初始T细胞向Th2方向分化,进而诱导免疫耐受[5]。随着对DC发育分化研究的不断深入,已证实信号转导及转录激活蛋白3(STAT3)介导的信号通路在pDC发育分化及功能调节中发挥着关键作用[6],但STAT3上游调控机制尚不明确。随着人类多个基因组计划的完成及测序技术的飞速发展,越来越多的微小核糖核酸(miRNA)被鉴定出来。这些曾经因为不能编码蛋白质而被认为是基因组中“暗物质”或“垃圾”的miRNA,现证实通过调控其靶基因表达与功能进而在细胞增殖、分化与凋亡等生理过程中发挥着重要作用,并参与了肿瘤等多种疾病的发生与发展,但其在URSA中的作用尚不明确[7,8]。本研究通过观察URSA患者外周血pDC亚群变化及miR-6165表达情况,探讨miR-6165能否调控STAT3信号通路途径干预pDC亚群分化,为URSA临床治疗提供新的靶点和途径。
1 资料与方法
1.1 临床资料 收集2017年8月~2018年8月山东中医药大学附属医院妇产科门诊及病房就诊的正常早孕妇女和URSA患者。URSA患者入选标准[8]:①妊娠12周以内,有2次或2次以上自然流产史,无活产史;②夫妇双方和(或)胚胎染色体正常,无家族遗传病及近亲结婚史;③妇科白带检查、超声检查和(或)子宫输卵管造影等检查排除器质性病变、生殖器官解剖畸形及感染性因素;④月经周期正常,基础体温双相,超声监测排卵正常;⑤男方精液分析正常;⑥性激素、甲状腺功能、血糖、胰岛素等内分泌检查均正常,自身抗体如抗核抗体、抗心磷脂抗体、抗甲状腺抗体、抗2-糖蛋白Ⅰ抗体检查均呈阴性;⑦血栓前状态有关的检查,包括D-二聚体、纤维蛋白(原)降解产物、血凝系列、全血分析均正常;⑧Torch系列IgM均阴性;⑨以往未进行过主动免疫治疗。正常早孕妇女纳入标准:①妊娠12周以内正常妊娠查体妇女;②既往无自然流产、死胎、死产史,无遗传、解剖、内分泌方面异常,无感染、自身免疫性疾病史;③本次妊娠期间无阴道流血、腹痛等先兆流产症状和体征;④超声证实胚胎发育正常,有心管搏动。共选取正常早孕妇女(正常妊娠组)和URSA患者(URSA组)各30例。URSA组年龄(27.8±4.4)岁、孕(7.5±1.3)周,对照组年龄(27.6±4.7)岁、孕(7.8±1.2)周,两组年龄与孕周具有可比性。本研究经医院医学伦理委员会批准,受试者均签署知情同意书。
1.2 标本采集与试剂准备 受试者均于清晨空腹抽静脉血6 mL,EDTA-Na2抗凝,密度梯度离心法分离外周血单个核细胞(PBMC),分别用于流式抗体标记检测及qPCR检测。主要试剂:人外周血淋巴细胞分离液试剂盒购自索莱宝科技有限公司;流式抗体Anti-Human CD11c-FITC、Anti-Human CD123-PE均购自eBioscience公司;TRIzol Reagent、UItraSYBR Mixture均购自北京康为世纪生物科技公司;ReverTra Ace qPCR RT Kit购自东洋纺生物科技有限公司;miRNA 1st Strand cDNA Synthesis Kit购自南京诺唯赞生物科技有限公司;293T细胞购自武汉普诺赛生命科技有限公司;Lipofectamine 2000购自美国Invitrogen公司;miR-6165过表达(mimics:上游序列5′-CAGCAGGAGGUGAGGGGAG-3′,下游序列5′-CCCCUCACCUCCUGCUGUU-3′)、抑表达(inhibitor:5′-CUCCCCUCACCUCCUGCUG-3′)、阴性对照(NC:上游序列5′-UUCUCCGAACGUGUCACGUTT-3′,下游序列5′-ACGUGACACGUUCGGAGAATT-3′)及内参照U6逆转录引物与qPCR引物均由上海吉玛公司设计合成;内参照GAPDH及目的基因STAT3 qPCR引物均由上海博尚生物技术有限公司设计合成,引物序列见表1;STAT3、p-STAT3和GAPDH抗体均购自美国Cell Signaling Technology公司;辣根过氧化物酶标记的山羊抗兔IgG抗体购自北京中杉金桥公司;野生型及突变型STAT3 mRNA 3′非翻译区(3′UTR)载体购自美国Promega公司。

表1 目的基因与内参基因引物序列及产物片段
1.3 外周血pDC细胞比例、miR-6165检测
1.3.1 pDC细胞比例 采用流式抗体标记法。调整PBMC细胞密度为1×106/mL,1×PBS洗2遍;去上清,细胞重悬至100 μL 1×PBS。将抗体FITC-CD11c、PE-CD123按说明书加入到细胞悬液中,4 ℃避光孵育30 min;1×PBS洗2遍,去上清,1×PBS重悬细胞;转管,上机检测,FlowJo 7.6分析pDC(CD11c-CD123+)比例变化。
1.3.2 miR-6165 采用qPCR法。TRIzol法提取各组细胞总RNA,紫外分光光度计测定RNA的浓度及纯度。根据miRNA 1st Strand cDNA Synthesis Kit说明书合成cDNA,UltraSYBR Mixture PCR反应体系扩增。以U6为内参照,采用1.8ΔΔCt法计算miR-6165相对表达量。
1.4 miR-6165与STAT3关系的生物信息学预测与验证 通过差异基因的生物信息学分析,用Target Scan 7.1程序预测miR-6165与STAT3 mRNA的3′UTR是否存在结合位点。运用分子克隆技术,构建包含结合位点的野生型及突变型STAT3 mRNA 3′UTR荧光素酶报告基因pmirGLO载体;将293T细胞分为干预组和对照组,分别同时转染miR-6165(空白对照NC)与野生型或突变型STAT3 mRNA 3′UTR荧光素酶报告基因pmirGLO载体;转染24 h后收集细胞,采用双荧光素酶报告基因系统检测荧光素酶报告基因活性。
1.5 miR-6165对STAT3表达的调控作用观察 将293T细胞分为3组,过表达组、抑表达组利用Lipofectamine 2000转染miR-6165 mimics及inhibitor,空白对照组不转染;转染24 h之后收集细胞,分别采用qPCR、Western blotting法检测各组细胞STAT3 mRNA、STAT3总蛋白及磷酸化水平(p-STAT3)。①STAT3 mRNA:TRIzol法提取各组细胞总RNA,紫外分光光度计测定RNA的浓度及纯度。根据ReverTra Ace qPCR RT Kit说明书合成mDNA,UltraSYBR Mixture PCR反应体系扩增。以GAPDH为内参照,根据获得数据采用1.8ΔΔCt法计算STAT3 mRNA相对表达量。②STAT3及p-STAT3蛋白:用RIPA裂解液提取各组细胞总蛋白,SDS-聚丙烯酰氨凝胶电泳,转膜;5%牛血清白蛋白封闭1 h,一抗4 ℃孵育过夜;1×PBST洗膜(10 min×4次),二抗室温摇床孵育1 h;1×PBST洗膜(10 min×4次),加入显影液显影,化学发光法检测STAT3总蛋白及磷酸化水平。Quantity One软件分析蛋白条带灰度值,以目的条带与GAPDH灰度值比值作为目的蛋白相对表达量。
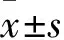
2 结果
2.1 两组PBMC中pDC比例及miR-6165表达比较 与正常妊娠组比较,URSA组PBMC中pDC比例降低而miR-6165表达水平升高(P均<0.05)。见表2。
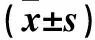
表2 两组PBMC中pDC比例及miR-6165表达比较
注:与正常妊娠组比较,*P<0.05。
2.2 miR-6165与STAT3关系的生物信息学预测与验证结果 Target Scan 7.1程序预测显示,miR-6165与STAT3 mRNA的3′UTR之间具有潜在的碱基互补结合位点,提示miR-6165通过结合STAT3 mRNA 3′UTR进而抑制STAT3表达。见表3。荧光素酶报告基因系统检测显示,与对照组比较,干预组能降低野生型STAT3 mRNA 3′UTR荧光素酶报告基因活性(P<0.05),但对突变型STAT3 mRNA 3′UTR荧光素酶报告基因活性无明显影响(P>0.05)。见表4。

表3 miR-6165与STAT3 mRNA 3′UTR结合位点预测
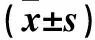
表4 miR-6165对STAT3 mRNA 3′UTR荧光素酶报告基因活性的影响
注:与对照组同型别比较,*P<0.05。
2.3 miR-6165对STAT3表达的调控作用 与空白对照组比较,过表达组STAT3 mRNA、STAT3与p-STAT3蛋白表达均降低(P均<0.05),而抑表达组STAT3 mRNA、STAT3与p-STAT3蛋白表达均升高(P均<0.05)。见表5。
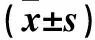
表5 各组293T细胞中STAT3 mRNA、STAT3与p-STAT3蛋白表达比较
注:与空白对照组比较,*P<0.05。
3 讨论
正常妊娠类似于成功的同种异体移植,有赖于妊娠母体的免疫耐受的建立与维持;母胎免疫耐受状态一旦被破坏,则导致病理性妊娠,如RSA、妊娠期高血压等疾病[10]。随着我国二胎政策的全面放开及妇女生育年龄的升高,URSA发病率呈上升趋势,严重危害女性生殖健康。DC是体内功能最强大的抗原提呈细胞(APC),也是体内惟一能够直接激活初始T细胞的APC,在抗病原体感染及维持机体内环境稳定中发挥重要作用[11]。根据细胞来源及功能,DC可分为cDC和pDC[5]。cDC具有强大的抗原提呈功能,通过分泌IL-12、IL-23等细胞因子诱导T细胞向Th1、Th17亚群分化,诱导机体免疫应答[12]。pDC通过分泌IL-10、TGF-β等细胞因子诱导T细胞向Th2、Treg亚群分化,在诱导机体免疫耐受中发挥重要作用[13]。研究发现,妊娠妇女子宫蜕膜存在大量DC,并证实pDC具有诱导母胎免疫耐受的作用[14]。本研究发现,与正常妊娠组比较,URSA组外周血中pDC比例降低。这提示DC亚群失衡可打破母胎免疫应答状态导致URSA发生,但导致这一现象的调控机制尚不清楚。
pDC来源于表达酪氨酸激酶受体(Flt3)的淋巴系造血干细胞,Flt3与Flt3L相互作用磷酸化并活化STAT3信号通路,活化的STAT3被募集到其靶基因TCF4启动子部位,促进编码pDC特异性核转录因子E2-2,进而调控pDC发育分化及功能自稳[15]。但是,目前STAT3信号通路调控pDC分化发育的作用机制尚未阐明。miRNA是近年来发现的一类长度约为22个核苷酸的内源性非编码的小分子单链RNA,主要通过与靶基因3′UTR结合负向调控靶基因的转录和翻译,参与调控胚胎发育、细胞增殖、分化、凋亡及肿瘤发生等生理病理过程[16]。越来越多的研究发现,miRNA调控其靶基因表达与功能在妊娠中具有重要作用,在妊娠过程中miRNA数量和功能异常可能参与了胎儿生长受限、妊娠期高血压疾病等妊娠相关疾病的发生与发展[17,18]。
miR-6165是长度为19个核苷酸的内源性非编码单链小RNA,其编码基因位于人的第17号染色体。有研究显示,miR-6165参与了细胞周期及细胞凋亡的调控,但其在妊娠及妊娠相关疾病中的作用尚不清楚[19]。本研究发现,与正常妊娠组比较,URSA组外周血中miR-6165表达水平升高,提示miR-6165在URSA中扮演着重要的角色。为了进一研究在URSA中miR-6165是否通过调控STAT3信号通路,进而干预pDC亚群分化发育。首先,我们通过Target Scan生物信息软件预测发现,miR-6165与IL-6 mRNA的3′UTR之间具有潜在碱基互补结合位点,并进一步通过双荧光素酶报告基因检测证实两者间通过碱基互补相结合,提示miR-6165通过结合STAT3 mRNA 3′UTR进而抑制其表达。然后,我们在293T细胞中转染miR-6165 mimics后,发现STAT3 mRNA表达水平显著降低,并且STAT3总蛋白表达及磷酸化水平显著降低,提示miR-6165对STAT3信号通路具有抑制作用;同时,我们在293T细胞中转染miR-6165 inhibitor后,发现STAT3 mRNA表达水平显著升高,并且STAT3总蛋白表达及磷酸化水平升高,进一步证实miR-6165对STAT3信号通路具有调控作用。以上结果表明,miR-6165通过调控STAT3信号通路干预pDC分化,进而参与URSA的发生。
综上所述,本研究结果进一步揭示了pDC亚群变化在URSA发病中的作用,阐释了miR-6165能够通过调控STAT3信号通路,进而抑制pDC亚群分化,打破母胎免疫耐受状态导致URSA。本研究从表观遗传免疫调控角度揭示了URSA发病机制,为临床治疗提供了新的靶点与思路。
