铜绿假单胞菌环介导等温扩增技术检测方法在实验小鼠微生物控制中的应用
2019-02-15向钦王会娟刘阳伍悦曹敏赖国旗何明忠
向钦, 王会娟, , 刘阳, 伍悦, 曹敏, 赖国旗, 何明忠*
(1.重庆医科大学实验动物中心,重庆400016; 2. 浙江大学基础医学院,杭州310058;3. 重庆医科大学附属第二医院肝胆外科,重庆400010)
铜绿假单胞菌Pseudomonasaeruginosa通常被称为绿脓杆菌(Silbyetal.,2011),为临床上较常见的人兽共患致病菌,在人体的各个部位都可能存在,一般出现在动物的鼻咽部和下消化道。铜绿假单胞菌感染后渗出液等呈绿色,能够引起化脓性病变,严重影响人和动物的健康以及动物实验的结果(Gordonetal.,1955;蒋观成,浦野徹,1991;Baker,1998)。快速、准确地检出铜绿假单胞菌,对控制该病原菌的感染具有重要意义。目前,铜绿假单胞菌的检测方法主要有细菌分离鉴定、免疫学、PCR等。其中,细菌分离鉴定法准确性高,但耗时费力、检出率低、易漏检;免疫学法检测过程繁杂、周期长、灵敏度低(王燕等,2010);尽管PCR法灵敏度较高,但对仪器设备要求严,很难在基层单位推广应用(Lodengetal.,2006;Deschaghtetal.,2009;Schwartzetal.,2010)。因此,探索准确、高效的铜绿假单胞菌检测方法,对人和实验动物感染的预防和控制都极其重要。
环介导等温扩增技术(loop-mediated isothermal amplification,LAMP)(Notomietal.,2000;Yoneyamaetal.,2007)具有操作简单、结果直观、特异性强及比普通PCR灵敏度高等突出优点,已被广泛应用于一些病原微生物的检测(Iwamotoetal.,2003;Horisakaetal.,2004;Songetal.,2005),包括铜绿假单胞菌(Gotoetal.,2010;Diribeetal.,2015;Kimetal.,2016)。由于LAMP的引物是扩增技术的关键所在,不同区域的引物对目的基因的扩增效果有重要影响。根据LAMP的基本原理,针对铜绿假单胞菌oprL基因序列的新区域,设计了相应的LAMP特异性引物,通过优化,达到高效、特异、灵敏的结果,并以《GB/T 14926.17-2001 实验动物 绿脓杆菌检测方法》和PCR法为对照,通过实验小鼠血清样本对建立方法进行验证,以期为丰富铜绿假单胞菌的检测手段提供重要依据。
1 材料
1.1 菌株及实验动物准备
铜绿假单胞菌(菌株编号:ATCC27853)由重庆市疾病预防控制中心馈赠;甲型副伤寒沙门杆菌SalmonellaparatyphoidA(菌株编号:CMCC50093)、鼠伤寒沙门氏菌Salmonellatyphimurium(菌株编号:CMCC50115)、肺炎克雷伯杆菌Klebsiellapneumoniae(菌株编号:CMCC46117)、嗜肺巴斯德杆菌Pasteurellapneumotropica(菌株编号:ATCC35149)、金黄色葡萄球菌Staphylococcusaureus(菌株编号:ATCC-25923、CMC6003)均由广东省实验动物监测所馈赠;87只实验小鼠(24只C57BL/6J小鼠、24只KM小鼠、16只BALB/c小鼠、23只各品系转基因小鼠)及其血清样本随机抽取于重庆市实验动物质量检测中心[实验动物生产许可证号:SCXK(渝)2012-0001、-0003、-0005、-0006;实验动物使用许可证号:SYXK(渝)2012-0001]。
1.2 试剂及仪器
Bst酶3.0购自New England Biolabs;Taq DNA聚合酶、dNTPs、基因组DNA提取试剂盒(DP304)购自天根生化科技(北京)有限公司;NAC(naldixic acid cetrimide)液体/固体培养基购自北京三药科技开发有限公司;肠杆菌科细菌编码(杭州)购自杭州微生物试剂厂;低温离心机、紫外可见核酸蛋白分析仪Bio Mate 3S购自Thermo Fisher Scientific;LAMP实时浊度仪(LA-320)和扩增试剂盒(4X004)购自日本荣研化学株式会社;SYBR Green Ⅰ购自InvitrogenTMThermo Fisher Scientific;PowerPac3000电泳仪、GelDocXR+凝胶成像分析仪及PCR热循环仪(S1000TMThermal Cyclers)购自Bio-Rad(上海)有限公司;恒温培养振荡器购自上海智诚分析仪器制造有限公司。
2 方法
2.1 DNA模板准备
NAC固体培养基上接种铜绿假单胞菌菌株,37 ℃培育20 h左右,挑单菌落在相同条件下用NAC液体培养基进行培育。菌液DNA提取步骤为:取菌液12 000 r·min-1离心5 min,加10 mmol·L-1Tris-EDTA(pH7.5)缓冲液50L,100 ℃ 10 min,-20 ℃ 2 min,12 000 r·min-1离心10 min,分离上清,-20 ℃储存。
2.2 引物设计与合成
根据铜绿假单胞菌oprL基因序列,在新区域内用PrimerExploer V4分别设计包含内引物(FIP、BIP)、外引物(F3、B3c)和环引物(LFc、LB)在内的3对LAMP特异性引物;根据参考文献(de Vosetal.,1997;邢进等,2012)合成2套PCR引物[oprL(F1、R1),16SrRNA(F2、R2)](图1,表1),引物由生工生物工程(上海)股份有限公司合成。


图1 环介异等温扩增技术引物在oprL基因的位置(GenBank登录号: Z50191.1)Fig. 1 The position of loop-mediated isothermal amplification primers in oprL gene (GenBank accession number: Z50191.1)
注: B3c、F1c、B2c、LFc分别为B3、F1、B2、LF的互补序列
Note: B3c, F1c, B2c and LFc are complementary sequence of B3, F1, B2 and LF, respectively
2.3 反应条件优化
2.3.1温度优化根据Bst酶最佳温度范围:60~66 ℃,设置8个温度梯度进行反应:59 ℃、60 ℃、61 ℃、62 ℃、63 ℃、64 ℃、65 ℃、66 ℃。最佳反应温度判断标准为:LAMP开始扩增的时间较早、最大扩增效率高且用时较短。
2.3.2内引物浓度优化设置8个浓度梯度的内引物(FIP/BIP):20 μmol·L-1、30 μmol·L-1、40 μmol·L-1、50 μmol·L-1、60 μmol·L-1、70 μmol·L-1、80 μmol·L-1、90 μmol·L-1(即以40 μmol·L-10.5 μL FIP和40 μmol·L-10.5 μL BIP为起点,按0.25 μL梯度等差递增体积等量加至2.25 μL),再分别加入5 μmol·L-1F3/B3c、20 μmol·L-1LFc/LB和Bst酶各1 μL,模板DNA 1 μL,2×RM缓冲液12.5 μL,无酶水补齐25 μL,混匀,在最佳反应温度下反应。最佳的内引物浓度判断标准为:扩增开始时间较早、最大扩增效率较大且用时较短。
2.3.3环引物浓度优化设置6个浓度梯度的环引物(LFc/LB):10 μmol·L-1、15 μmol·L-1、20 μmol·L-1、25 μmol·L-1、30 μmol·L-1、35 μmol·L-1(即以20 μmol·L-10.5 μL LFc和20 μmol·L-10.5 μL LB为起点,按0.25 μL梯度等差递增体积等量加至1.75 μL),再分别加入70 μmol·L-1FIP/BIP、5 μmol·L-1F3/B3c、Bst酶各1 μL,2×RM缓冲液11.5 μL,模板DNA 1 μL,无酶水补齐25 μL,混匀,在最佳反应温度下反应。最佳的环引物浓度判断标准为:扩增开始时间较早、最大扩增效率较大且用时较短。
2.4 特异性试验
按照上述新建立的LAMP体系,检测其对包括铜绿假单胞菌在内的7株菌株(ATCC27853、CMCC50115、CMCC50093、ATCC35149、CMCC46117、ATCC25923、CMC6003)的鉴别能力,样本扩增后加入1 μL SYBR Green Ⅰ后,使用LAMP实时浊度仪观察颜色变化,产物1.5%琼脂糖凝胶电泳检测。
2.5 稳定性试验
取6份不同批次铜绿假单胞菌菌液提取DNA,用新建立的LAMP体系进行检测。
2.6 重复性试验
取6份同批次铜绿假单胞菌菌液提取的DNA,用新建立的LAMP体系进行检测。
2.7 灵敏度试验
紫外可见核酸蛋白分析仪测定菌液DNA浓度,取已知浓度的铜绿假单胞菌DNA,将铜绿假单胞菌DNA起始浓度设为2.9 μg·mL-1,按10倍浓度梯度进行稀释至10-8或10-9,分别用已建立的LAMP方法及文献报道的PCR方法(de Vosetal.,1997;邢进等,2012)进行扩增,测定二者对铜绿假单胞菌的检测限。
2.8 临床样本的检测
随机抽取重庆市实验动物检测中心87只小鼠,每只小鼠同时收集血清及回盲部内容物,利用DNA试剂盒提取血清DNA样本,进行LAMP扩增,随后每个样本中加入1 μL SYBR Green Ⅰ观察颜色变化;同时,按照《GB/T 14926.17-2001 实验动物 绿脓杆菌检测方法》检测,即采取回盲部内容物接种NAC液体培养基,置于(36±1) ℃培养18~24 h后观察生长情况,对未产生绿色色素者转种NAC琼脂平皿,(36±1) ℃培养18~24 h,对生长特性及菌落特征与铜绿假单胞菌一致的菌落进一步进行生化鉴定;LAMP或《GB/T 14926.17-2001 实验动物 绿脓杆菌检测方法》检测结果为阳性的样本,进一步用PCR方法验证。
3 结果
3.1 反应体系的建立
3.1.1温度优化比较8个温度梯度扩增结果,满足扩增效率最大且用时最短的温度为66 ℃,即确定66 ℃为最佳反应温度(图2)。
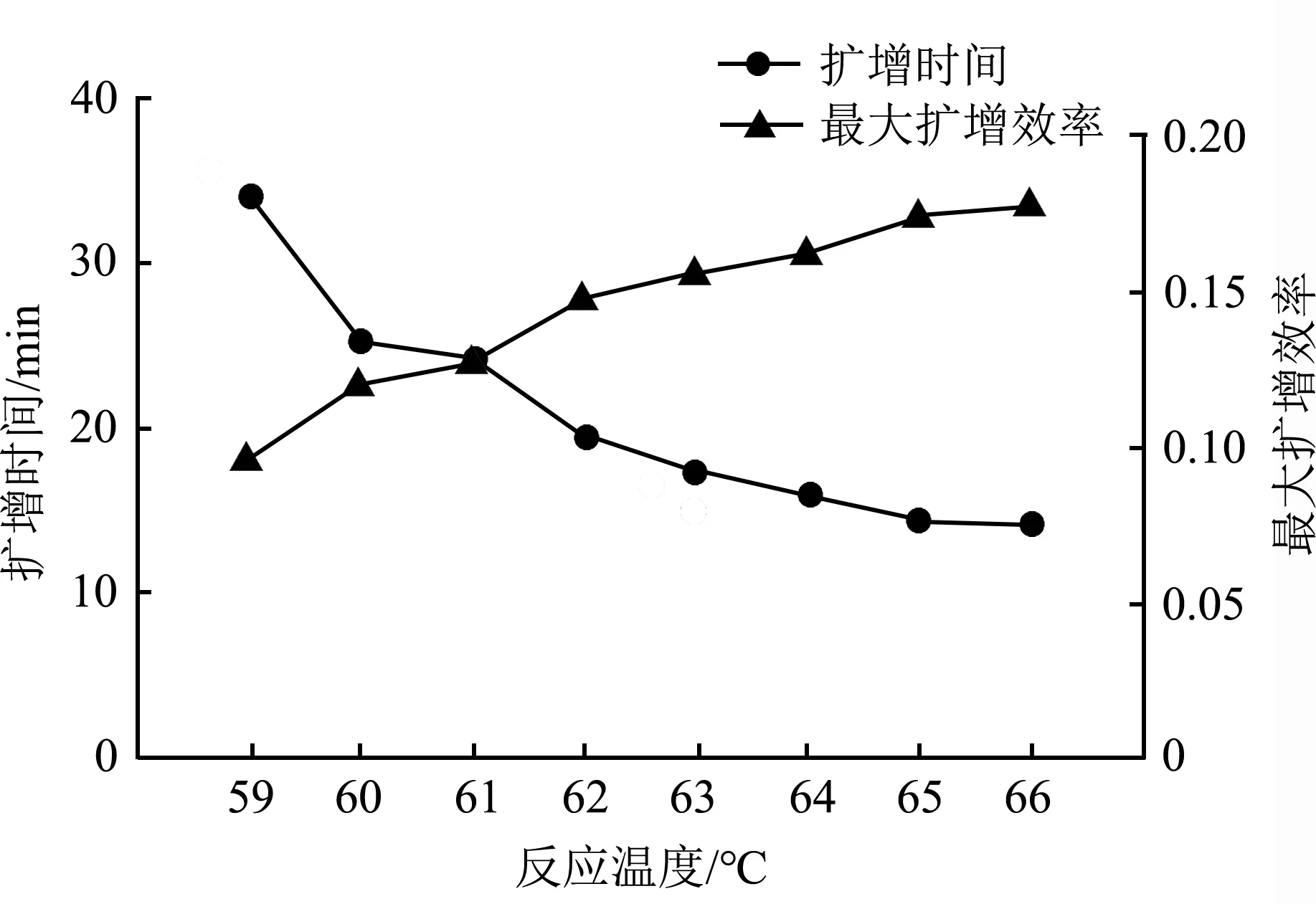
图2 温度优化Fig. 2 Optimization of temperature
3.1.2内引物浓度优化在内引物浓度为70 μmol·L-1时,反应体系在15 min左右开始扩增,此时的最大扩增效率较高,并且达到最大扩增效率用时相对较短,因此将70 μmol·L-1判定为反应的最佳内引物浓度(图3)。
3.1.3环引物浓度优化在环引物浓度为30 μmol·L-1时,反应体系在12 min左右开始扩增,此时的最大扩增效率较高,并且达到最大扩增效率用时较短,故将30 μmol·L-1判定为反应的最佳环引物浓度(图4)。
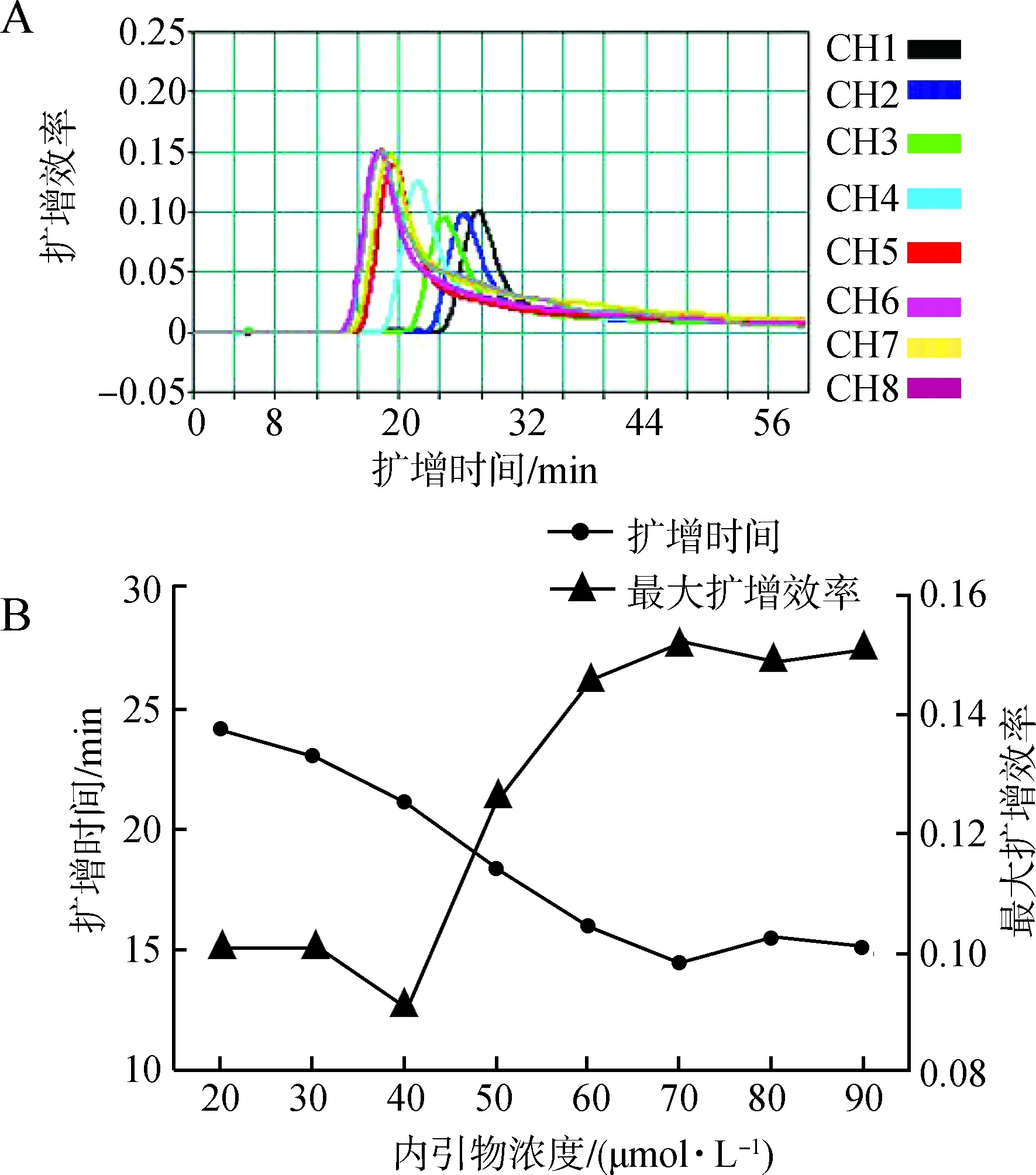
图3 内引物浓度优化Fig. 3 Optimization of inner primers concentration
A.不同内引物浓度下环介导等温扩增技术的扩增效率, CH1~CH8为20~90 μmol·L-1的8个内引物浓度梯度; B. 不同浓度内引物下的扩增时间和最大扩增效率
A.amplification efficiency of loop-mediated isothermal amplification under different concentrations of inner primers, CH1-CH8 indicate different concentration gradients of inner primers from 20 μmol·L-1to 90 μmol·L-1; B. amplification time and maximum amplification rate under different concentrations of inner primers
3.1.4最终反应体系的建立通过优化反应条件最终确定:66 ℃为最佳反应温度,反应体系(25 μL)如下:2×RM缓冲液12.5 μL,70 μmol·L-1FIP、70 μmol·L-1BIP、5 μmol·L-1F3、5 μmol·L-1B3c、30 μmol·L-1LFc、30 μmol·L-1LB、Bst酶和模板DNA各1 μL,无酶水4.5 μL。
3.2 特异性
结果仅显示铜绿假单胞菌的DNA样本为阳性(图5:A);其余6株菌株(鼠伤寒沙门氏菌、甲型副伤寒沙门杆菌、嗜肺巴斯德杆菌、肺炎克雷伯杆菌、2株金黄色葡萄球菌)的DNA样本均为阴性。向扩增后的产物中加1 μL SYBR Green Ⅰ观察颜色,发现只有铜绿假单胞菌的DNA样本能看到翠绿色(图5:B);琼脂糖凝胶电泳结果可知仅铜绿假单胞菌DNA样本扩增出清晰的条带(图5:C)。
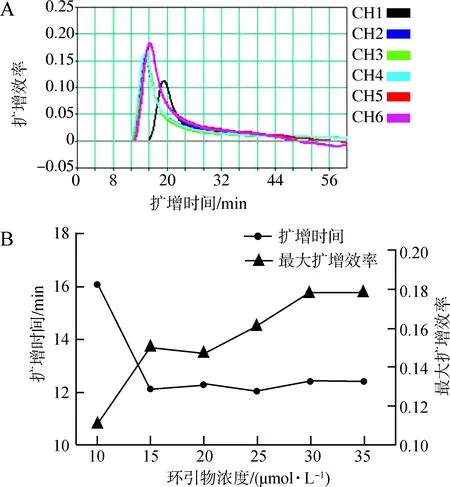
图4 环引物浓度优化Fig. 4 Optimization of loop primers concentration
A.不同环引物浓度下环介导等温扩增技术的扩增效率, CH1~CH6为10~35 μmol·L-1的6个环引物浓度梯度; B. 不同浓度环引物下的扩增时间和最大扩增效率
A.amplification efficiency of loop-mediated isothermal amplification under different concentrations of loop primers, CH1-CH6 indicate different concentration gradients of loop primers from 10 μmol·L-1to 35 μmol·L-1; B. amplification time and maximum amplification rate under different concentrations of loop primers
3.3 稳定性
用新建立的LAMP体系对不同批次不同时间提取的6份DNA检测结果均为阳性(图6),样品管的扩增效率、浊度之间的差异均无统计学意义(P>0.05),表明该检测方法较稳定。
3.4 重复性
用新建立的LAMP体系对6份同批次DNA检测结果均为阳性,且扩增效率和浊度2条曲线的重合率极高(图7),表明该检测方法的重复性较好。
3.5 灵敏度
梯度稀释后的铜绿假单胞菌DNA用LAMP和PCR方法检测,其最低检测浓度分 别 为 2.9×10-7μg·mL-1(图8:A~C)和2.9×10-4μg·mL-1(图8:D、E)。
3.6 临床样本检测
用新建立的LAMP体系扩增87份小鼠血清样本,有10份显示为铜绿假单胞菌阳性,检出率为11.5%(10/87),扩增产物加入SYBR Green Ⅰ 后,观察颜色变化(图9:A)。按照《GB/T 14926.17-2001 实验动物 绿脓杆菌检测方法》对同批次87只小鼠回盲部内容物进行检测的结果均为阴性。用PCR方法扩增LAMP检测的10份阳性样本DNA,扩增产物经1.5%琼脂凝胶电泳,均在1 519 bp和504 bp处可见阳性条带(图9:B、C)。
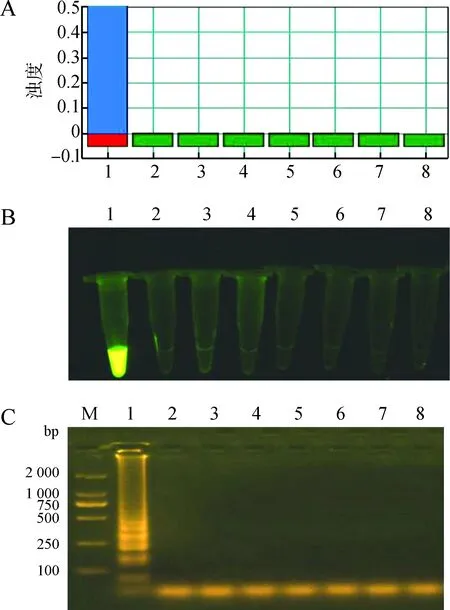
图5 环介导等温扩增技术(LAMP)检测的特异性Fig. 5 Specificity of loop-mediated isothermal amplification (LAMP) assay
A. 不同菌株的LAMP鉴定, B. 荧光鉴定图, C. 琼脂糖电泳图; 1. 铜绿假单胞菌DNA, 2~7分别为鼠伤寒沙门氏菌、甲型副伤寒沙门杆菌、嗜肺巴斯德杆菌、肺炎克雷伯杆菌、金黄色葡萄球菌ATCC25923和CMC6003的DNA, 8. 空白对照, M. DL2000 DNA Marker
A.product identification by LAMP, B. sample fluorescence, C. agarose gel electrophoresis of reaction products; lane 1.PseudomonascaeruginosaDNA product, lanes 2-7.Salmonellatyphimurium,SalmonellaparatyphoidA,Pasteurellapneumotropica,Klebsiellapneumoniae,StaphylococcusaureusATCC25923 and CMC6003 DNA products, 8. control, M. DL2000 DNA Marker
4 讨论
与传统的检测方法相比,LAMP最大的优点在于反应全程均可在恒温条件下进行,避免了温度循环的时间消耗,扩增的反应结果肉眼可见(阳性结果呈白色浑浊),达到快速检测的目的,LAMP的引物是扩增技术的关键(Notomietal.,2000;Yoneyamaetal.,2007)。本研究根据铜绿假单胞菌(Z50191)的oprL基因序列针对8个不同区域所设计的6条特异性引物(Iwamotoetal.,2003;Enomotoetal.,2005;Yamazakietal.,2008)。与GenBank中的铜绿假单胞菌基因序列比对,该引物还包含其他基因序列,如EU28653、JF901474、JN628780、JN628781、JN628782、JN628828、JN717231、KP056547,显示出了引物的高度保守性和特异性。此外,对温度、内引物浓度、环引物浓度的梯度进行优化,最终确立最优方案如下:温度66 ℃,内引物浓度70 μmol·L-1,环引物浓度30 μmol·L-1。
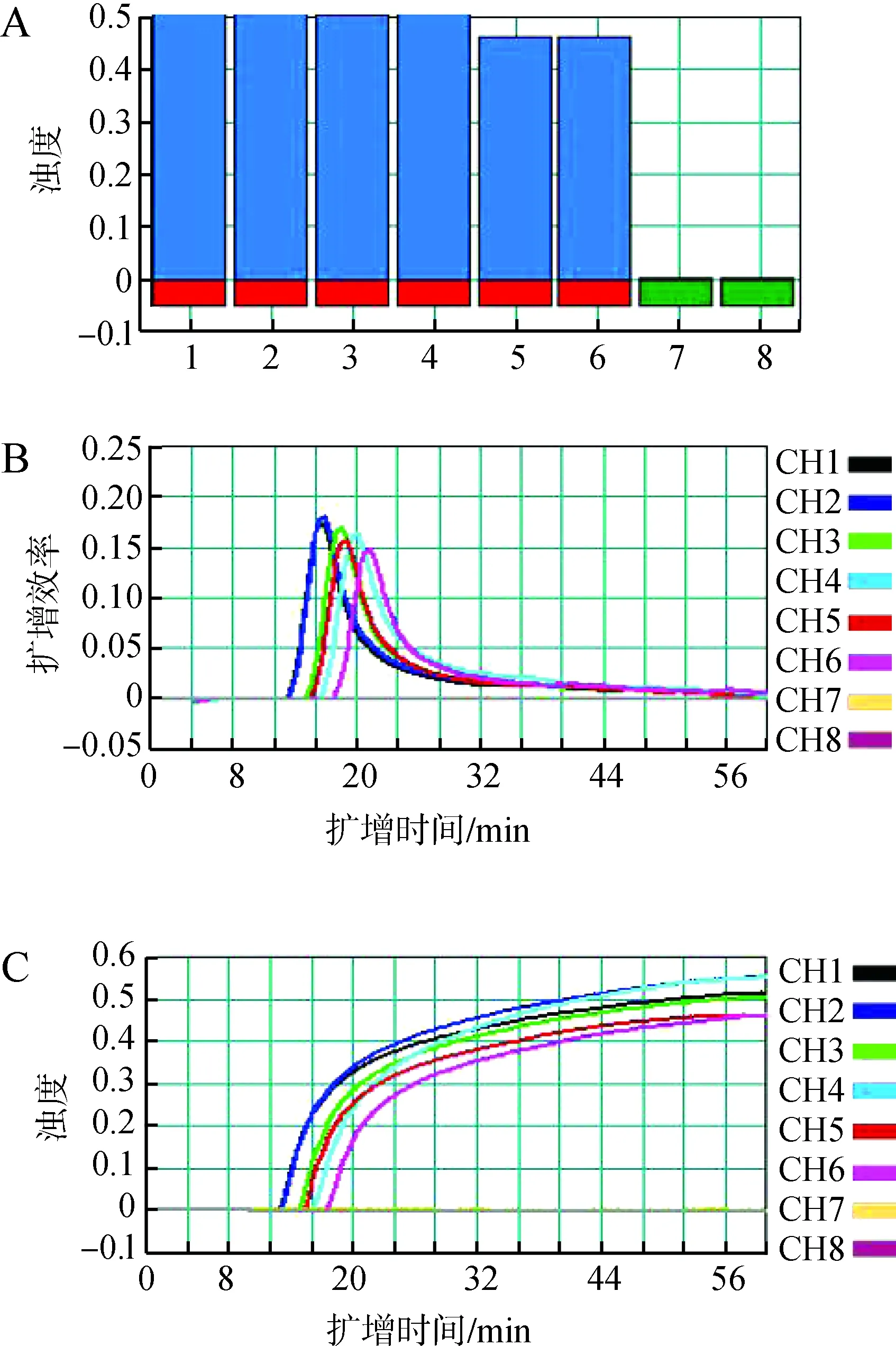
图6 环介导等温扩增技术(LAMP)检测的稳定性Fig. 6 Stability of loop-mediated isothermal amplification (LAMP) assay
A. 样本的鉴定, B. LAMP扩增效率, C. 样本浊度; 1~6为不同批次不同时间提取的铜绿假单胞菌的DNA样本, 7、8为空白对照
A.product identification, B. LAMP amplification efficiency, C. sample turbidity; 1-6 indicate the different batches at different times ofPseudomonasaeruginosaDNA product, 7 and 8 represent the negative control
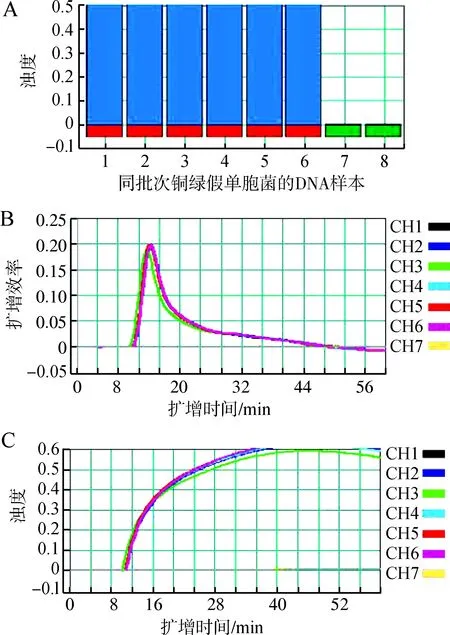
图7 环介导等温扩增技术(LAMP)检测的重复性Fig. 7 Repeatability of loop-mediated isothermal amplification (LAMP) assay
A.样本的鉴定, B. LAMP 扩增效率, C. 样本浊度; 1~6为同批次的铜绿假单胞菌的DNA样本, 7为空白对照, 8为空信号通道
A.product identification, B. LAMP amplification efficiency, C. sample turbidity; 1-6 indicate the same batch at different times ofPseudormonasaeruginnosaDNA product, 7 represents the negative control, 8. null
用新建立的LAMP体系分别检测实验小鼠体内常见的6种病原微生物和不同批次及同一批次的不同时间段的铜绿假单胞菌DNA样本,结果都显示了较高的特异性、重复性和稳定性;再运用标准铜绿假单胞菌DNA比较新建立的LAMP体系与PCR方法检测结果的差异,结果表明,新检测体系能检出的铜绿假单胞菌最低检测限为2.9×10-7μg·mL-1,比普通PCR (2.9×10-4μg·mL-1)的灵敏度高出103倍,与已报道方法(Zhaoetal.,2011)(比普通PCR方法高102倍)比较,其灵敏度更高。
为了评价新建立的LAMP方法在实验动物铜绿假单胞菌检测中的应用价值,对87份小鼠血清样本进行了检测,检出率为11.5%(10/87),而利用《GB/T 14926.17-2001 实验动物 绿脓杆菌检测方法》的检出率为0%(0/87),同时,16SrRNA和oprL利用PCR方法进行阳性样本验证时,其结果与LAMP方法检测结果完全一致(10/10);实验结果显示,LAMP检测方法比传统分离培养检测方法的检出率高。在检测手段上,《GB/T 14926.17-2001 实验动物 绿脓杆菌检测方法》需要各种不同的培养基(如:NAC液体/固体培养基、普通营养琼脂培养基、糖发酵培养基等),还需要肉眼选择可疑菌落进行生化试验,检测时间长,不可控因素也较多。尽管与传统PCR方法检测结果一致,但新LAMP检测体系不需要特殊仪器,操作简单,非常适合基层单位,能够有效地应用于人和动物的铜绿假单胞菌检测,对保证人及动物安全具有重要意义;也为实验动物铜绿假单胞菌的质量控制提供了新的、可靠的检测方法。
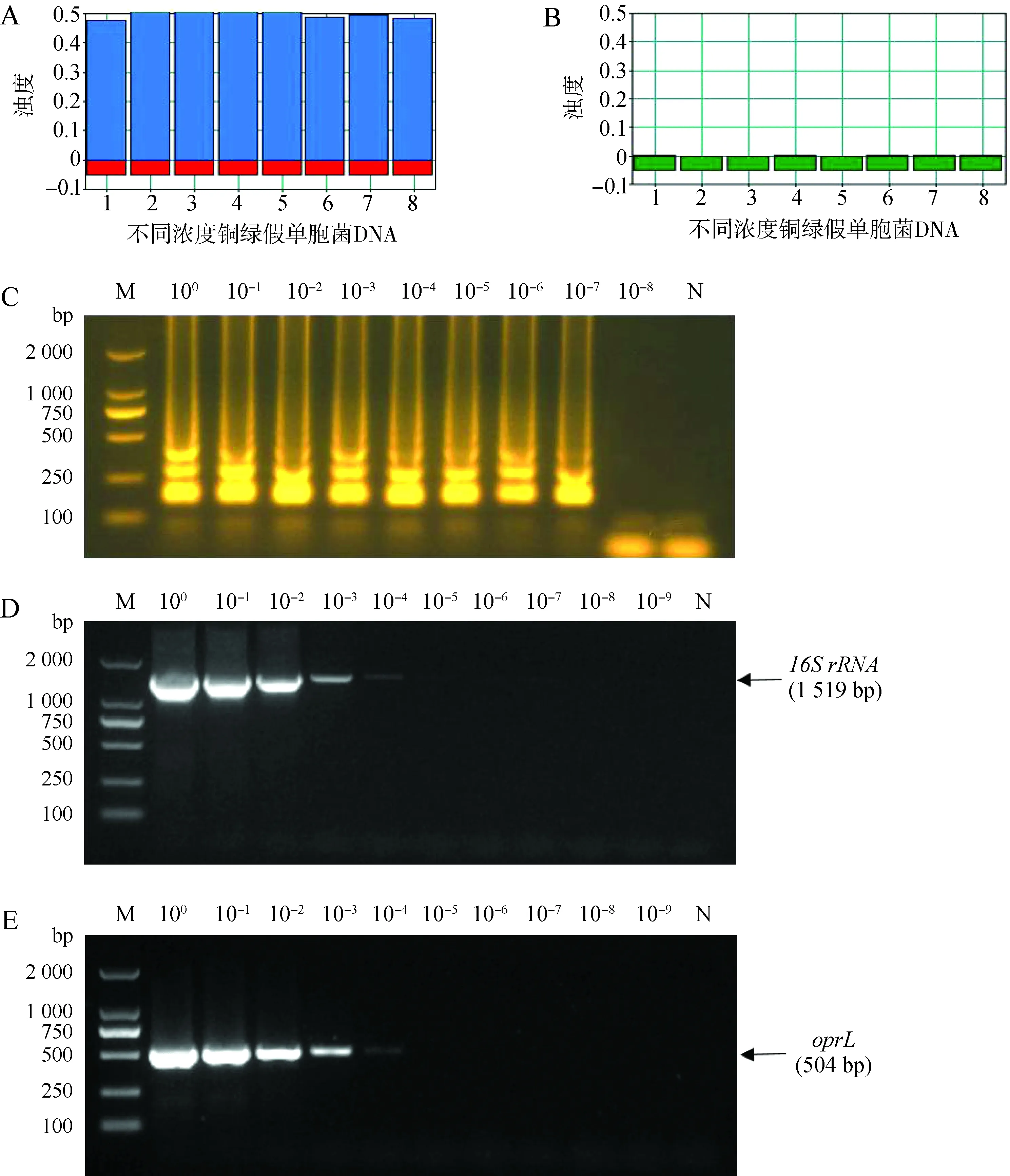
图8 环介导等温扩增技术(LAMP)检测的灵敏度Fig. 8 Sensitivity of loop-mediated isothermal amplification (LAMP) assay
A. 样本的鉴定, 1~8分别为按照100~10-7稀释的铜绿假单胞菌DNA; B. 样本的鉴定, 1为稀释10-8的铜绿假单胞菌DNA, 2为空白对照, 3~8为空信号通道; C. LAMP凝胶电泳图(M为DL2000 DNA Marker, 2~9分别为按照100~10-8稀释的铜绿假单胞菌DNA, N为阴性对照); D. 16SrRNAPCR凝胶电泳图(M为DL2000 DNA Marker, 2~10分别为按照100~10-9稀释的铜绿假单胞菌DNA, N为阴性对照); E.oprLPCR凝胶电泳图(M为DL2000 DNA Marker, 2~10分别为按照100~10-9稀释的铜绿假单胞菌DNA, N为阴性对照)
A. product identification, dilutedPseudomonasaeruginosaDNA according to 100-10-7from lanes 1-8; B. product identification, lane 1. diluted 10-8P.aeruginosaDNA, lane 2. control, lane 3-8. null; C. agarose gel electrophoresis of LAMP reaction products (M. DL2000 DNA Marker, lanes 2-9. 10-fold serial dilutions ofP.aeruginosaDNA, lane N. negative control); D. agarose gel electrophoresis of 16SrRNAPCR amplification (M. DL2000 DNA Marker, lanes 2-10. 10-fold serial dilutions ofP.aeruginosaDNA, lane N. negative control); E. agarose gel electrophoresis ofoprLPCR amplification (M. DL2000 DNA Marker, lanes 2-10, 10-fold serial dilutions ofP.aeruginosaDNA, lane N. negative control)
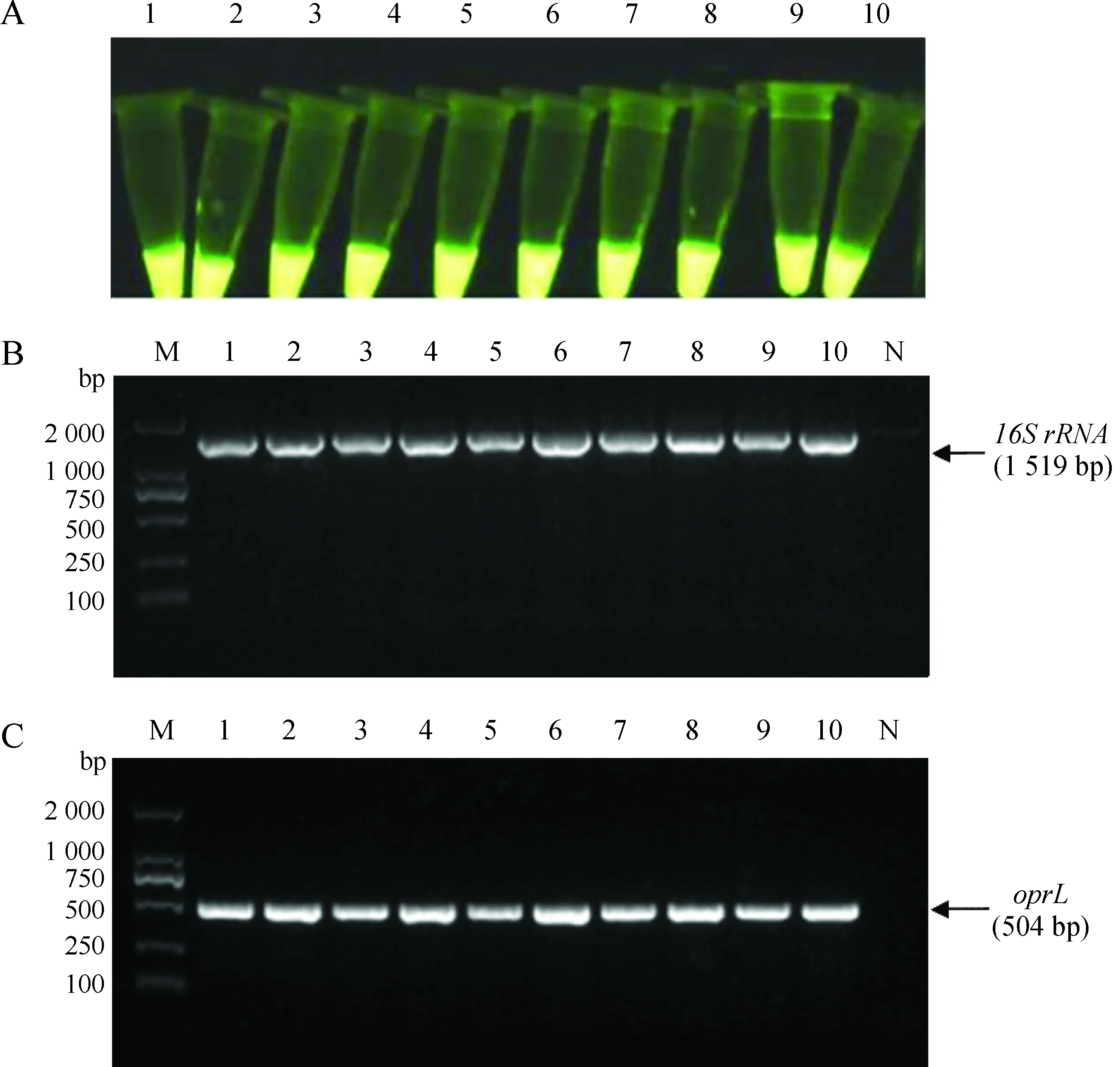
图9 小鼠血清样本检测结果
Fig. 9 Detection results of mouse serum samples
A. 环介异等温扩增技术反应阳性结果(1~10为阳性样本); B. 16SrRNAPCR凝胶电泳图(M为DL2000 DNA Marker, N为阴性对照);C.oprLPCR凝胶电泳图(M为DL2000 DNA Marker, 1~10为阳性样本, N为阴性对照)
A. fluorescence result of loop-mediated is othermal amplification (lanes 1-10. positive samples); B. agarose gel electrophoresis of 16SrRNAPCR amplification (M. DL2000 DNA Marker, lanes 1-10. positive samples, lane N. negative control); C. agarose gel electrophoresis ofoprLPCR amplification (M. DL2000 DNA Marker, lanes 1-10. positive samples, lane N. negative control)
