钾/钠离子对水热合成铯榴石结构的影响
2019-02-14卢忠远
李 军,侯 莉,卢忠远
(1.中国工程物理研究院 激光聚变研究中心,四川 绵阳 621900;2.西南科技大学 环境友好能源材料国家重点实验室,四川 绵阳 621010;3.西南科技大学 材料科学与工程学院,四川 绵阳 621010)
铯榴石是137Cs稳定存在的主要天然矿物形式,理论上可容纳超过40%(质量分数)的Cs,同时还具有高熔点、低热膨胀系数、抗热震等特性,这使其成为富137Cs放射性废物的理想固化基材和航空航天用特种陶瓷备选材料[1-7]。一般来说,纯相、高致密度的铯榴石需用高温固相反应法制备[8],但Cs+的高温挥发性使该方法并不适于核素137Cs的铯榴石陶瓷固化。采用地聚合物、Cs+交换沸石等为前驱体,可进一步降低铯榴石烧结温度[6,8-11]。近年来,研究人员发现,水热处理载Cs地聚合物、Cs污染土壤、含Cs焚烧灰、铯硅铝氧化物悬浮液等可直接获得铯榴石,这为其低温合成和可能的137Cs固化处理、特种陶瓷粉体以及沸石应用提供了有益参考[1-3,5,7,11]。铯榴石(CsAlSi2O6)、白榴石(KAlSi2O6)、方沸石(NaAlSi2O6)均属于方沸石型结构,由共用桥氧的(Al,Si)O4四面体网络结构骨架和平行分布于〈111〉方向通道中的碱金属离子构成[12-13]。从组成和结构来看,碱金属离子在上述3种结构中占据相同晶格位点,理论上可以任意比例相互替代。尽管如此,研究表明,碱金属离子在铯榴石结构中的相互替代存在比例限制,超过优化比例则两种或几种晶体结构同时存在,这将对铯榴石的结构和性能产生重要影响[10-11]。
考虑到富137Cs放射性废物中Cs+通常与K+、Na+共存,以及水热法制备的铯榴石材料在低温晶格固化放射性137Cs方面具有潜在的巨大优势,本文拟通过实验进一步阐明K+和Na+对Cs+的替代对水热合成铯榴石组成和结构的影响。
1 实验方法
1.1 原料
KS-1300型偏高岭土(MK),SiO2含量为52.92%,Al2O3含量为43.85%,粒度<5 μm,内蒙古超牌高岭土有限公司;HL-150型气相法纳米二氧化硅(NS),粒度<30 nm,广州吉必盛科技有限公司;CsOH·H2O,纯度99.5%,江西东鹏新材料有限公司;NaOH和KOH,分析纯,成都科龙化工试剂有限公司。实验用水为自制去离子水。
1.2 样品制备
按照方沸石型结构MAlSi2O6(M=Cs,K,Na或几者复合)化学计量组成配制各原料。首先将称量好的NS溶解于CsOH·H2O、KOH、NaOH或混合碱金属强碱水溶液中,搅拌均匀形成澄清溶液;然后将MK分散于澄清溶液中,磁力搅拌均匀,形成悬浮液;取105 mL悬浮液转入150 mL带聚四氟乙烯内胆的水热反应釜中;反应釜封闭后置于120~200 ℃的恒温鼓风干燥箱中水热反应20 h;冷却后取出,用去离子水和酒精清洗样品,离心分离;固体样品在60 ℃真空干燥箱中干燥48 h。
1.3 样品表征
采用荷兰帕纳科公司X’Pert PRO型X射线衍射仪(XRD)分析样品晶相结构(Cu Kα,λ=0.154 18 nm);采用蔡司公司的Ultra 55型场发射扫描电子显微镜(SEM)表征样品微观结构;采用蔡司公司的Libra 200FE型高分辨透射电镜(TEM)进一步表征样品微观结构。
2 结果与讨论
2.1 水热合成铯榴石组成及结构
首先,以CsOH·H2O为碱源,不掺入KOH或NaOH,研究纯相铯榴石水热形成及产物结构。图1为不同温度下水热反应20 h产物的XRD谱。由图1可见,铯榴石在140 ℃水热反应温度下即开始生成,随反应温度的升高,铯榴石特征衍射峰增强,180 ℃下水热产物铯榴石特征峰强度更高且更为尖锐,表明其结晶度和晶体数量均有增加。强碱环境中,无定形铝硅酸盐在OH-作用下溶解解聚形成[SiO4]和[AlO4]-单体(也称[Al(OH)4]-和[OSi(OH)3]-离子团);随着溶解反应的进行,[SiO4]和[AlO4]-单体/离子团数量增加,并在碱金属阳离子的吸引下聚集于Cs+周围;单体/离子团发生缩聚反应形成碱铝硅酸盐多聚体,碱金属阳离子起到平衡结构中[AlO4]-负电荷的作用[11,14]。碱铝硅酸盐多聚体继续缩聚并向高聚态发展,结构有序度逐渐增加,成核并结晶生长为铯榴石。本研究所用原料MK、NS均为无定形高活性材料[11],易于在强碱溶液中溶解形成单体/离子团,同时拥有更大离子半径的Cs+更易形成并稳定高聚合态的铝硅多聚体[15-16],该聚合体也更易成核、结晶,这使得铯榴石在较低的水热反应温度下形成。
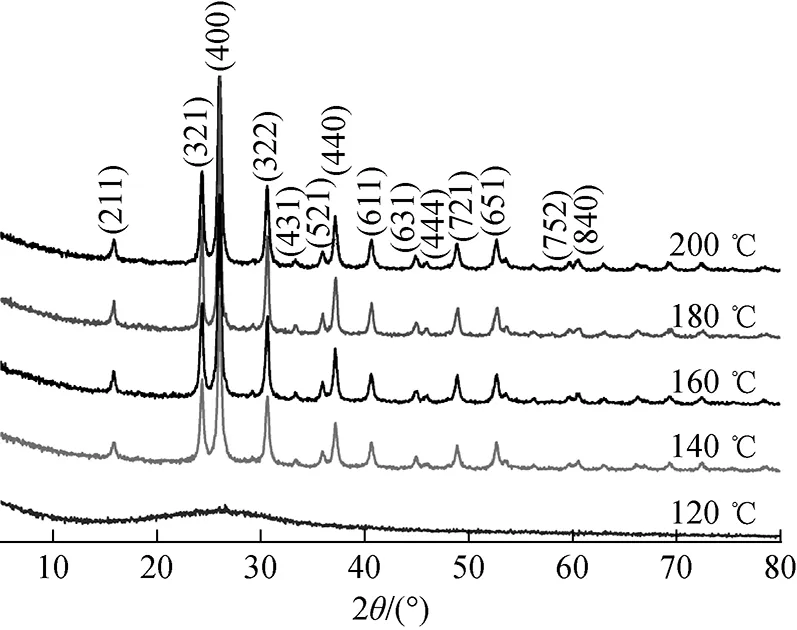
图1 不同温度下水热反应20 h产物的XRD谱Fig.1 XRD patterns of hydrothermal productat different temperatures for 20 h

a——MK;b——120 ℃;c——140 ℃;d——160 ℃;e——180 ℃;f——200 ℃图2 不同温度下水热反应20 h产物的SEM图像 Fig.2 SEM images of hydrothermal product at different temperatures for 20 h
原料MK和不同温度下水热反应产物的微观形貌如图2所示,MK主要为层片状颗粒;120 ℃水热反应产物以纳米级小颗粒和片状颗粒为主,纳米级小颗粒可能是尚处于晶化、生长状态下的铯铝硅酸盐前驱物沉淀,而片状颗粒为尚未反应完全的MK;提高水热温度,体系出现直径300 nm左右球形颗粒;进一步提高温度,微球尺寸均匀性改善。180 ℃水热反应20 h产物的微观结构及EDS谱示于图3。由图3可见,产物由平均直径约300 nm的球形颗粒组成(图3a),单个球形颗粒化学组成(原子数)中Cs/Al/Si原子比=8.86/7.63/19.12(图3b),与铯榴石的理论化学组成接近,TEM图像再次证明了颗粒的球形形貌(图3c);单个球形颗粒表面较为粗糙、有棱角(图3d)。图3e的SAED图证明微球为多晶;图3f的HRTEM图像证明球形颗粒由纳米晶粒组成,纳米晶粒晶格条纹对应于铯榴石的d(321)晶面。由于晶体生长具有自限性,水热合成的立方相铯榴石晶体微观下多呈立方体形貌[11]。本研究水热合成的铯榴石微球虽呈球形,但其为多晶态,由有棱角的、近似立方体的纳米级颗粒组成。
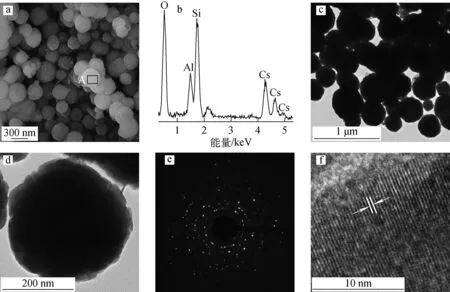
a——SEM;b——EDS;c、d——TEM;e——SAED;f——HRTEM图3 180 ℃水热反应产物的微观结构及EDS谱Fig.3 Microstructure and EDS pattern of hydrothermal product at 180 ℃
2.2 K+对水热合成铯榴石组成和结构的影响
研究表明,采用高温烧结条件,K+和Cs+可相互替代进入铯榴石或白榴石结构位点,从而形成K替代型铯榴石、Cs替代型白榴石或两者的固溶体[10-11,17-19]。但水热条件下Cs+与K+是否能相互替代进入相应结构位点则尚未见报道。基于此,本文重点研究K+和Cs+共存体系在180 ℃水热反应20 h条件下水热产物的组成和结构,不同K+掺加量的样品以CsxK1-x形式标记。图4a为CsxK1-x体系180 ℃水热反应20 h产物的XRD谱,无K+存在时产物为铯榴石;随着K+摩尔含量的增加,铯榴石特征衍射峰强度下降且趋于消失,钾铝硅酸盐水合物(K2Al2Si4O16·nH2O)逐步显现;体系无Cs+时,产物由结晶较差的钾铝硅酸盐水合物以及原料MK所带入的未反应石英组成。对XRD谱中23.5°~27°范围内的区域放大(图4b),可发现铯榴石特征峰位置并未随K+含量的增加发生明显变化,但其强度逐渐降低,说明Cs+和K+并未进入铯榴石或钾铝硅酸盐水合物晶格中的对应结构位点。
对CsxK1-x体系180 ℃水热反应20 h的产物进行微观形貌观察,其SEM图像如图5所示,图5中标注区域的EDS分析结果列于表1。在K+含量较低的CsxK1-x(x≥0.8)体系中,颗粒基本呈球形、表面相对光滑,其化学组成近于CsxK1-xAlSi2O6,且K+含量相对更低;提高K+掺入量(0.1≤x<0.8),产物主要由微球和不规则类凝胶颗粒组成,球形颗粒化学组成均与铯榴石相近,且K+含量低,而类凝胶体中K+含量相对更高;当K+全部替代Cs+时,体系未见有球形颗粒,主要由不规则颗粒组成。
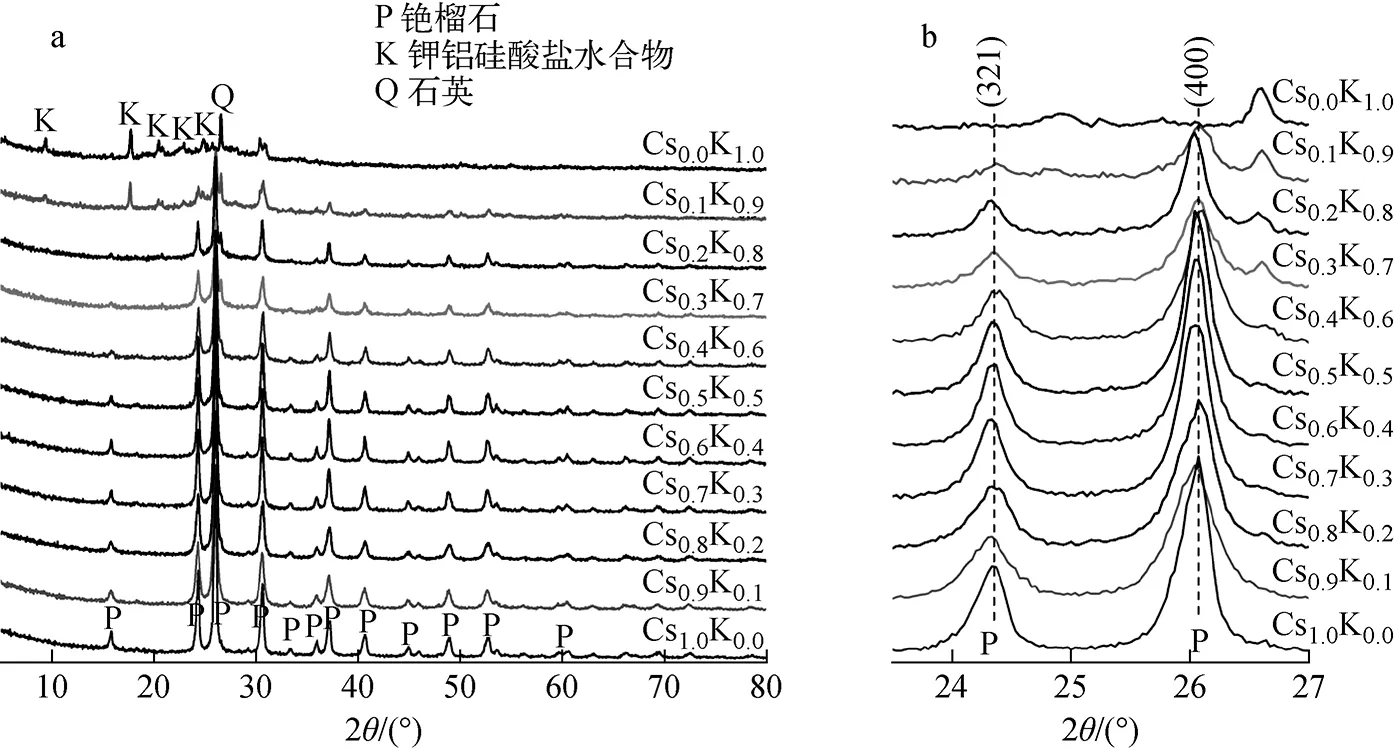
图4 CsxK1-x体系180 ℃水热反应20 h产物的XRD谱Fig.4 XRD pattern of CsxK1-x system hydrothermal product at 180 ℃ for 20 h

图5 水热产物的SEM图像及其中各标注点的EDS谱Fig.5 SEM image and EDS pattern of CsxK1-x system hydrothermal product at 180 ℃ for 20 h
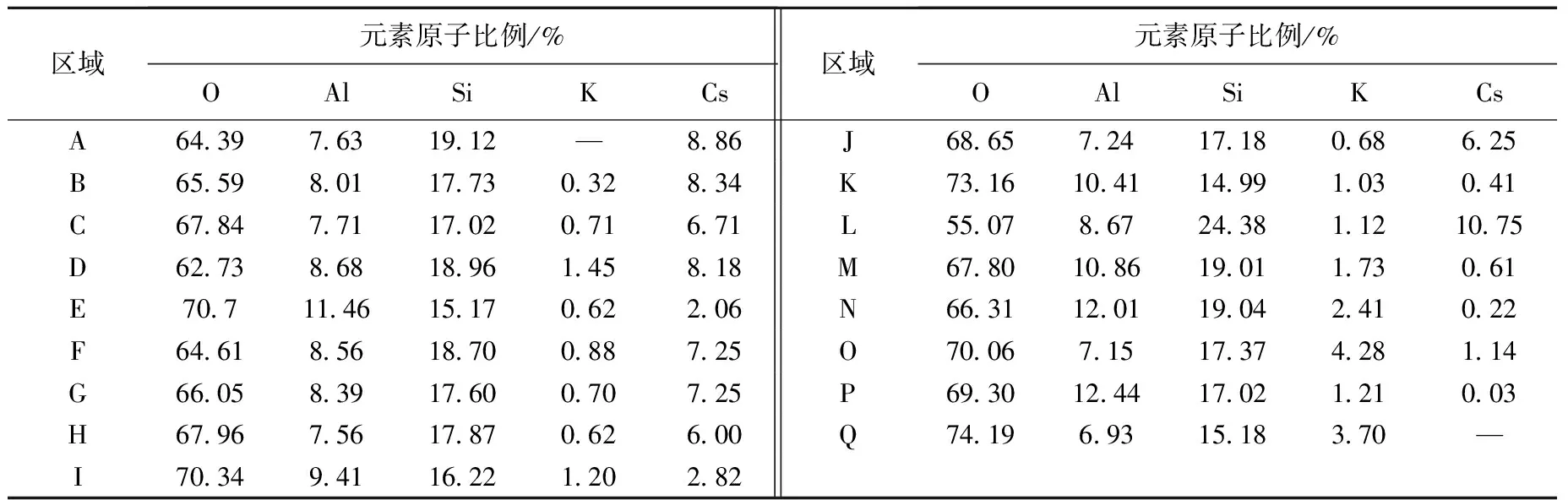
区域元素原子比例/%OAlSiKCs区域元素原子比例/%OAlSiKCsA64.397.6319.12—8.86J68.657.2417.180.686.25B65.598.0117.730.328.34K73.1610.4114.991.030.41C67.847.7117.020.716.71L55.078.6724.381.1210.75D62.738.6818.961.458.18M67.8010.8619.011.730.61E70.711.4615.170.622.06N66.3112.0119.042.410.22F64.618.5618.700.887.25O70.067.1517.374.281.14G66.058.3917.600.707.25P69.3012.4417.021.210.03H67.967.5617.870.626.00Q74.196.9315.183.70—I70.349.4116.221.202.82
对Cs0.4K0.6和Cs0.0K1.0体系不同水热温度下产物的矿物组成进行对比分析,结果示于图6。Cs0.4K0.6体系120 ℃反应即有铯榴石生成,说明尽管K+未进入并占据铯榴石结构的Cs位,但其掺入有利于铯榴石水热晶化温度进一步降低;温度升高到≥160 ℃,铯榴石衍射峰强度大幅提高,钾铝硅酸盐水合物衍射峰变得不明显。Cs0.0K1.0体系120 ℃水热反应时,除原料MK带入的石英外,未发现其他结晶矿物;水热反应温度≥140 ℃时,体系主要由钾铝硅酸盐水合物组成。

图6 不同温度下Cs0.4K0.6(a)和Cs0.0K1.0(b)体系水热反应20 h产物的XRD谱Fig.6 XRD patterns of Cs0.4K0.6 (a) and Cs0.0K1.0 (b) system hydrothermal product at different temperatures for 20 h
综合以上结果可知,在当前水热条件下,K+并未进入铯榴石结构中的Cs位。研究[1]认为,相比于Na+和K+,离子半径更大的Cs+具有择优占位效应,因此在Na+或K+与Cs+共存的水热反应体系中,Cs+将优先进入结构位点并形成铯榴石。另外,方沸石型晶体结构中沸石通道是由[SiO4]和[AlO4]-联接成的六元环组成,通道尺寸为0.28 nm,而Cs+直径为0.334 nm,即一旦铯榴石形成且Cs+进入结构位点,Cs+不会通过通道迁移或与其他离子进行交换[13]。以此推论,由于铯榴石优先水热晶化形成,Cs+离子在其结构位点不能迁移及与其他离子交换,使得K+未进入铯榴石结构中。
2.3 Na+对水热合成铯榴石组成和结构的影响
以NaOH等摩尔量替代CsOH·H2O,研究Na+和Cs+共存体系在180 ℃水热反应20 h条件下的水热产物组成和结构,该体系以CsxNa1-x形式标记,结果示于图7。由图7a可知,体系无Na+时水热反应产物为铯榴石;体系无Cs+时,水热反应产物为方沸石;当Na+与Cs+共存时,随着Na+掺量的增加,铯榴石的d(211)或方沸石的d(221)特征峰强度大幅提高,方沸石d(220)特征衍射峰开始出现并增强。对XRD谱中23.5°~27°范围内的特征峰局部放大(图7b),可看到方沸石d(312)和d(400)特征衍射峰均位于较低角度,而相应的铯榴石d(321)和d(400)两特征峰则位于较高角度。Cs+半径远大于Na+,若Na+进入并占据铯榴石结构中Cs+的位置,则铯榴石晶面间距减小、特征衍射峰向高角度偏移;若Cs+进入并占据方沸石结构中Na+的位置,则方沸石晶面间距增大、特征衍射峰向低角度偏移。但由图7可知,特征衍射峰角度并未依上述规律偏移,这与Jing等[1]的研究结果一致。
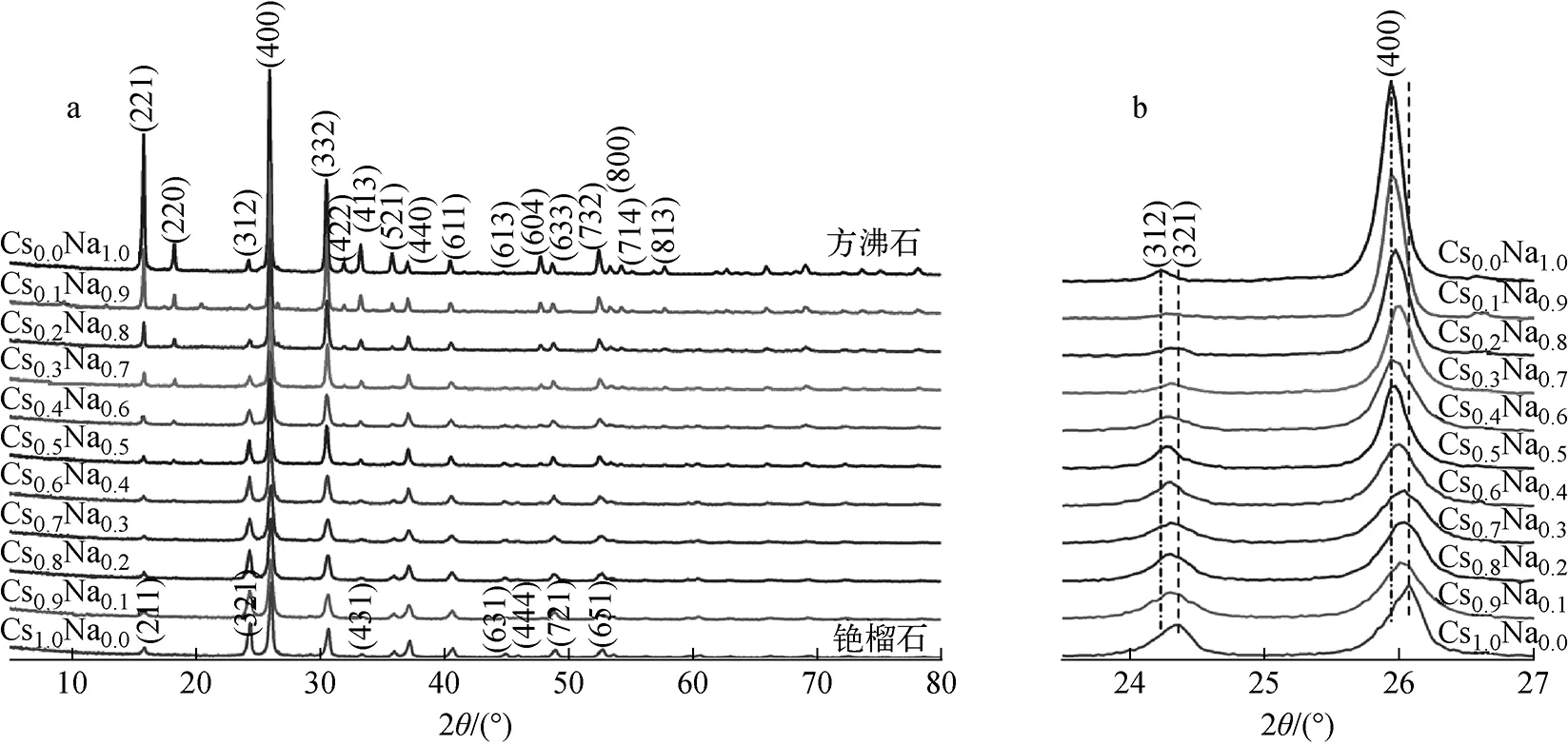
图7 CsxNa1-x体系180 ℃水热反应20 h产物的XRD图谱Fig.7 XRD patterns of CsxNa1-x system hydrothermal product at 180 ℃ for 20 h

图8 CsxNa1-x体系水热产物SEM图像及其中各标注点的EDS谱Fig.8 SEM image and corresponded EDS pattern of CsxNa1-x system hydrothermal product at 180 ℃ for 20 h
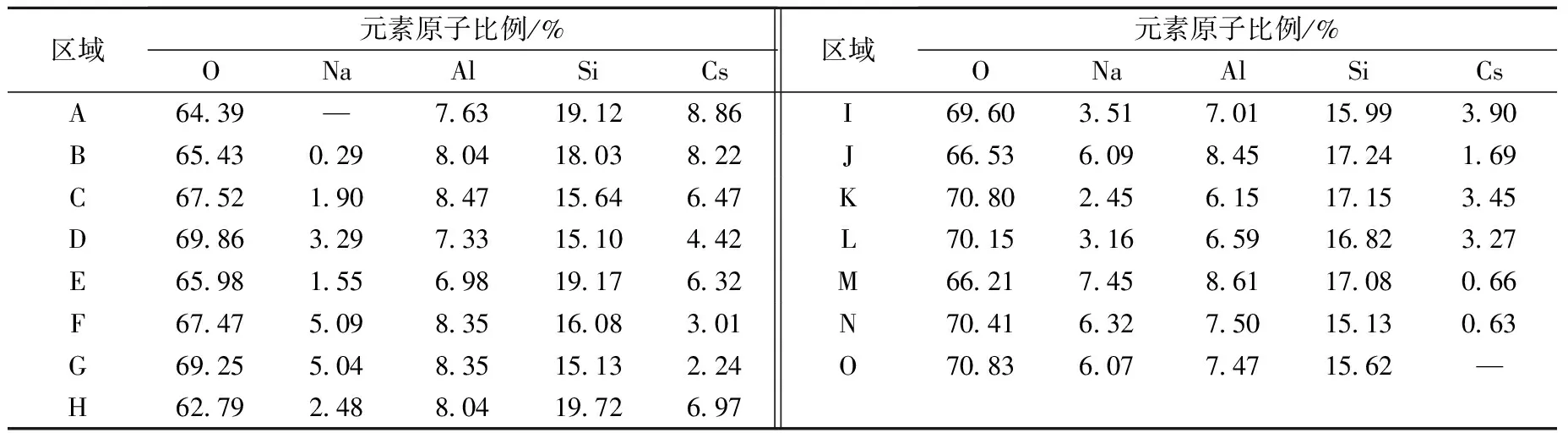
区域元素原子比例/%ONaAlSiCs区域元素原子比例/%ONaAlSiCsA64.39—7.6319.128.86I69.603.517.0115.993.90B65.430.298.0418.038.22J66.536.098.4517.241.69C67.521.908.4715.646.47K70.802.456.1517.153.45D69.863.297.3315.104.42L70.153.166.5916.823.27E65.981.556.9819.176.32M66.217.458.6117.080.66F67.475.098.3516.083.01N70.416.327.5015.130.63G69.255.048.3515.132.24O70.836.077.4715.62—H62.792.488.0419.726.97
CsxNa1-x体系水热产物微观形貌如图8所示,图8中SEM图像上标注区域的EDS分析结果列于表2。对于x≥0.7的CsxNa1-x体系,水热反应产物颗粒基本呈球形、表面相对光滑,化学组成近于CsxNa1-xAlSi2O6,且Na含量相对较低;对于0.4≤x≤0.6的CsxNa1-x体系,水热反应产物主要由表面相对光滑的球体和表面粗糙、有棱角的球体共同组成,表面光滑球体Cs+含量高、而表面有棱角球体则Na+含量高;对于0.2≤x≤0.3的CsxNa1-x体系,产物中还出现有立方块聚集体以及小的立方体,立方块和立方块聚集体Na+含量远高于Cs+,表明其主要为方沸石;对于x≤0.1的CsxNa1-x体系,产物主要由边缘相对光滑的近球形立方体组成,EDS分析结果证明其主要为方沸石。综合SEM及EDS分析结果,可认为CsxNa1-x体系水热反应产物主要是铯榴石和方沸石,且铯榴石趋向于尺寸较小的球形,而方沸石趋向于立方体或立方体聚集体。
基于上述分析结果并与CsxK1-x体系进行对比发现,CsxNa1-x体系水热反应产物为铯榴石和方沸石,Cs+主要存在于铯榴石中,Na+主要存在于方沸石中,且根据Cs+和Na+含量变化,CsxNa1-x体系可能会形成结构近于铯榴石或方沸石的固溶体。尽管如此,Cs+和Na+并未相互取代进入并占据铯榴石或方沸石的相应结构位点。在Na+与Cs+共存的铝硅酸盐水热反应体系中,铯榴石仍将优先形成,且Cs+能稳定固化于铯榴石晶体结构中而不会与Na+进行交换;而体系中的Na+将进入方沸石结构中。同时,Na+的存在将有利于铯榴石水热晶化温度的进一步降低和晶体进一步生长。
3 结论
1) 采用水热法制备了铯榴石微球,发现铯榴石在140 ℃即可水热生成,这可能是由于离子半径更大的Cs+对高聚合态铝硅聚合体的稳定效应及其自身的择优占位效应。
2) 无Cs+存在时,CsxK1-x体系水热反应产物为钾铝硅酸盐水合物,CsxNa1-x体系水热反应产物为方沸石;K+或Na+和Cs+同时存在时,铯榴石水热晶化温度进一步降低,但K+和Na+均未进入并占据铯榴石结构中的Cs位,这主要是由于铯榴石优先形成,其结构位点的Cs+不能通过沸石通道迁移并与其他离子交换。
3) 可预期,在利用铝硅酸盐水热反应体系固化K+、Na+、Cs+共存的放射性废物时,铯榴石仍将优先形成,且Cs+能优先进入并稳定固化于铯榴石晶体结构中而不会与K+、Na+进行交换替代。此外,体系中未能进入铯榴石结构中的K+、Na+将赋存于钾铝硅酸盐水合物和方沸石晶体结构中。
