异叶青兰总黄酮对去甲肾上腺素诱导大鼠心肌细胞肥大的抑制作用*
2019-02-14蒋红何雯张晨
蒋红,何雯,2,张晨
(1.新疆医科大学护理学院,乌鲁木齐 830011,2.长沙市第一医院药学部,长沙 410005)
心肌肥大(cardiac hypertrophy)是心脏应对长期压力超负荷缓慢产生的一种代偿机制,常伴随蛋白质合成增加、心脏结构重构和细胞器的功能障碍,主要表现为心肌细胞体积增大、胶原纤维形成的肌节增加及胚胎基因的再表达,是先天性心脏病、高血压、心肌梗死、心力衰竭等多种心血管疾病共有的病理过程[1]。导致心肌肥厚的因素除机械因素(各种原因导致的压力或容量超负荷)外,神经体液性因素,如去甲肾上腺素(noradrenaline,NE)、血管紧张素Ⅱ(AngⅡ)、甲状腺素、加压素、内皮素以及多种生长因子等,也在心肌肥厚的进展中起着重要作用[2]。其中,NE是体内主要的交感神经递质和内分泌激素,在病理情况下,可诱发心肌细胞肥大、凋亡以及心肌细胞坏死等心肌重塑,是公认的心肌肥厚因子[3]。研究表明,NE主要通过肾上腺素能α1和β受体诱导心肌肥厚。α1受体与Gq蛋白耦联,β肾上腺素能受体与Gs蛋白耦联。α1受体激活后可激活细胞内磷酸酯酶 C(phosphatase C,PLC),水解4,5-磷酸肌醇二磷酸(4,5-inositol phosphate diphosphate,PIP2),升高三磷酸酯(triguaiacyl phosphate,IP3)和甘油二酯(diglyceride,DAG),DAG的升高可激活蛋白激酶 C(protein kinase C,PKC)。β肾上腺素能受体激活后可活化腺苷酸环化酶(adenyl cyclase,AC),使三磷酸腺苷(adenosine triphosphate,ATP)转变成环磷酸腺苷(cyclic adenosine monophosphate,cAMP),细胞内cAMP蓄积,cAMP的增多可激活蛋白激酶A(protein kinase A,PKA)。PKC和PKA的激活是导致心肌肥厚的关键步骤,二者都可激活MAPK信号转导通路,引起心肌肥厚[4]。异叶青兰是维吾尔族及藏族民间传统用药,有研究表明,其具有治疗高血压、肺热咳嗽、支气管炎等功效,具有良好的抗氧化活性,且本课题前期研究发现,异叶青兰总黄酮(DracocephalumHeterophyllumBenth flavonoid,DHBF)可降低肾血管性高血压大鼠血压,可改善左室收缩舒张功能和心肌收缩力,其作用机制尚不明确[5]。因此,笔者在本研究拟进一步观察DHBF对NE诱导的大鼠心肌细胞肥大的影响,体外实验探讨DHBF对心肌细胞肥厚的抑制作用,为进一步探讨其作用机制提供依据。
1 材料与方法
1.1实验动物 无特定病原体(SPF)级SD新生乳鼠,出生3 d内,由新疆医科大学第一附属医院实验动物中心提供。实验动物生产许可证号:SCXK(新)2003-0001。饲养于新疆医科大学一附院科技楼SPF环境,许可证号:SYXK(新)2010-0003。动物合格号:No.65000700000650。
1.2药品、试剂与主要设备 DEBF:异叶青兰于2016年7—8月在新疆克孜勒苏柯尔克孜自治州阿克陶县奥依塔克镇奥依塔克村收集,经中国科学院新疆生态与地理研究所植物分类研究室沈观冕研究员鉴定为青兰属植物异叶青兰全草。其后由新疆理化技术研究所进行晾干、粉碎,浸泡于50倍体积70%乙醇,回流提取3次,合并提取液,然后用AB-8大孔吸附树脂纯化制备,提取液趁热滤过去除不溶性沉淀,加分离剂冷却析出棕色结晶,离心,沉淀物经70 ℃烤干即为DEBF,经鉴定总黄酮含量为560 g·kg-1;去甲肾上腺素(美国Sigma公司,批号:SLBC0359V);哌唑嗪(上海信裕生物科技有限公司,批号:100164-201602);胎牛血清(FBS,上海桥星贸易有限公司,批号:1616756);双抗(青霉素链霉素溶液,美国Hy Clone公司,批号:J170006);D-Hanks溶液(石家庄博士德软件科技开发有限公司,批号:09I22C75);胰蛋白酶(美国Sigma公司,批号:J170007);Ⅱ型胶原酶(美国Worthington公司,批号:46D16553);谷氨酰胺(美国Sigma公司,批号:RNBF4742);CCK-8细胞试剂盒(石家庄博士德软件科技开发有限公司,批号:NO60410);定量聚合酶链反应(PCR)试剂盒(德国Thermo有限公司,批号:AK9403);逆转录酶试剂盒(德国Thermo有限公司,批号:152104);抗钙调素蛋白酶(calcineurin,CaN)抗体(英国Abeam公司,批号:ab32117);抗T 细胞核活化因子-3( T nuclear activator factor -3,NFAT-3)抗体(英国Abeam公司,批号:ab23E6);羊抗兔 IGg 二抗(英国Abeam公司,批号:ab205718);抗心肌肌钙蛋白T抗体(英国Abeam公司,批号:GR274050);Dy Light594标记驴抗鼠Ig G二抗(英国Abeam公司,批号:GR287651);Triton-100(美国 Sigma公司,批号:201601);DAPI(霍夫曼·罗氏公司,批号:11L19B76);封闭液驴血清(北京索莱宝科技有限公司,批号:201607);LSM 710共聚焦显微镜((LEICA公司,德国);逆转录仪(Bio-RAD);定量PCR仪(ABI 7500)。
1.3方法
1.3.1心肌细胞培养 参照文献[6]的方法。 乳鼠无菌开胸,迅速取出心脏,置于盛有4 ℃ 的D-hanks 溶液培养皿中,清除残留血液,减去心脏的1/3~1/2,留心尖部心室组织后,分别沿横、纵两个方向剪开,使心尖部相连,呈花瓣状。加入 0.1%胰蛋白酶溶液,置于摇床上,4 ℃震荡过夜。第2天加入与胰蛋白酶等量的培养液,置37 ℃水浴箱震荡10 min后终止消化。加入0.08 %Ⅱ型胶原酶置37 ℃水浴箱震荡消化4或5次,每次10 min。消化完毕后,细胞用孔径0.075 mm(200目)的尼龙筛网除去残留的组织块,用达尔伯克改良伊格尔培养基(DMEM)制成单细胞悬液,吹打均匀,接种于100 mm培养皿中,置于 5%二氧化碳(CO2),37 ℃ 培养箱中静置90 min 差数贴壁后,取上清液,并加入 0.1 mmol·L-1Brdu抑制非心肌细胞增殖,细胞分别以1.5×106·L-1接种于60 mm培养皿、3×105·L-1接种于96孔板和1×106·L-1接种于6孔板中,用含10 %小牛血清的 DMEM 培养液培养 48 h后,换无血清培养液。显微镜下可见细胞单层同步搏动,频率70~90 次·min-1,此心肌细胞用于以下实验。
1.3.2实验分组 ① 正常对照组;②模型对照组(给予NE造模);③哌唑嗪组(NE造模后给予哌唑嗪50 μmol·L-1) ;④DHBF低浓度组 (NE造模后给予DHBF 10 μmol·L-1) ;⑤DHBF中浓度组 (NE造模后给予DHBF 25 μmol·L-1);⑥DHBF高浓度组 (NE造模后给予DHBF 50 μmol·L-1)。
1.3.3细胞肥大模型的建立及给药 将“1.3.1”项心肌细胞用NE(2 μmol·L-1)作用 48 h,即可诱导心肌细胞肥大[7]。用不同浓度DEBF(10,25,50 μmol·L-1)和哌唑嗪(50 μmol·L-1)作用细胞30 min后,加入NE(2 μmol·L-1),作用 48 h 后进行各项指标的测定。将未给予任何处理的细胞作为正常对照组。
1.3.4细胞生存率检测 细胞生存率用 CCK-8 法进行测定。将接种在96 孔板的各组原代心肌细胞进行处理,对照组加入0.5% DMSO作为溶媒对照,其他各组用磷酸盐缓冲液(PBS)洗3次,加入CCK-8检测液10 μL孵育 2 h,于波长430 nm处检测吸光度值(A值)。检测过程中设立不加细胞的调零孔。实验每组设复孔5个,重复3次,取平均值。细胞存活率(%)=(待测组A430 nm值-调零组A430 nm值)/(细胞对照组A430 nm值-调零组A430 nm值)×100%。
1.3.5RT-PCR法检测心肌细胞中c-jun和BNP的mRNA表达水平 将接种在60 mm培养皿中的各组原代心肌细胞中加入 TRIzol试剂1 mL裂解细胞,收集细胞裂解液,三氯甲烷抽提,异丙醇沉淀,用 DEPC处理水回收总RNA,紫外分光光度计A260/A280鉴定其浓度及纯度,并反转录成cDNA。反应条件:95 ℃ 30 s,95 ℃ 5 s,62 ℃ 20 s,40 个循环。取cDNA 1 μg进行 RT-PCR 检测c-jun原癌基因和脑钠肽(brain natriuretic peptide,BNP)的表达,将甘油醛-3-磷酸脱氢酶(glyceraldehyde -3- phosphate dehydrogenase,GAPDH)作为内参因子,以2-ΔΔct法计算目标基因的相对表达水平。 PCR 引物由上海生工有限责任公司提供,序列见表 1。

表1 PCR引物序列
1.3.6Western blotting蛋白检测心肌细胞Ca N、NFAT蛋白表达水平 蛋白裂解液提取各组细胞总蛋白并定量,凝胶电泳后电转移至聚偏氟乙烯(polyvinylidene fluoride,PVDF) 膜上,5%脱脂奶粉封闭1 h。加入一抗CaN、NFAT-3,GAPDH(内参),抗体稀释均为1:1000,4 ℃孵育过夜,洗膜后加入二抗(HRP 羊抗兔IgG 1:2000),摇床室温孵育1 h,洗膜后用电化学发光(electrochemiluminescence,ECL) 液进行曝光显影,Bio-Rad成像分析系统进行图像采集及分析,以目的蛋白与内参蛋白GAPDH灰度值的比值代表目的蛋白相对表达水平。
1.3.7激光共聚焦进行心肌细胞的鉴定及心肌细胞表面积的检测 取出接种在6孔板用药处理过各组心肌细胞,弃培养基,用 PBS 清洗细胞3 次,用4%多聚甲醛固定15 min,再用0.25%Triton X-100透化10 min,驴血清室温封闭30 min,加入抗心肌肌钙蛋白T抗体室温孵育1 h。加入荧光二抗,避光室温孵育1 h。避光加入1 g·mL-1的DAPI 3 min。心肌细胞图像通过 LSM 710 的激光共聚焦仪获取。每次独立实验中,每组各取 3 孔细胞进行处理,重复实验3 次。每孔细胞样品随机获取 5 个不同视野的图片,每个图片取10个细胞,并通过 Image-Pro Plus 6.0 软件测量 3 次实验的细胞表面积,以细胞对照组均值为标准,其余组表面积与细胞对照组相除,得出心肌细胞相对平均表面积。

2 结果
2.1DHBF对细胞生存率的影响 CCK-8检测各组细胞生存率见表2。与正常对照组比较,模型对照组细胞生存率明显下降(P<0.05);与模型对照组比较,使用 DHBF 处理的细胞生存率明显升高,其中DHBF中、高浓度组细胞活性最为显著(P<0.05)。结果表明DHBF可使 NE 诱导的心肌细胞的生存率提高。
表2 6组肥大心肌细胞生存率检测值
Tab.2 Survival rate of six groups of hypertrophy cardiomyocytes
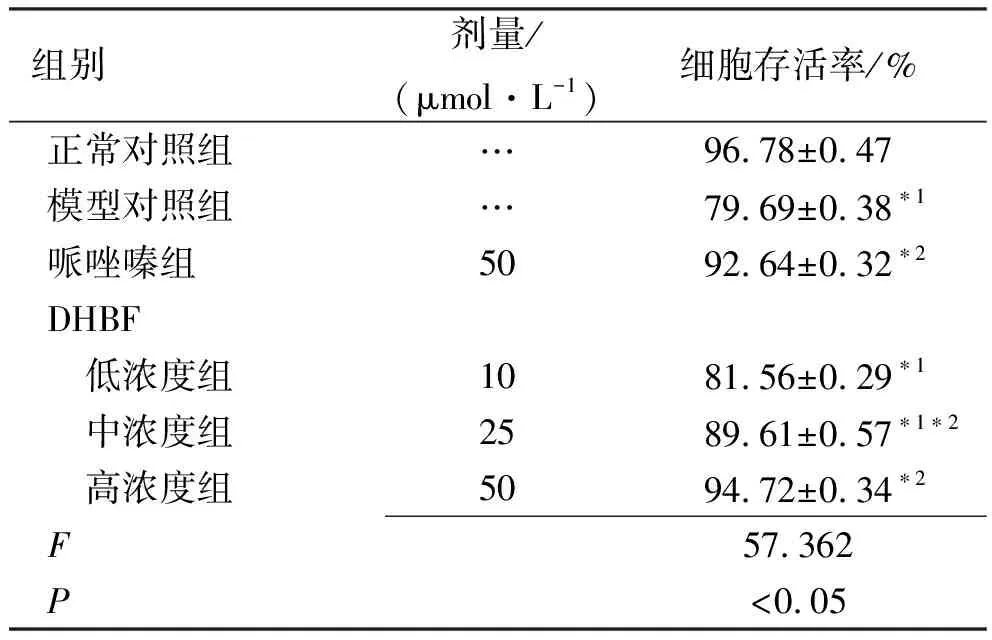
表2 6组肥大心肌细胞生存率检测值
组别剂量/(μmol·L-1)细胞存活率/%正常对照组…96.78±0.47模型对照组…79.69±0.38∗1哌唑嗪组5092.64±0.32∗2DHBF 低浓度组1081.56±0.29∗1 中浓度组2589.61±0.57∗1∗2 高浓度组5094.72±0.34∗2F57.362P<0.05
与正常对照组比较,*1P<0.05 ;与模型对照组比较,*2P<0.05
Compared with normal control group,*1P<0.05; compared with model control group,*2P<0.05
2.2DHBF对NE诱导的心肌细胞c-jun和BNP的mRNA表达的影响 RT-PCR 检测分析结果见表3。与正常对照组比较,模型对照组心肌肥大标志物c-jun和 BNP mRNA表达均上调,分别增加2.14和2.57倍(n=6,P<0.05);与模型对照组比较,DHBF低、中、高浓度组心肌肥大标志物 c-jun和 BNP mRNA表达均明显下调(P<0.05)。结果表明DHBF可阻断由NE诱导的心肌细胞c-jun和 BNP mRNA的表达增高。
2.3DHBF对NE诱导的肥大心肌细胞内CaN、NFAT-3蛋白表达水平的影响 Western blotting 蛋白检测结果见图1,表4。与正常对照组比较,模型对照组 CaN、NFAT-3蛋白表达均升高(P<0.05);与模型对照组比较,DHBF低、中、高浓度组CaN、NFAT-3蛋白表达明显下降(P<0.05),结果表明DHBF可抑制由NE诱导的心肌细胞CaN、NFAT-3的蛋白表达。
2.4DHBF对NE诱导的肥大心肌细胞表面积的影响 各组心肌细胞横截面积见图2,表5。与正常对照组比较,模型对照组心肌细胞表面积明显增大(P<0.05);与 模型对照组比较,哌唑嗪组及DHBF低、中、高浓度组心肌细胞表面积明显缩小(均P<0.05)。结果表明DHBF可减小由 NE 诱导的心肌细胞表面积的增加。
表3 6组肥大心肌细胞c-jun和BNP的mRNA表达
Tab.3 The mRNA expression of of c-jun and BNP in six groups of hypertrophy cardiomyocytes

表3 6组肥大心肌细胞c-jun和BNP的mRNA表达
组别c-junBNP正常对照组1.00±0.011.00±0.01模型对照组3.14±0.32∗13.57±0.62∗1哌唑嗪组1.73±0.44∗21.75±0.41∗2DHBF 低浓度组2.53±0.28∗12.61±0.53∗1 中浓度组1.60±0.26∗1∗21.81±0.33∗1∗2 高浓度组1.11±0.2∗21.07±0.38∗2F11.81910.988P<0.05<0.05
与正常对照组比较,*1P<0.05 ;与模型对照组比较,*2P<0.05
Compared with normal control group,*1P<0.05; compared with model control group,*2P<0.05
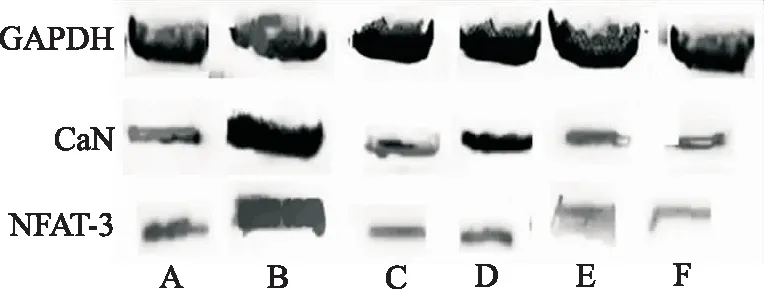
A.正常对照组;B.模型对照组;C.哌唑嗪组;D.DHBF低浓度组;E.DHBF中浓度组;F.DHBF高浓度组
图16组肥大心肌细胞CaN、NFAT-3蛋白表达
A.normal control group;B.model control group;C.prazosin group;D.low-dose DHBF group;E.medium-dose DHBF group;F.high-doseDHBF group
Fig.1ProteinexpressionofCaNandNFAT-3insixgroupsofhypertrophycardiomyocytes
3 讨论
在发达国家,1%~2%成人患心力衰竭,而在 70 岁以上人群,该比例高达10%[8]。BROUWERS等[9]报道,心力衰竭发生后,男性和女性患者5年生存率分别为25%和38%。近年来,经过包括利尿药、血管紧张素转换酶抑制药、β 受体阻断药、醛甾酮受体阻滞药等药物优化治疗和心脏再同步化治疗等综合治疗后,心力衰竭患者预后较前改善,住院率下降,但仍不容乐观。目前认为,心脏重构是心力衰竭发生发展的基本机制,因而对心脏重构学说的研究不断深入。心脏肥厚是心脏重构的重要环节,其诱发因素有高血压、心肌梗死、瓣膜病等,在细胞形态学方面主要表现为心肌细胞体积增大,蛋白合成增加,并伴有心肌细胞凋亡、心肌纤维化等;心肌肥厚最初是心脏对高负荷的适应性反应,但是持续的心肌肥厚将会导致心律失常、心力衰竭和心脏骤停[10]。因此,阻断心肌肥大是干预心力衰竭的重要策略。
表4 6组肥大心肌细胞内CaN、NFAT-3蛋白表达
Tab.4 Protein expression of CaN and NFAT-3 in six groups of hypertrophy cardiomyocytes
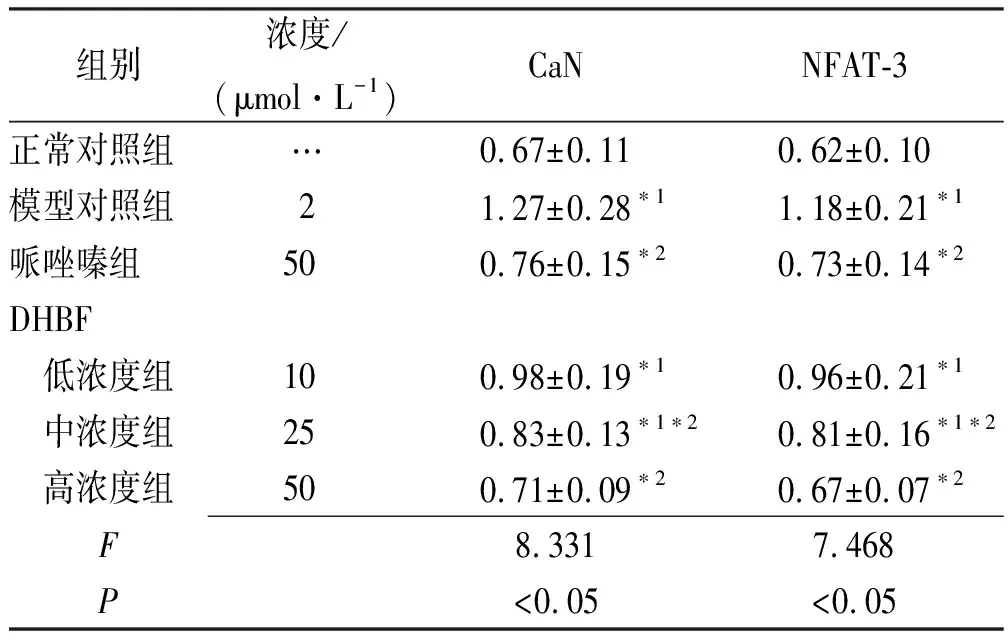
表4 6组肥大心肌细胞内CaN、NFAT-3蛋白表达
组别浓度/(μmol·L-1)CaNNFAT-3正常对照组…0.67±0.110.62±0.10模型对照组21.27±0.28∗11.18±0.21∗1哌唑嗪组500.76±0.15∗20.73±0.14∗2DHBF 低浓度组100.98±0.19∗10.96±0.21∗1 中浓度组250.83±0.13∗1∗20.81±0.16∗1∗2 高浓度组500.71±0.09∗20.67±0.07∗2F8.3317.468P<0.05<0.05
与正常对照组比较,*1P<0.05 ;与模型对照组比较,*2P<0.05
Compared with normal control group,*1P<0.05; compared with model control group,*2P<0.05
心肌肥大是一种由多种因素参与调节的复杂动态过程,现已证实磷脂酰肌醇3激酶/蛋白激酶通路、钙调神经磷酸酶通路、MAPK 通路[11]、NO/cGMP 通路等多条信号通路均参与其病理过程[12]。其中,NE是体内一种重要的神经递质和内分泌激素,可促进心肌细胞肥大,在心肌肥厚、心力衰竭等病理过程中起重要作用,而这些病理过程往往伴有心肌细胞的异常生长、凋亡及氧化应激的增加[13]。近来许多研究表明,氧化应激产生的活性氧 (ROS),在亚毒剂量时可充当第二信使分子,可以调节转录因子活化、细胞凋亡、细胞生长等生理过程。同时ROS通过调节信号转导过程中的多个环节,完成功能性应答:ROS对于 Ca2+信号转导、蛋白激酶与蛋白激酶的磷酸化及转录因子均有一定的作用。有研究发现NE可作为一种内在的氧化剂,促使氧化应激的发生,在高血压、糖尿病等疾病的心脏损害中发挥重要作用。这些均为研究 DHBF对NE诱导心肌肥厚的抑制作用提供了可能的探讨方向。
c-jun和 BNP 是心肌合成和分泌的多肽,属于胚胎基因,主要在心脏发育期表达,在出生之后通常低表达或者不表达。心肌肥厚时,c-jun和BNP mRNA 的表达代偿性增加,因此可以作为心肌细胞肥大的重要标志物[14]。肥大的心肌细胞客观上表现为心肌细胞体积明显增加,显微镜下可观察到细胞表面积增加;心肌细胞胚胎基因重新表达,c-jun和 BNP mRNA上调是心肌细胞肥大的标志。本课题前期研究发现,DHBF可降低肾血管性高血压大鼠血压,可改善左室收缩舒张功能和心肌收缩力,其机制可能与降低血循环、心肌组织、肾组织中内皮素 (endothelin,ET)水平,升高一氧化氮(NO)水平,调整体内ET与NO平衡状态有关[5]。本研究发现与对照组比较,模型对照组c-jun和BNP的mRNA水平显著升高,证明肥大心肌细胞模型构建成功,DHBF明显降低心肌细胞肥大标志物c-jun和BNP的mRNA表达水平,并呈剂量依赖性,提示DHBF对NE诱导的心肌肥大有一定抑制作用。
心肌肥厚的发生是多因素、多靶点、多条细胞内信号转导通路共同促进、共同参与所致的病理生理过程。细胞内Ca2+浓度浓度升高是内外界刺激诱导心肌肥厚发生发展中的中心环节[15]。当细胞内Ca2+浓度持续增加,可活化很多肥厚相关基因的表达,CaN/NFAT 是钙离子介导的一条主要信号传导通路,在心肌肥厚的发生发展过程中起着至关重要的作用[16]。各种刺激均能导致细胞内Ca2+浓度升高,游离的 Ca2+与钙调素结合,共同参与钙调神经磷酸酶的激活,而活化的 CaN 又会进一步磷酸化细胞质中的活化 T 细胞核因子(NFAT),磷酸化的 NFAT 可以透过细胞核膜,与细胞核内的锌指转录因子(GATA4)结合,共同促使心肌肥厚相关基因ANP、BNP等胎儿型基因的表达,进而使心肌蛋白合成增加、心肌细胞横截面积增大、成纤维细胞增生,最终导致心肌肥厚的发生[17]。本研究发现与NE诱导的心肌肥大模型组比较,DHBF 可明显降低心肌细胞的 CaN、NFAT 的蛋白表达水平,提示DHBF对NE诱导的心肌肥大的抑制作用可能与Ca2+介导的CaN-NFAT信号传导通路有关。
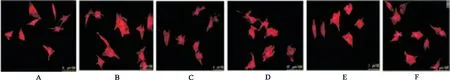
A.正常对照组;B.模型对照组;C.哌唑嗪组;D.DHBF低浓度组;E.DHBF中浓度组;F.DHBF高浓度组
A.normal control group;B.model control group;C.prazosin group;D.low-dose of DHBF group;E.medium-dose of DHBF group;F.high-dose of DHBF group
Fig.2Microscopyofmyocardialcellsinsixgroupsofhypertrophycardiomyocytes(×200)

表5 6组肥大心肌细胞表面积
与正常对照组比较,*1P<0.05 ;与模型对照组比较,*2P<0.05
Compared with normal control group,*1P<0.05; compared with model control group,*2P<0.05
在本研究中,笔者选用NE诱导原代心肌细胞肥大,排除血流动力学负荷和其他神经体液刺激等影响因素,是常用的评价心肌肥大的体外实验模型,同时用NE 诱导原代培养的心肌细胞肥大,建立心肌肥大模型,并进一步观察到DHBF能明显增加由 NE 诱导的肥大心肌细胞的存活率、抑制心肌肥大标志物c-jun和BNP的mRNA表达和CaN、NFAT的蛋白表达,以及减小肥大心肌细胞表面积,提示DHBF对肥大心肌细胞有明显的抑制和保护作用。其次,本研究中采用临床常用治疗心肌肥厚药物哌唑嗪和DHBF进行干预,发现所选3个浓度的 DHBF 对心肌细胞肥大的抑制作用呈现浓度依赖性,以50 μmol·L-1DHBF抑制作用最强。哌唑嗪是临床上用于治疗心肌肥厚的常用药物,在本研究中发现高浓度DHBF在抑制心肌肥厚的作用方面优于哌唑嗪,说明DHBF具有开发价值。因本研究采用的心肌细胞部分为原代培养的乳鼠心肌细胞,而与乳鼠心肌细胞相比,成年鼠心肌细胞更接近疾病发生的内环境。所以本研究仅在在细胞层面验证DHBF下调由NE诱导的心肌细胞肥厚,如果能在成年鼠心肌细胞上进行研究,实验设计将会更加严谨。
综上所述,DHBF能够抑制去甲肾上腺素诱导的心肌细胞肥大,对心肌细胞有一定的保护作用,这可能与其抑制Ca2+介导的CaN-NFAT信号传导通路有关,此作用为其有可能成为临床防治心力衰竭的潜在药物提供了依据。
