环境因子及次生壁合成基因对木质部生成影响的研究进展
2019-02-13陈沫何沙娥陈少雄欧阳林男刘学锋张程张维耀
陈沫,何沙娥,陈少雄,欧阳林男,刘学锋,张程,张维耀
环境因子及次生壁合成基因对木质部生成影响的研究进展
陈沫,何沙娥,陈少雄*,欧阳林男,刘学锋,张程,张维耀
(国家林业和草原局桉树研究开发中心,广东湛江 524022)
木本植物次生木质部生成是木材质量和产量形成的基础,次生木质部生成受外部环境因子和自身遗传调控双重因素的影响。本文以杨树等主要树种为例,概述了木本植物次生木质部的形态结构、形成过程,重点阐述了外部环境因子对木质部生成的影响以及次生壁主要成分纤维素、半纤维素、木质素合成基因的研究进展,以期为木本植物木材产量和质量形成研究提供借鉴和依据。
环境因子;次生木质部;木材形成;次生壁
次生木质部是木材的主要组成成分,由维管形成层向内分化产生。次生木质部细胞的形成和增加是树木主干不断增粗的主要原因,对维持树木多年生长和木材产量形成具有重要意义。由维管形成层生成成熟的次生木质部是一个复杂的生物学过程,包括次生木质部母细胞产生、木质部细胞伸展生长、次生壁合成和细胞程序化死亡等几个阶段[1]。这几个阶段受外界环境因子直接或间接的影响以及树木自身遗传因子的调控[2],进而影响木质部细胞数量或形态结构,最终决定木材产量和质量形成。因此,从20世纪至今,次生木质部生成调控的研究一直是国内外植物生理学家和遗传育种工作者研究的热点。在环境因子方面,国内外研究多集中在气候因子,包括温度、光照强度、降水、co2浓度和光周期等;土壤的营养状况包括磷肥、钙肥、钾肥和盐胁迫等。在遗传因子方面,主要解析调控木质部生成各阶段发生的基因及其调控机制,其中木质部细胞次生壁合成研究甚多。本文以杨树()等为例,概述了木本植物次生木质部形态结构、形成过程、环境因子对木质部生成的影响和次生壁主要成分合成基因的研究进展,以期为木本植物木材产量和质量形成研究提供借鉴和依据。
1 次生木质部的结构
木材(次生木质部)是林木主干的主体部分,起支撑和输送营养物质的作用。以桉树()为例,阔叶树种次生木质部的轴向系统由导管(V)、薄壁细胞和木纤维(f)等管状分子构成,径向系统由射线薄壁细胞组成(rp)(图1)。由于导管分子扩张和纤维侵入,阔叶树种的木质部细胞在外观上大多排列散乱,呈随机分布。
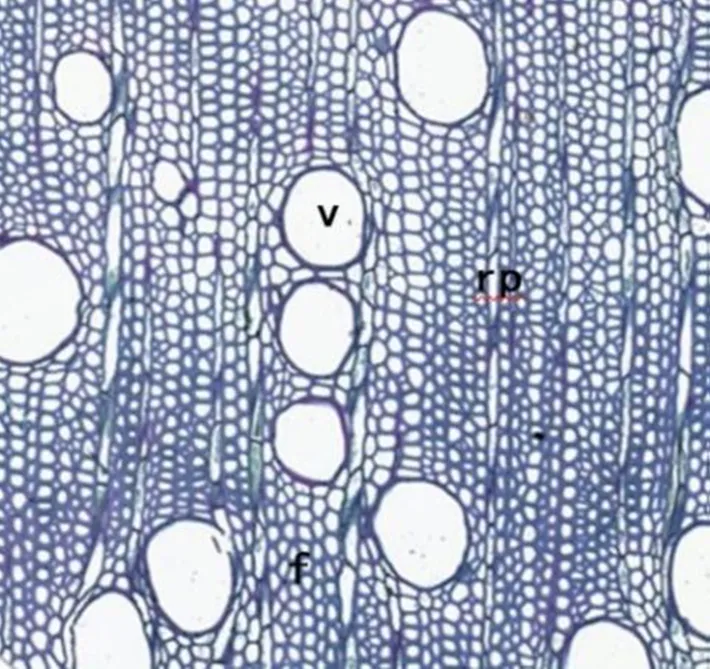
图1 桉树的木质部解剖结构
注:V-导管;rp-射线薄壁细胞;f-纤维
大部分成熟的木质部细胞壁可分为两层:薄的初生壁和相对较厚的次生壁。其中次生壁又分为外、中、内三层(S1、S2和S3),中层最厚(图2)[1]。次生壁主要由纤维素、半纤维素、木质素等物质在细胞生长停止以后不断积累而成。次生壁有一定的厚度且质地坚硬,在木本植物的木质部中大量存在,是决定木材产量和质量决定的重要因素。
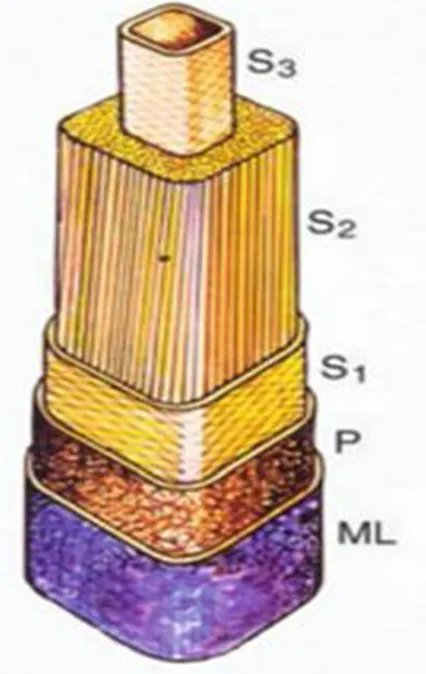
图2 木质部细胞壁结构图[3]
注:S1-外层;S2-内层;S3-中层;P-初生壁;ML-胞间层
2 次生木质部的形成过程
次生木质部细胞由维管形成层活动产生。维管形成层细胞通过平周分裂向外产生次生韧皮部,向内产生次生木质部[4]。同时,通过垂周分裂逐年扩大自身的周径,随树木直径的增粗逐渐向外推移,维持自身的生存[5]。从形成层细胞分化到木质部细胞成熟需经历木质部细胞产生、木质部细胞伸展生长、次生壁加厚和细胞程序化死亡等几个主要阶段[1]。
由维管形成层新产生的木质部细胞起初仅具一层很薄的初生壁。木质部细胞伸展生长阶段,初生壁在酶的作用下,细胞壁松弛、扩张,细胞纵向和横向直径增加,直至达到最终的形态。随后次生壁物质开始合成,沉积在初生壁内部,细胞形态也随即被固化[6]。次生壁合成过程中纤维素微纤丝以一定的模式连续沉积,使得次生壁呈片层状,构成细胞骨架。木质素和其他物质则以内填的方式沉积在纤维素骨架中,这个过程称之为木质化[7]。木质化完成以后,木质部细胞进入细胞程序化凋亡过程。在一些水解酶的作用下,木质部细胞原生质体降解消失,最终形成疏水性的导管元件[1]。
3 环境因子对次生木质部形成的影响
次生木质部的形成受多种环境因素的影响,包括温度、水分、营养、光照等,以及这些因素之间的相互作用。此外,一些培育技术例如灌溉、施肥、林分密度控制,都可以通过改变林分的温度、水分、营养和光照等状况,进而改变木质部细胞的数量或形态结构,间接影响次生木质部的生成。
温度是影响木质部细胞数量的重要环境因子。WAISEL[8]等在不同气候条件下用14CO2短期处理2 a生赤桉()幼苗时发现,相对于低温处理(16 ~ 18℃),高温(28℃)处理下木质部细胞新生成的层数较多。对杜仲()和毛白杨()等的研究表明,在冬季低温条件下,形成层区活跃程度降低,树木生长呈休眠状态;而在温暖的季节,形成层活跃程度增加,衍生出更多的木质部细胞[9-11]。这说明低温不利于木质部细胞生长。温度除了可以影响木质部细胞数量,还能够影响木质部细胞的形态结构。例如,THOMAS等[12]研究发现,桉树在较高温度下形成的木质部导管管腔面积会明显减小。
水分是次生木质部形成的重要决定因素。热带硬木树种柚木()的木质部细胞数量全年都在增加,但遇到短期的干旱季节木质部细胞将停止增加[13]。另外,在持续干旱的情况下,短期的雨季会诱导阔叶树种非洲李()次生木质部细胞的增加[14]。RAHMAN等[15]在降水模式对尾叶桉()形成层活动的研究中也得到相似的结论,低降水量或无降水可导致树木形成层活动和木质部形成的时间周期性停止,相反,在持续降水的情况下,同一棵树的形成层活动可能持续全年。由此可见,水分供给对木质部生成至关重要。
养分条件对木质部细胞数量和形态结构产生影响,是木材产量增加的主要手段。在杨树中研究发现缺少磷、钾和钙肥均会导致次生木质部细胞增量的减少和导管尺寸的减小,增施这三种肥则可促进次生木质部细胞的增多以及导管细胞的扩张[16-18]。此外,研究发现杨树中,春季和夏季树木快速增粗时期形成层中K+含量远远高于秋季和冬季[19],说明K+含量在木本植物径向生长中起重要作用。
在生产中,密度调控等培育技术可对木质部生成产生显著影响。大量研究数据显示,林分密度与茎粗呈显著负相关关系,密度越大,植株的径向增长量越小[20-23]。众所周知,次生木质部的生长量是光合产物在茎中分配的结果。密度控制改变了树木生长的光照、养分和水分供给等外部环境状况,影响了植株的光合效率,进而影响木质部细胞生成。
4 次生壁成分合成相关基因研究进展
如前所述,由形成层细胞分化到木质部成熟经历几个程序化过程。研究表明,植物体自身的遗传机制严格地调控着这些程序化过程[24],是影响次生木质部形成的内在因素。纤维素、半纤维素和木质素是次生壁的主要构成,现就这3种物质合成基因的研究进展进行综述。
4.1 纤维素合成相关基因
纤维素是高等植物中次生细胞壁的主要构成成分,约占其总量的二分之一。纤维素合酶(Cellulose Synthase/CESA),在纤维素合成途径中发挥主要调节作用,是控制木材纤维产量和品质的重要因素[25]。CESA由纤维素合酶超级基因家族成员编码。CESA基因家族是一个超基因家族,包含多个成员。
在草本植物拟南芥()中发现10个CESA基因,其中,、和是负责拟南芥次生壁合成的必需基因[26]。毛果杨()基因组中鉴定出17个基因[27],其中5个成员在杨树成熟茎中具有较高表达水平,在次生维管组织发育的后期表达水平更高[28],进一步实验证明过表达任意一个成员均能够共抑制次生木质部相关的CESA活性并且显著降低纤维素含量[29],表明它们主要负责木质部细胞次生壁纤维素的合成。ZHOU等[30]认为基因的开启和关闭是响应压力的一个信号,对木材中木质素和纤维素的积累具有重要作用。在裸子植物辐射松()中,纤维素合成酶基因和在密度较大的木材中表达量显著高于低密度木材[31],表明这些基因参与次生壁的合成,并且影响了木材性质。此外,RANIK等在巨桉()中克隆了6个基因,其中,参与次生细胞壁合成的基因有3个,分别是,和,其中尤以的在木质部和未成熟的木质部中表达量最高[32]。BALACHANDRAN等[33]在细叶桉()中的研究也得到了相同的结论。
蔗糖合成酶(SuSy)被认为负责糖纤维素前体物质尿苷二磷酸-葡萄糖(UDP-glucose)的合成,为纤维素合成提供原料[34],但也有研究认为其可能是纤维素合成酶复合体的一个成分[35]。杨树中过表达棉花的蔗糖合成酶能够略微提高纤维素的含量和纤维素的结晶性,表明蔗糖合成酶与纤维素合成有一定的关系[36],但是在杨树中下调蔗糖合成酶活性的结果并不支持蔗糖合成酶直接参与纤维素合成,因此认为蔗糖合成主要功能是为木材多聚物的合成提供碳源[37]。
4.2 半纤维素合成相关基因
在次生壁中,半纤维含量约占1/4,主要作用是通过与其他次生壁成分的结合保持细胞壁的完整性和稳定性。糖基转移酶(glycosyltransferases, GTs)蛋白家族参与半纤维素主要成分木聚糖(xylan)的合成。对拟南芥合成木聚糖有缺陷的突变体分析表明,GT43、GT8和GT47等家族的糖基转移酶参与半纤维素的合成[38]。
GT43家族的共有4个成员,包括、、I和,其中、和主要参与木聚糖中(glucuronoxylan, GX)主链的延伸[39]。有研究表明,该家族基因突变将导致拟南芥次生壁变薄,木质部细胞发育不正常[39-41]。ZHOU等[42]在白杨中发现了的同源基因,发现其功能相似,均参与了木聚糖中葡糖醛酸木聚糖的合成。此外,糖基转移酶PtrGT43A、PtrGT43B和PtrGT43E均是的同源蛋白,PtrGT43C和PtrGT43D均是的同源蛋白,它们是木聚糖骨架合成的关键成员[43-44]。
GT47家族中参与半纤维素中木聚糖还原末端结构合成的基因有()、和[45-46]。基因突变将导致植物次生细胞壁不能正常加厚,在杨树中沉默表达会导致同样的结果[45,47]。在次生壁细胞中特异性表达,和()在拟南芥次生壁合成中具有相同的功能[48]。此外,GT47家族中和参与了葡糖醛酸木聚糖主链的延伸,在次生细胞壁正常的物质合成中发挥重要作用[49],与相比,在木聚糖主链的延伸过程中发挥的作用更大[50]。
目前,GT8家族中木聚糖合成的基因,拟南芥中有5个(、、、和),杨树中有5个(、、、和)。其中,和同样参与木聚糖还原性末端序列的合成,其突变体木质部次生壁强度均明显下降46,51]。拟南芥中,和行使合成木聚糖的侧链功能[38]。和是和的同源基因,所编码的非糖基转移酶也参与木聚糖合成[52-53-]。
葡甘露聚糖(glucomannan)是半纤维素的另一主要组成,其合成由类纤维素合成酶CslA(Cellulose synthase-like A)糖基转移酶家族催化,该酶的功能在维管植物中非常保守[54]。杨树CslA基因在发育的木质部中高水平表达,其重组蛋白具有葡甘聚糖合成酶活性,表明其参与次生木质部发育过程中的葡甘聚糖合成[55]。与此类似,松树中的几个CslAs重组蛋白也表现出glucomannan合成酶活性[54]。
4.3 木质素合成相关基因
木质素由香豆醇、松柏醇和芥子醇的衍生物对苯基单体(H型)、愈创木基单体(G型)和紫丁香基单体(S型)三类聚合而成,可通过与纤维素和半纤维素交联使细胞壁组分之间连成整体,增强细胞壁的机械强度及疏水性能。S型木质素和G型木质素广布于被子植物次生木质部细胞,G型木质素广布于裸子植物中。木质素合成包括苯丙烷合成(莽草酸途径)、木质素单体合成(苯丙烷代谢途径)和单体聚合3个生物学过程[56-57]。目前,关于木质素单体合成(苯丙烷代谢途径)和单体聚合两个过程研究较多。
参与S型木质素单体合成的酶有:苯丙氨酸氨解氨酶(PAL);肉桂酸-4-氢化酶(C4H);对香豆酰辅酶-A3-羟化酶(C3H);羟基肉桂酰辅酶A-莽草酸/奎尼酸羟基肉桂酰转化酶(HCT);咖啡酸邻位甲基转化酶(comt);咖啡酰辅酶A-邻-甲基转移酶(CCoAOMT);阿魏酸五羟化酶(f5H);4-香豆酸:辅酶A连接酶(4cl);肉桂酰辅酶A还原酶(CCR);肉桂醇脱氢酶(CAD)。以上酶除F5H、COMT外,共8种酶参与G型木质素单体的合成。已有研究表明下调合成这些关键酶的基因能够降低木质素含量。例如,杨树中基因表达的表达受到抑制,会导致次生壁中木质素含量下降[58-59]。此外,同样是下调基因,杨树中木质素含量下降一半左右[60],而挪威云杉中()中木质素含量仅下降8%[61],其原因可能是裸子植物和被子植物木质素单体不同,也能是两者基因活性下调的量不同。但也有研究表明下调这些关键酶的基因会导致木质素含量下降剧烈甚至影响植物的正常生长,如在杂交杨中下调,发现植株的木质素含量下降剧烈以至于影响植物的正常生长,这可能与维管疏导组织受到破坏有关[62]。另外,因为G型木质素更难从细胞壁中去除,因此,有学者为得到更有利于生产的植物原料,通过基因工程手段来增大S/G的比例。LI等[63]在山杨中同时上调和下调,S型和G型两类木质素的比例成倍增加,木质素含量下降一半左右,同时伴有纤维素的少量增加。
过氧化物酶和漆酶(POD和LAC)被认为是参与木质素单体聚合的酶。这两种酶具有较低的底物特异性,受众多同源基因的共同编码[64-65]。过氧化物酶分为阴离子过氧化物酶和阳离子过氧化物酶。转基因烟草中缺乏阴离子过氧化物酶,木质素含量无变化[66];但在杨树中,缺乏阳离子POD造成木质素下降44%[67],造成这两种结果的原因可能是阴、阳离子过氧化物酶在细胞壁上定位和木质组织中的表达不同。此外,在毛果杨()中,过表达后抑制单体聚合酶漆酶的活性,会导致木质素的含量下降[68]。
5 展望
次生木质部的生长发育是一个极其复杂的过程,每个阶段都受内外众多因素的影响。次生木质部存在树种特异性,因此,不同树种会对外部环境因子的变化作出不同的响应,这也是当前研究的热点。而这些研究最终都会归结到基因层次,近年来人们对此研究已经取得了较大的进展,但对于众多基因参与调控的复杂过程来说只是“冰山一角”。温度、水分、施肥和光照等这些环境因子是如何影响木质部细胞的数量和结构,树木自身的遗传基因又是如何调控次生壁中各成分的含量和比例,这些调控机理的研究目前还不太清晰,是木材形成研究亟需解决的重要问题之一。
[1] PLOMION C, LEPROVOST G, STOKES A. Wood formation in trees[J]. Plant Physiology, 2001, 127(4): 1513-1523.
[2] Denne M P, Dodd R S. The environmental control of xylem differentiation[M]∥Barnett J R .Xylem cell development[M]. UK: Castle House, 1981.
[3] Gardiner B, Barnett J, Saranpää P, et al.The biology of reaction[M].Springer Heidelberg New York Dordrecht London: European cooperation in science and technology, 2014.
[4] 郑相如,汪矛.形成层的结构与活动[J].生物学通报,1997(4):10-12.
[5] BRUCE J Z, Jett B J. Genetics of wood production[M]. Springer-Verlag Berlin Heidelberg, 1995.
[6] Dejardin A, Laurans F, Arnaud D, et al. Wood formation in angiosperms[J]. Comptes Rendus Biologies, 2010, 333(4): 325-334.
[7] NAKANO Y, YAMAGUCHI M, ENDO H, et al. NAC-MYB-based transcriptional regulation of secondary cell wall biosynthesis in land plants[J]. Frontiers in Plant Science, 2015, 6: 1-18.
[8] WAISEL Y, FAHN I N. Cambial activity inDehn II: The production of phloem and xylem elements[J]. New Phytologist, 1966, 65(3): 319-324.
[9] MWANGE K N, HOU H W, WANG Y Q, et al. Opposite patterns in the annual distribution and time course of endogenous abscisic acid and indole-3-acetic acid in relation to the periodicity of cambial activity inOliv[J]. Journal of Experimental Botany, 2005, 56(413): 1017-1028.
[10] Mwange K N K, Wang X W, Cui K M. Mechanism of dormancy in the buds and cambium of[J]. Acta Botanica Sinica, 2003, 45: 698-704.
[11] Yin Y F, Jiang X M, Cui K M. Seasonal changes in the ultrastructure of the vascular cambium in shoots of[J]. Acta Botanica Sinica, 2002, 44: 1268-1277.
[12] Thomas D S, Montagu K D, Conroy J P. Temperature effects on wood anatomy, wood density, photosynthesis and biomass partitioning ofseedlings[J]. Tree Physiology, 2007, 27: 251-260.
[13] Die A P, Kitin F N, Kouame J, et al. Fluctuations of cambial activity in relation to precipitation result inannual rings and intra-annualgrowth zones of xylem and phloem in teak() in Ivory Coast[J].,2012, 110: 861-873.
[14] Krepkowski J ,Bräuning A, Gebrekirstos a, et al.Cambial growth dynamics and climatic control of different tree life forms in tropical mountain forest in Ethiopia[J]. Trees,2011, 25(1): 59-70.
[15] Rahman M H, Nugroho W D, Nakaba S, et al.Changes in cambial activity are related to precipitation patterns in four tropical hardwood species grown in Indonesia[J]. American Journal of Botany, 2019, 106(6): 1-12.
[16] FROMM J, LAUTNER S.Secondary Xylem Biology:chapter 4:abiotic stresses on secondary xylem formation [M]. Salt Lake ,USA:Academic Press , 2016.
[17] Lautner S, Ehlting B,Windeisen E, et al. Calcium nutrition has a significant influence on wood formation in poplar[J]. New Phytologist, 2007, 174(4): 743-752.
[18] Langer, K, Ache P, Geiger D, et al. Poplar potassium transporters capable of controlling K+homeostasis and K+- dependent xylogenesis[J]. The Plant Journal, 2002, 32: 997-1009.
[19] Wind C, Arend M, Fromm F. Potassium-dependent cambial growth in poplar[J]. Plant Biology. 2004, 6(1): 30–37.
[20] 田新辉,孙荣喜,李军,赵长海,杨敏生.107杨人工林密度对林木生长的影响[J].林业科学,2011,47(3):184-188.
[21] 李洁,列志旸,许松葵,等.不同密度的银合欢林生长分析[J].中南林业科技大学学报,2016,36(6):70-74.
[22] Coetzee J,陈少雄.林分密度对巨桉收获量的影响:好立地和差立地在4年生时的比较[J].桉树科技,1998(1):53-60.
[23] 晏姝,胡德活,韦如萍,等.南洋楹造林密度与施肥均匀设计试验[J].林业科学,2015,51(5):153-158.
[24] Schuetz M, Smith R, Ellis B. Xylem tissue specification, patterning, and differentiation mechanisms[J]. Journal of Experimental Botany, 2013, 64(1): 11-31.
[25] Somerville C. Cellulose synthesis in higher plants[J]. Annual review of cell and developmental biology, 2006, 22: 53-78.
[26] Turner S R, Somerville C R. Collapsed xylem phenotype ofidentifies mutants deficient in cellulose deposition in the secondary cell wall[J]. Plant Cell, 1997, 9(5): 689-701.
[27] Djerbi S, Lindskog M , Arvestad L , et al. The genome sequence of black cottonwood () reveals 18 conserved cellulose synthase () genes[J]. Planta, 2005, 221(5): 739-746.
[28] 魏凯莉,周厚君,江成,等.杨树次生壁纤维素合酶的表达与互作模式分析[J].林业科学研究,2017,30(2):245-253.
[29] Joshi C P, Thammannagowda S, Fujino T, et al. Perturbation of wood cellulose synthesis causes pleiotropic effects in transgenic aspen[J]. Molecular Plant, 2011, 4(2): 331-345.
[30] ZHOU J,WANG X,LEE J Y, et al. Cell-to-cell movement of two interacting AT-hook factors in Arabidopsis root vascular tissue patterning[J].Plant Cell,2013,25(1): 187-201.
[31] LI X, WU H X, Southerton S G. Seasonal reorganization of the xylem transcriptome at different tree ages reveals novel insights into wood formation in[J].New Phytologist,2010,187(3):764-776.
[32] Ranik M, Myburg A A .Six new cellulose synthase genes fromare associated with primary and secondary cell wall biosynthesis[J].Tree Physiology, 2006, 26(5): 545-556.
[33] Balachandran K R S , DASGUPTA M G. Isolation of developing secondary xylem specific cellulose synthase genes and their expression profiles during hormone signalling in[J].Journal of Genetics, 2014, 93(2): 403-414.
[34] Amor Y, Haigler C H, Johnson S, et al. A membrane-associated form of sucrose synthase and its potential role in synthesis of cellulose and callose in plants[J].Proceedings of the National Academy of Sciences, 1995, 92(20): 9353-9357
[35] Fujii S, Hayashi T, Mizuno K. Sucrose synthase is an integral component of the cellulose synthesis machinery[J]. Plant Cell Physiology, 2010, 51(2): 294-301.
[36] Coleman H D, Yan J, Mansfield S D. Sucrose synthase affects carbon partitioning to increase cellulose production and altered cell wall ultrastructure[J]. Proceedings of the National Academy of Sciences, 2009,106(31): 13118-13123.
[37] Gerber L, Zhang B, Roach M, et al. Sucrose synthase is an integral component of the cellulose synthesis machinery[J]. New Phytologist, 2014, 203(4): 1220-1230.
[38] 秦丽霞,张德静,李龙,等.参与植物细胞壁半纤维素木聚糖合成的糖基转移酶[J].植物生理学报, 2011(9): 831-839.
[39] Lee C, Teng Q, Huang W, et al. The Arabidopsis family GT43glycosyltransferases form two functionally nonredundant groups essential for the elongation of glucuronoxylan backbone[J]. Plant Physiology, 2010, 153(2): 526-541.
[40] Brian D K, Allan M S.and, Two glycosyl transferases involved in glucuronoxylan biosynthesis and drought tolerance in Arabidopsis[J]. Molecular Plant, 2010, 3(5): 834-841.
[41] Wu A M, Hörnblad E, Voxeur A, et al. Analysis of the/and/pairs of glycosyltransferase genes reveals critical contributions to biosynthesis of the hemicellulose glucuronoxylan[J]. Plant Physiology, 2010,153: 542-554.
[42] Zhou G K, Zhong R Q, Richardson E A, et al. Molecular characterization of PoGT8D and PoGT43B, two secondary wall-associated glycosyltransferases in poplar[J]. Plant Cell Physiology, 2007,48: 689-699.
[43] Lee C, Teng Q, Zhong R, et al. Molecular dissection of xylan biosynthesis during wood formation in Poplar [J]. Molecular Plant, 2011, 4(4): 730-747.
[44] Lee C, Zhong R, Ye Z H. Biochemical characterization of xylan xylosyltransferases involved in wood formation in Poplar [J]. Plant Signaling & Behavior,2012,7(3): 332-337.
[45] Zhong R, Pena M J, Zhou G K, et al. Arabidopsis fragile fiber8, which encodes a putative glucuronyltransferase, is essential for normal secondary wall synthesis[J]. Plant Cell, 2005, 17(12): 3390-3408.
[46] Pena M J, Zhong R, Zhou G K, et al. Arabidopsis irregularand irregular: implications for the complexity of glucuronoxylan biosynthesis [J]. Plant Cell, 2007, 19(2): 549-563.
[47] Lee C, Teng Q, Huang W, et al. Down-regulation ofexpression in poplar results in a reduced glucuronoxylan content and an increased wood digestibility by cellulase[J].Plant Cell Physiology,2009, 50: 1075-1089.
[48] Lee C, Teng Q, Huang W, et al. The F8H glycosyltransferase is a functional paralog of FRA8 involved in glucuronoxylan biosynthesis in[J]. Plant Cell Physiology, 2008, 50: 812-827.
[49] Brown D M, Zhang Z, Stephens E, et al. Characterization of IRX10 and IRX10-like reveals an essential role in glucuronoxylan biosynthesis in Arabidopsis [J]. The Plant Journal, 2009, 57(4): 732-746.
[50] Wu A M, Rihouey C, Seveno M, et al. TheIRX10 and IRX10-like glycosyltransferases are critical for glucuronoxylan biosynthesis during secondary cell wall formation[J]. The Plant Journal, 2009,57: 718-731.
[51] Lee C, Zhong R, Richardson E A, et al. Thegene is expressed in cells undergoing secondary wall thickening and is essential for glucuronoxylan biosynthesis[J]. Plant Cell Physiology, 2007, 48: 1659-1672.
[52] Brown D, Wightman R, Zhang Z, et al.genes() andencode DUF579-containing proteins that are essential for normal xylan deposition in the secondary cell wall[J]. The Plant Journal, 2011, 66: 401-413.
[53] Jensen J K, Kim H, Cocuron J C, et al. The DUF579 domain containing proteins IRX15 and IRX15-L affect xylan synthesis in[J]. The Plant Journal , 2011, 66: 387-400.
[54] Liepman A H, Nairn C J, Willats W G T, et al. Functional genomic analysis supports conservation of function among cellulose synthase-like a gene family members and suggests diverse roles of mannans in plants[J]. Plant Physiology, 2007, 143(4): 1881-1893.
[55] Suzuki S, Li L, Sun Y H, et al. The cellulose synthase gene superfamily and biochemical functions of xylem-specific cellulose synthase-like genes in[J]. Plant Physiology, 2006, 142(3): 1233-1245.
[56] Campbell M M , Sederoff R R. Variation in lignin content and composition (mechanisms of control and implications for the genetic improvement of plants)[J]. Plant Physiology, 1996, 110(1): 3-13.
[57] Barros J, Serk H, Granlund I, et al. The cell biology of lignification in higher plants[J].Annals of Botany, 2015, 115(7): 1053-1074.
[58] LIU C J. Deciphering the enigma of lignification: precursor transport, oxidation, and the topochemistry of lignin assembly[J].Molecular Plant, 2012, 5(2): 304-317.
[59] Hu W J , Harding S A , Lung J, et al. Repression of lignin biosynthesis promotes cellulose accumulation and growth in transgenic trees[J]. Nature Biotechnology, 1999, 17(8): 808-812.
[60] Leplé J C, Dauwe R, Morreel K,et al. Downregulation of cinnamoyl-coenzyme areductase in poplar: multiple-level phenotyping reveals effects on cell wall polymer metabolism and structure[J]. The Plant Cell, 2007, 19(11): 3669-3691.
[61] WadenbäCk J, Arnold S V, Egertsdotter U, et al.Lignin biosynthesis in transgenic Norway spruce plants harboring an antisense construct for cinnamoyl CoA reductase (CCR)[J].Transgenic Research,2008,17(3): 379-392.
[62] Novaes E, Kirst M, Chiang V, et al. Lignin and biomass: a negative crrelation for wood formation and lignin content in trees[J]. Plant Physiology, 2010, 154(2): 555-561.
[63] Li L , Zhou Y , Cheng X , et al. Combinatorial modification of multiple lignin traits in trees through multigene cotransformation[J]. Proceedings of the National Academy of Sciences, 2003, 100(8): 4939-4944.
[64] Lars Ò A, Anders G P B , Hans M J A , et al. Computational analyses and annotations of the Arabidopsis peroxidase gene family[J]. Febs Letters, 1998, 433(1/2): 98-102.
[65] Ranocha P , Mcdougall G , Hawkins S , et al. Biochemical characterization, molecular cloning and expression of laccases–a divergent gene family–in poplar[J]. European Journal of Biochemistry, 1999, 259(1/2): 485-495.
[66] Lagrimini L M, Gingas V,Finger F,et al. Characterization of antisense transformed plants deficient in the tobacco anionic peroxidase[J].Plant Physiology, 1997,114: 1187-1196.
[67] Yahong L, Tsuji Y, Nishikubo N, et al.Analysis of transgenic poplar in which the expression of peroxidase gene is suppressed[J].Molecular Breeding of Woody Plants, 2001,18: 195-204.
[68] Lu S, Li Q, Wei H, et al. Ptr-miR397a is a negative regulator of laccase genes affecting lignin content in[J]. Proceedings of the National Academy of Sciences, 2013, 110: 10848-10853.
Effects of Environmental Factors and Secondary Wall Synthesis Genes on Xylem Formation
CHEN Mo, HE Shae, CHEN Shaoxiong, OUYANG Linnan, LIU Xuefeng,ZHANG Cheng, ZHANG Weiyao
()
The process of secondary xylem formation in woody plants determines wood quality and yield. Genetic regulation of this process, in combination with environmental factors, influence this process. In this paper, the understanding of and research on secondary xylem formation and wood morphology inspecies around the world is reviewed and summarized to provide insights to the yield and quality of wood. In this review, special attention is given to the effects that environmental factors and genes controlling synthesis of the main components of secondary cell-walls (cellulose, hemicellulose and lignin) have on xylem formation.
environmental factor; secondary growth; wood formation; secondary cell-wall
S781
A
10.13987/j.cnki.askj.2019.04.009
国家重点研发计划课题 (2016YFD0600502)
陈沫(1994― ),女,在读研究生,主要从事桉树人工林培育培育研究,E-mail:954584495@qq.com
陈少雄(1965— ),男,博士,研究员,主要从事桉树人工林培育研究,E-mail:sxchen01@163.com
