睡眠紊乱与慢性肾脏病
2019-02-12毛晓明综述杨俊伟审校
毛晓明 江 蕾 综述 杨俊伟 审校
慢性肾脏病(CKD)是多种肾脏疾病的统称,在长达数月或数年的疾病过程中,肾脏发生不可逆的结构和功能的损伤和改变。通常,CKD被定义为肾小球滤过率(GFR)<60 ml/(min·1.73m3),或出现其他肾脏损伤的标志,持续时间>3个月[1]。在中国,大约1.2亿人处于CKD的不同阶段,且人数逐年增加[2]。糖尿病和高血压已成为CKD的最主要病因,这两种疾病也因为工作压力的增大、饮食、运动、睡眠等生活方式的改变,患病率增长迅速。此外,肥胖、血脂异常、炎症、吸烟等也是CKD的危险因素,然而其机制尚未完全清楚[3]。
近年来,人们开始关注不良生活方式对健康的影响。人类的正常生活及生命机能存在昼夜的周期性改变,而睡眠是昼夜节律最为人熟知的外在表现,充足的睡眠对维持机体昼夜节律、正常的能量代谢和多种生理功能至关重要,睡眠缺乏已成为重要的社会卫生问题[4]。一些研究发现,睡眠缺乏与CKD的发生和发展之间存在联系[5-6],睡眠时间的减少(<5 h/d)与蛋白尿的发生和GFR的下降存在相关性。本文旨在总结目前关于昼夜节律紊乱以及睡眠缺乏影响肾功能的研究进展,同时对其发生机制做出简述。
睡眠与昼夜节律
人体内许多生理活动都有其内在的生理周期。睡眠与觉醒由位于下丘脑的视交叉上核(SCN)调控,也就是生物钟。在哺乳动物中,生物钟是由核心节律基因转录反馈环调控的(图1),该反馈环由脑和肌肉组织芳香烃受体核转运蛋白的类似蛋白1(brain and muscle ARNT-like 1,BMAL1)和昼夜运动输出周期蛋白(circadian locomotor output cycles kaput,CLOCK)。BMAL1-CLOCK异二聚体触发广泛的时钟控制基因(circadian clock-controlled genes,CCGs)转录,包括周期蛋白(period,PER1,PER2和PER3)和隐花色素(cryptochrome,CRY1和CRY2)基因家族。周期性昼夜节律蛋白同系物(PER)隐花色素(CRY)异二聚体通过抑制BMAL1-CLOCK活性的转录抑制因子,发挥抑制反馈回路的作用。另一个重要的反馈机制是核受体(REV-ERBs)和视黄醇相关孤儿受体(retinoid-related orphan receptors,RORs),它们调控BMAL1的转录水平。在生物钟的强制作用下,机体进入睡眠与觉醒的循环之中。
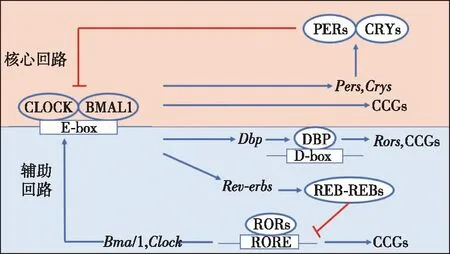
图1 哺乳动物体内节律基因转录/翻译反馈回路机制BMAL1:脑和肌肉组织芳香烃受体核转运蛋白的类似蛋白1;CLOCK:昼夜运动输出周期蛋白;DBP:白蛋白D元件结合蛋白;RORs:视黄醇相关孤儿受体;在核心回路中,BMAL1和CLOCK构成异二聚体BMAL1-CLOCK,该异二聚体结合周期蛋白(PER1,PER2和PER3)和隐花色素(CRY1和CRY2)基因和时钟控制基因(CCGs) 启动子中的E-boxes以激活转录,转录所得mRNA进入细胞质,PERs和CRYs蛋白在细胞质中合成。PERs和CRYs形成复合物,再进入细胞核,抑制BMAL1-CLOCK介导的转录,PERs和CRYs的降解又重新启动了一个新的转录周期。辅助回路包含另外一对拮抗转录因子,核受体超家族(NR1D1和NR1D2,又称REV-ERBα和REV-ERBβ,REV-ERBs)和DBP。前者通过RORs调节CLOCK和BMAL1基因,后者通过结合D-boxes调控其他的一些CCGs
睡眠-觉醒周期是自身节律最重要的外在表现之一,正是觉醒时间的积累和自身节律的规律振荡,使人在睡眠和觉醒两种状态之间规律转变[7]。一方面,体温的昼夜规律变化、褪黑色素和皮质醇等激素的昼夜周期性变化与睡眠的开始有关[8-9],而另一方面,睡眠自身存在稳态调节系统,即睡眠缺乏时睡眠强度和时间的代偿性增加,过量的睡眠则使机体减少对睡眠的需求,这一机制巩固了昼夜节律。早期人们关注于节律改变对睡眠的影响,而近年来则有越来越多的证据说明睡眠也对生物钟有反馈作用[10]。睡眠紊乱往往伴随着节律的紊乱,而节律紊乱又会影响睡眠周期,两者之间关系密切,很难分割开来。
睡眠独立于节律之外的特点,在于睡眠缺乏的程度是可以累积的,被称为“睡眠债”。短期的持续觉醒与长期的睡眠时间减少有等价的影响。长期的睡眠时间受限(<6h)会导致认知功能障碍,相当于连续2晚不睡[11]。大脑是人体耗氧量最高,代谢最旺盛的器官,睡眠缺乏对大脑的损伤机制与线粒体氧化磷酸化功能的受损、电子传递链损伤有关[12],即造成其代谢障碍。可以推测,睡眠缺乏对全身代谢旺盛的组织,可能都存在较为明显的损害。
肾脏生理功能的昼夜节律
肾脏的生理功能也存在着昼夜节律。尿量[13]、GFR、肾血流量(RPF)[14]、钠钾钙磷等电解质的排泄[15],某些代谢产物的排泄[16]以及尿蛋白的排泄[17],均存在昼夜节律。对小鼠的12种器官的转录组学分析结果显示,肾脏是拥有节律性转录活动的第二大器官,仅次于肝脏[18],许多参与脂质合成、离子转运的基因,其mRNA水平存在昼夜节律,并且一些激活PIK3-AKT-MTOR通路的膜结合受体仅在肾脏内呈周期性表达变化。
肾小管通过重吸收和分泌两种方式,在维持机体水电、酸碱平衡方面发挥重要作用。这一功能的正常进行需要大量ATP供能,使离子转运蛋白发挥作用。电解质排泄的昼夜节律提示肾小管的功能受昼夜节律调控,分为活跃期和非活跃期,这也意味着肾小管的能量代谢模式存在昼夜的周期性改变。尽管缺乏直接证据,但肾皮质和髓质的氧含量存在昼夜周期性变化,夜行动物大鼠就表现为夜高昼低的模式,与RPF的昼夜节律相一致,意味着肾脏在睡眠期间更容易受到缺氧的打击[19],也提示肾脏的耗氧和产能与动物的活动强度成正相关。
越来越多的证据表明,肾脏对细胞外液容量及溶质的调节不仅受到活动、饮食、温度、内分泌系统的调控,也受到节律基因的调控。节律基因及节律调控基因在转录、翻译、翻译后修饰的不同水平上参与昼夜节律的调控机制中来。目前尚且缺乏蛋白组学、修饰组学的研究来提供更多的直接证据,也缺乏合适的数学模型来分析数据,但昼夜节律是进一步研究肾脏生理功能的重要方向。
睡眠缺乏、节律紊乱与CKD的发生发展
肾脏的正常生理功能需要节律基因的维持,损伤的肾脏伴有异常的节律基因表达,而节律基因表达紊乱也给肾脏带来损伤。对高血压TGR(mREN-2)大鼠的研究显示[20],Clock基因表达水平较正常对照组明显上调,而Bmal1基因表达的周期平均值和峰值则较对照组下降。在5/6肾切除的大鼠肾脏中,可以检测到节律蛋白表达的周期性发生改变,BMAL1,DBP和PER2的峰值相比于对照组提前了4h,通过免疫组化定位BMAL1及PER2蛋白可发现其位置发生改变[21]。单侧输尿管结扎(UUO)的小鼠,其节律基因表达的振幅增大,而缺乏Clock基因的小鼠则在UUO后表现出更严重的肾脏纤维化和肾实质损伤[22],COX2抑制剂则能减轻这种损伤,提示CLOCK可能通过调节COX2的表达来保护肾脏。
节律及节律基因的改变也会增加糖尿病和高血压的患病风险,长此以往会发展为CKD。节律基因Bmal1敲除的小鼠生成的儿茶酚胺减少,失去血压的节律性波动[23]。肾小管特异性敲除Bmal1基因后,肾脏的NAD+/NADH比值明显下降,提示代谢异常[24]。越来越多的研究提示CKD和代谢障碍之间存在着强相关性[25],而节律紊乱会导致代谢异常,例如倒班工作者的代谢综合征风险更高[26],这也许是节律紊乱后加速CKD发生和发展的机制之一。
睡眠是节律重要的外在表现之一,是维持节律的重要环节,当睡眠出现问题时,肾功能受到影响。阻塞性睡眠呼吸暂停(OSA)和睡眠缺乏都是最为常见的睡眠障碍的表现,其中,OSA又会导致低氧血症和夜间睡眠缺乏,因此睡眠缺乏是OSA的伴随症状。临床上,OSA患者常常伴有尿电解质排泄异常和夜尿增多,推测与早期肾脏损伤相关,但尚缺乏直接证据。在CKD患者中,OSA是一种常见症状[27],并且与eGFR的下降有明显的相关性[28]。肾脏易受缺氧打击,在机体低通气或呼吸暂停的情况下,局部肾组织发缺氧,从而出现缺氧损伤。这通常被认为是OSA导致肾功能下降的机制。经鼻持续气道正压通气治疗能明显延缓CKD的进展,而针对OSA患者的ACEI/ARB降压治疗则没有明显的效果[29],进一步提示缺氧是OSA患者肾功能减退的根本原因。
单纯的睡眠缺乏也是CKD发生和发展的独立危险因素(表1)。睡眠时间的异常与肾功能进展、CKD的发生存在相关性。一些研究表明,睡眠过长(>8h/晚)或过短(<6h/晚)的人群伴有CKD的比例更高[30-31]。对CKD患者的长期随访发现,睡眠时间<5h,或睡眠质量不佳、睡眠时躁动不安(用睡眠碎片化程度衡量),将增加蛋白尿的发生风险,并且会导致GFR更快地下降[32-33]。在正常人群中的研究同样提示,长期的睡眠缺乏会增加CKD的风险[5]。睡眠缺乏不仅会诱发CKD,也会加速CKD的进展。值得注意的是,也有临床研究发现,睡眠缺乏会导致GFR的升高[34],这并不能说明睡眠缺乏存在保护作用,不仅仅是因为对eGFR的估算并不能反映实际的肾功能,也因为肾脏的高滤过状态已在糖尿病肾病和高血压性肾病的研究中有较为详尽的阐述,高滤过状态过度消耗了肾单位的储备功能,长期看仍是不利因素。现有的临床研究以累计平均每日的睡眠时间长短来划分亚组,忽略睡眠缺乏所包含的多种异常睡眠模式,并且常以问卷的形式统计睡眠时间,其真实性受到受试者主观因素的影响,进一步的研究需要更加精确客观地监测受试者的睡眠情况。在没有明显的缺氧情况下,睡眠缺乏仍与CKD存在相关性,提示充足的睡眠对肾功能的维护作用另有机制,有待进一步研究。在对小鼠进行持续6h的睡眠剥夺后,节律蛋白PRE2在肾脏中的表达增加[10],提示肾脏节律基因表达模式受睡眠的影响,则睡眠缺乏引起的节律紊乱和代谢异常或许是其中机制之一。
小结: 肾脏的生理功能存在昼夜节律,维持正常的生理功能则需要能量维持,面对昼夜不同的能量需求,肾脏的代谢模式和代谢水平每天受人的活动、饮食等因素的影响,在节律基因的调控下,发生以24h为周期的规律变化。睡眠在维持每日的能量代谢动态平衡中发挥着重要作用。当睡眠缺乏时,节律受到影响,能量代谢动态平衡的丧失导致代谢异常,加速了CKD的进展,或促使其发生。充足的睡眠时间对维护CKD患者的肾功能具有重要意义。

表1 睡眠缺乏与eGFR下降或蛋白尿的相关性研究
eGFR:估算的肾小球滤过率;*:该研究为前瞻性研究,该值为发病率之比
