外泌体miR-155调控p38丝裂原活化蛋白激酶信号通路影响心肾综合征大鼠的心肾细胞凋亡
2019-02-12欧阳过蔡虎志王雅乐刘越美陈新宇
欧阳过 蔡虎志 王雅乐 王 敏 刘越美 陈新宇
心肾综合征(CRS)是指心脏或肾脏急慢性功能异常引起另一器官的急性或慢性功能障碍的临床综合征。心脏和肾脏疾病均为临床常见病,且二者经常同时存在,相互影响,这显著增加了患者的死亡率,CRS近年来逐渐被重视。由于CRS的病理机制尚未完全明确,目前尚未发现有效的防治方案。综合前期研究和文献复习,我们发现p38丝裂原活化蛋白激酶(p38MAPK)信号通路在CRS的进展中起着重要作用,本研究基于外泌体miR-155调控p38MAPK信号通路影响CRS大鼠的心肾细胞凋亡探讨其发病机制,发现p38MAPK信号通路在心肾细胞凋亡中起着关键作用,外泌体miR-155可能对p38MAPK信号通路有着调控作用。
材料方法
动物与药品清洁级SD雄性大鼠购自上海斯莱克实验动物有限责任公司,许可证号:SCXK(湘)2016-0002,合格证号:43004700049940。注射用盐酸多柔比星(阿霉素),深圳万乐药业有限公司,生产批号:1804E1,规格10 mg/瓶。
主要试剂大鼠N端前脑钠素ELISA试剂盒(上海希美化学有限公司,货号:CSB-E08752r);人肾损伤分子1(KIM-1)ELISA 试剂盒(上海希美化学有限公司,货号:CSB-E08808r);Tunel细胞凋亡检测试剂盒(凯基生物技术股份有限公司,货号:KGA704);兔多克隆p38MAPK抗体(美国proteintech,货号:14064-1-AP);兔多克隆p-p38抗体(CST公司,货号:#9211);小鼠单克隆β肌动蛋白(β-actin)抗体(美国proteintech,货号:60008-1-Ig);Tris、APS、SDS、TEMED、Tween-20、丙烯酰胺、甘氨酸(美国Sigma);GAPDH、P38引物(上海生工);RIPA裂解液(中国北京普利莱);蛋白酶抑制剂(德国Merck);蛋白磷酸酶抑制剂(瑞士Roche);SuperECL Plus 超敏发光液(美国Thermo pierce);上样缓冲液6X(上海碧云天);逆转录试剂盒(北京康为世纪);Trizol(Invitrogen);逆转录试剂盒、UltraSYBR Mixture(北京康为世纪);SYBRGREEN I核酸染料(北京普博欣生物);血清外泌体提取试剂盒(SBI公司,货号:01.SBI.EXOQ5TM-1);外泌体定量试剂盒(Biovision公司,货号:K120-1-100)。
主要仪器超声彩色多普勒诊断仪(深圳市开立科技有限公司,型号:S2N);-80℃冰箱(中科美菱,DW-HL388);包埋机(常州中威电子仪器,BMJ-A);振荡切片机(莱卡,VT1000S);多功能显微镜和数字图像分析仪(Motic,BA410B);台式高速冷冻离心机(湘仪,H1650R);全自动酶标洗板机(汇松,PW-812);多功能酶标分析仪(汇松,MB-530);恒温培养箱(光明,DHP-500);电泳仪(美国Bio-rad,164-5050);转膜仪(北京六一,DYCZ-40A);全自动凝胶成像分析系统(英国Syngene G公司);荧光PCR板(Thermo,SPL0960);荧光定量RCP仪(Thermo,PIKO REAL 96);透射电子显微镜(日立,7700型);数码相机(AMT,ER-B)。
实验分组清洁级SD雄性大鼠,体质量200~250g,在自由饮食、光暗周期为12h/12h、温度22℃~26℃条件下正常饲养1周以适应环境。按体质量分层,再随机分为空白组、造模3周组、造模4周组、造模5周组、造模6周组,每组10只。
造模方法与标本采集用生理盐水将阿霉素配置成质量浓度2.0 mg/ml的溶液,以1.5 ml/kg的标准对大鼠进行腹腔注射,每周注射1次,分别连续注射3周、4周、5周、6周。
分别于造模3周、4周、5周、6周后行心脏超声检测,随后静脉采血,实验末将大鼠处死取心脏、肾脏。
指标检测
心脏超声检测 大鼠腹腔麻醉后,平卧位固定,剔除胸毛,涂耦合剂,将探头置于左胸前,调节探头至左心室短轴切面,计算左室射血分数(LVEF)、左室短轴缩短分数(LVFS)。
血清氨基末端脑钠肽前体(NT-pro BNP)和KIM-1检测 取大鼠血清,严格按照ELISA试剂盒说明书进行操作。
血清肌酐、尿素氮测定 采用全自动生化仪检测血清尿素氮和肌酐含量。
血浆外泌体提取及电镜观察外泌体形态 采用美国SBI公司的外泌体提取试剂盒EXOQuick(EXOQ5A-1)抽提血浆中的外泌体,具体步骤按照试剂盒说明书操作。收集外泌体,以备后续miR-155、CD9的检测。电镜观察外泌体形态及直径。
外泌体定量检测 具体步骤参照美国Biovision 公司ExoQuantTMOverall Exosome Capture and Quantification ELISA Assay Kit (Human Plasma,Colorimetric)说明书进行。
RT-PCR法检测大鼠心脏、肾脏p38MAPK mRNA、miR155及外泌体miR-155的表达 具体步骤参照相关试剂盒说明书进行。引物设计如表1。

表1 RT-PCR检测法引物设计
p38MAPK:p38丝裂原活化蛋白激酶
Western Blot法检测大鼠心脏及肾脏p38MAPK、p-p38MAPK、外泌体CD9蛋白的表达 具体步骤参照相关试剂盒说明书进行。
HE染色观察肾脏病理形态学 取肾脏固定、脱水、包埋、切片、染色、封片后,光学显微镜观察各组细胞形态学变化。
TUNEL法检测大鼠心、肾细胞凋亡阳性细胞率 参照Tunel试剂盒说明书进行操作。每张切片取3个高倍视野,采用Image-Pro-Plus图像分析软件计算每张切片凋亡阳性细胞率,取平均值。
统计学处理采用《SPSS 22.0》统计软件进行数据分析,多样本计量资料比较符合正态性和方差齐性时用单因素方差分析检验,用均数±标准差表示,不符合正态性和方差齐性用非参数检验(Kruskal-Wallis H检验),假设检验水准P=0.05。
结 果
一般情况造模组大鼠逐渐出现腹水、脱毛、毛发干燥枯黄、活动量减少、饮食减少等现象,其中造模6周组1只大鼠死亡,可见腹腔注射部位溃烂。
大鼠心肾功能指标与空白组比较,4周组、5周组、6周组大鼠EF、FS值降低(P<0.01),4周组大鼠血清NT-proBNP升高(P<0.05),5周组、6周组大鼠血清NT-proBNP升高(P<0.01)(表2)。
与空白组比较,4周组大鼠血清肌酐(SCr)升高(P<0.05),5周组、6周组大鼠血清尿素氮(BUN)升高(P<0.01),4周组、5周组、6周组大鼠SCr升高(P<0.01); 5周组、6周组大鼠血清KIM-1升高(P<0.01)。
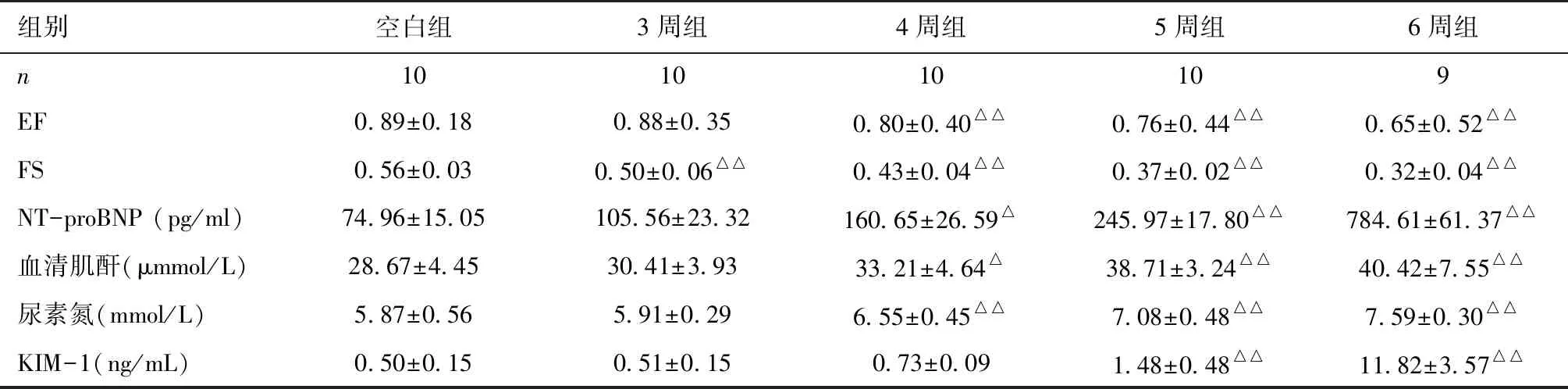
表2 心脏超声EF、FS值、血清NT-proBNP、肌酐、尿素氮、肾损伤分子1(KIM-1)浓度
EF:射血分数;FS:短轴缩短率;NT-proBNP:氨基末端脑钠肽前体;KIM-1:肾损伤分子1;与空白组比较,△:P<0.05,△△:P<0.01
大鼠血浆外泌体含量、外泌体miR-155相对表达量及外泌体标志蛋白CD9的表达与空白组比较,造模 4周组、5周组、6周组大鼠血浆外泌体含量降低(P<0.01),造模3周组、4周组、5周组、6周组外泌体miR-155相对表达量降低(P<0.01)(表3,图1)。
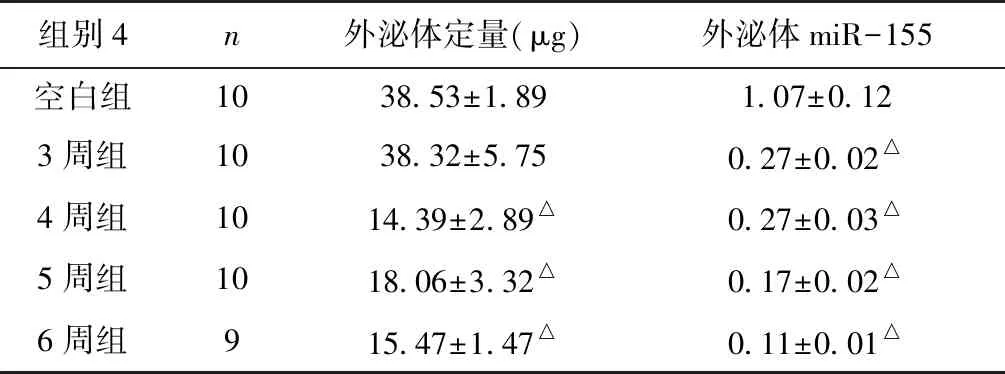
表3 血浆外泌体定量及外泌体miR-155表达
△:与空白组比较,P<0.01
大鼠心脏、肾脏p38MAPK、p-p38MAPK、p38MAPKmRNA、miR-155的表达心脏组织中,与空白组比较,4周组、5周组p-p38MAPK增高(P<0.05),6周组p-p38MAPK增高(P<0.01),4周组p38MAPK mRNA增高(P<0.05),5周组、6周组p38MAPK mRNA增高(P<0.01)。
肾脏组织中,与空白组比较,5周组p38MAPK增高(P<0.05)、6周组p38MAPK增高(P<0.01),4周组、5周组、6周组p-p38MAPK、p38MAPK mRNA增高(P<0.01)。
与空白组比较,造模3周组、4周组、5周组、6周组心肌组织、肾脏组织miR-155相对表达量呈下降趋势(P<0.01)(表4,图2)。
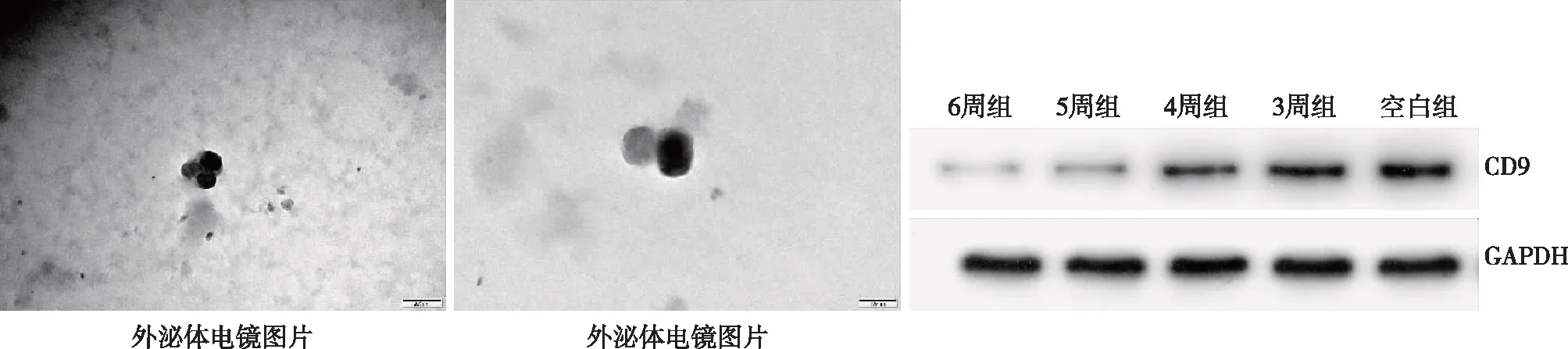
图1 电镜观察外泌体为直径<100 nm的圆形囊泡,Western Blot法检测外泌体标志蛋白CD9呈阳性

组别空白组(n=10)3周组(n=10)4周组(n=10)5周组(n=10)6周组(n=9)心p38MAPK0.65±0.030.67±0.020.65±0.020.61±0.110.67±0.03心p-p38MAPK0.03±0.010.09±0.030.14±0.04△0.15±0.02△0.26±0.03△△心p38MAPK mRNA0.19±0.040.48±0.100.58±0.08△0.74±0.12△△0.83±0.14△△心脏miR-1553.56±0.301.76±0.19△△1.58±0.16△△1.32±0.08△△1.02±0.03△△肾p38MAPK0.56±0.190.55±0.560.55±0.460.65±0.64△0.67±0.02△△肾p-p38MAPK0.03±0.010.08±0.020.11±0.02△△0.14±0.02△△0.24±0.06△△肾p38MAPK mRNA0.25±0.040.74±0.100.88±0.20△△1.06±0.17△△1.11±0.25△△肾脏miR-1553.89±0.171.75±0.08△△1.07±0.12△△0.73±0.03△△0.95±0.05△△
p38MAPK:p38丝裂原活化蛋白激酶;p-p38MAPK:磷酸化p38MAPK;与空白组比较,△:P<0.05,△△:P<0.01

图2 各组大鼠心脏及肾脏p38MAPK、p-p38MAPK蛋白表达情况p38MAPK:p38丝裂原活化蛋白激酶;β-actin:β肌动蛋白
大鼠肾脏组织形态学观察及心、肾细胞凋亡阳性率空白组、造模3周大鼠肾小球、肾小管、肾小囊腔结构完整,无明显病理学改变。造模4周组大鼠肾小球体积轻微增大,肾小球及肾间质可见红细胞和炎症细胞浸润,肾小管上皮细胞有轻度变性。造模5周组大鼠肾小球、肾小管、肾小囊腔形态改变,可见红细胞和炎症细胞浸润,肾小球硬化,部分肾小管萎缩,管腔变窄,肾间质纤维化。造模6周组大鼠可见部分肾小球形态异常,结构不完整,大量炎症细胞浸润,肾小管上皮细胞变性坏死,可见条纹状纤维化。
肾脏HE染色图片中,造模后可见部分肾组织红细胞和炎症细胞浸润、结构改变、肾间质纤维化等病理改变(3A)。
TUNEL法检测细胞凋亡图片中,肾脏切片肾小球和肾小管均可见不同程度核染成棕黄色或褐色阳性染色(3B)。心脏各组均可见心肌细胞不同程度核染成棕黄色或褐色阳性染色(3C)。
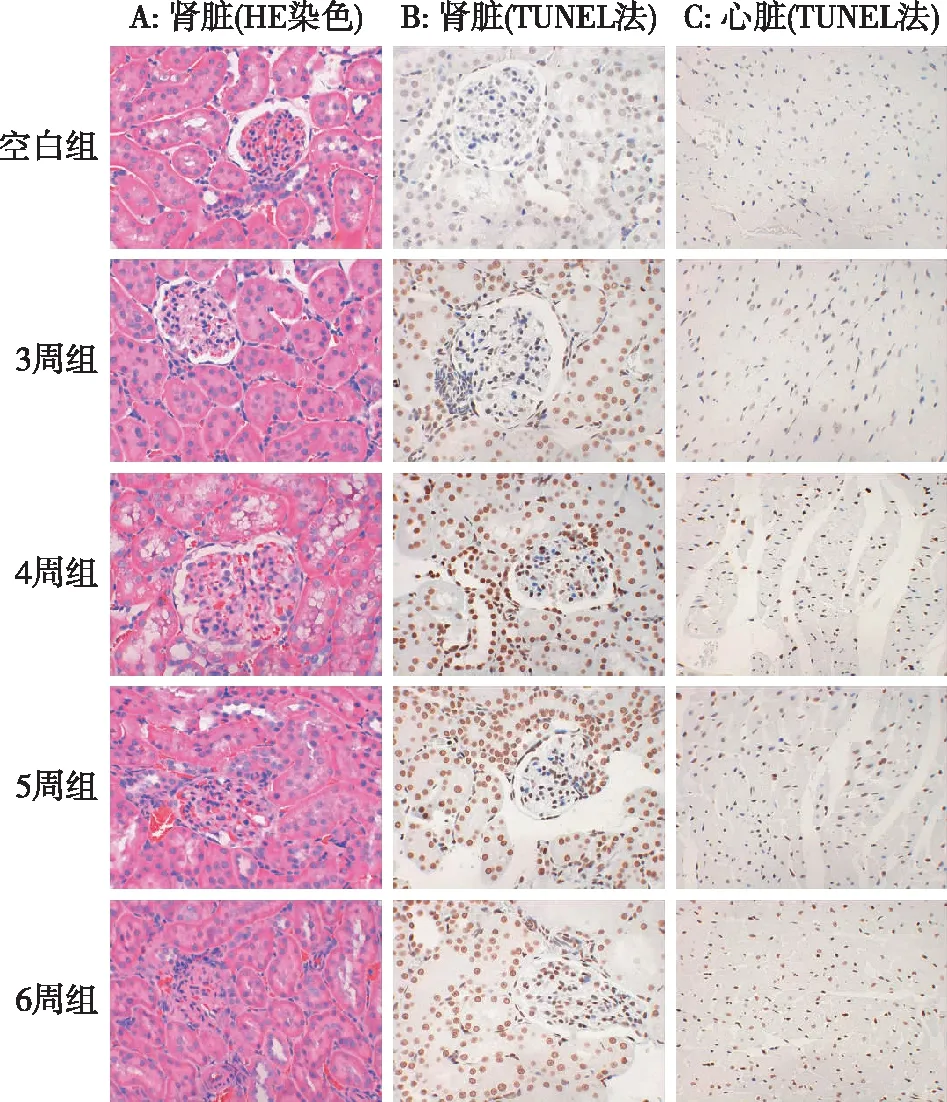
图3 各组大鼠肾脏HE染色和TUNEL法检测心脏、肾脏细胞凋亡图片(×400)
与空白组比较3周组、4周组、5周组、6周组心脏、肾脏凋亡细胞阳性率增高(P<0.01)(表5)。
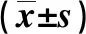
表5 心脏、肾脏凋亡细胞阳性率
△:与空白组比较,P<0.01
讨 论
既往研究证实,CRS的发生主要与下列因素有关:(1)肾素血管紧张素醛固酮系统激活[1];(2)交感神经系统活化[2];(3)慢性炎症反应[3-4]等。在上述因素作用下均可引起心肌细胞和肾脏细胞凋亡。心肌细胞的凋亡被认为是损伤心脏结构和功能的主要途径[5],同时肾脏足细胞凋亡也是肾单位丢失的主要途径[6-7]。课题组前期研究已证实MAPK信号通路中的主要亚族p38MAPK通路蛋白磷酸化的表达与CHF病情进展呈正相关[8]。另有研究证实,p38MAPK磷酸化在足细胞凋亡导致的肾功能损伤中起着关键作用,抑制p38磷酸化,能降低心肾细胞凋亡,增强CRS大鼠心肾功能[9]。由此可知,p38MAPK介导的心肾细胞凋亡在CRS进展中有着重要作用。
本研究也证实,p-p38MAPK的表达量与心肾细胞凋亡率呈正相关,p-p38MAPK的表达量与心肾功能呈负相关,这与前期研究报告基本相符。此外,本研究还发现血浆外泌体含量、外泌体miR-155表达量、心肾组织miR-155表达量与p-p38MAPK表达量、心肾细胞凋亡率、心肾功能呈负相关,而血浆外泌体含量、外泌体miR-155表达量与心肾组织miR-155表达量呈正相关,这表明miR-155可能对p-p38MAPK的表达有抑制作用,且心肾组织miR-155表达量的增多可能是通过外泌体携带miR-155来调节。
研究证实,作为p38MAPK上游非编码调控基因,miR-155可通过丝裂原活化蛋白激酶激酶激酶10途径调控促分裂原活化蛋白激酶3(MKK-3)及MKK-6,从而影响p38MAPK介导系列生物活性反应[10-11]。同时,作为重要的细胞间信号物质运载体——外泌体,几乎可被所有的细胞主动分泌,且外泌体天然存在于体液中,包括血液、唾液、尿液、脑脊液和乳汁[12-13]。由于外泌体可以从细胞内携带miRNAs及其他生物活性物质分泌到细胞间质中而介导着细胞的自分泌、旁分泌及功能物质的远端传递作用,近三年来逐渐受到各领域研究者的高度重视[14-15]。结合本研究结果,我们得出结论:p38MAPK磷酸化在心肾细胞凋亡中起着关键作用,且外泌体miR-155可能对其有着重要的调控作用。
鉴于CRS病理机制的复杂性,本研究从外泌体miR-155调控p38MAPK信号通路影响心肾细胞凋亡出发,研究其可能的病理机制,这对CRS的防治有着重要意义,可能成为未来治疗的靶点。
