柴胡属药用植物多重实时荧光PCR检测方法的建立
2019-02-11张全芳范阳阳刘艳艳陈雪燕谭晴晴胡悦刘国霞汪冰林永强步迅
张全芳,范阳阳,刘艳艳,陈雪燕,谭晴晴,胡悦,刘国霞,汪冰,林永强*,步迅*
(1.山东省农业科学院生物技术研究中心,山东省农业科学院应用生命科学实验室,山东 济南 250100;2.山东省食品药品检验研究院,国家药品监督管理局胶类产品质量评价重点实验室,山东 济南 250101)
柴胡,是伞形科(Umbelliferae)柴胡属(BupleurumL.)植物的干燥根,始载于《神农本草经》,原名茈胡,列为上品。至《本草图经》始易其名为柴胡[1]。具有解表和里、疏肝解郁、升举阳气之功效,为中医治疗少阳症的首选要药[2]。《中国药典》2015年版规定柴胡来源于柴胡(BupleurumchinenseDC.)和狭叶柴胡(BupleurumscorzonerifoliumWilld.),分别习称为北柴胡和南柴胡。药用柴胡植物主要是来自25种、8个变种、3个变型的伞形科(Belliferae)芹亚科(Apioideae)柴胡属(Bupleurum)的植物[3-4]。柴胡在我国有着两千多年药用历史,是最常用的大宗药材之一,但柴胡属植物众多,分布广泛,在产地均作药用,导致柴胡药材品种混杂,药材质量极不稳定[5]。常见的混伪品如黑柴胡(BupleurumsmittiWolff.)、银州柴胡(BupleurumyinchwensenShan et Y Li)、柴首(BulpeurumchaishouiShan et Sheh)、大叶柴胡(BupleurumlongiradiatumTurcz.)、秦岭柴胡(BupleurumlongicauleWall wx DC.Var.Giraldii Wolff.)[6]。
目前,柴胡的鉴定主要依靠形态学特征或其中的化学成分柴胡皂苷a、d加以区分,但是由于柴胡属植物在形态、组织上差别不大,且受产地、生态环境、采收时间、加工方法等诸多可变因素的影响,同一种柴胡的生药鉴别特征也会变化,更增加了鉴别的难度[7]。仅用性状、显微及理化鉴别方法较难准确的区分市场上的柴胡品种,因此,建立更加可靠的柴胡鉴别方法对于保证柴胡药材的质量及用药安全具有重要意义。
随着分子生物学技术的发展,一些基于DNA的生物学鉴定手段逐渐丰富起来,与传统分析方法相比,DNA分子法更加客观和准确。目前柴胡鉴别的分子手段主要是DNA条形码技术,通过DNA测序手段比较柴胡的ITS序列进行鉴别操作复杂,仪器配套成本高,局限性大。近年来实时荧光定量聚合酶链式反应(qPCR)技术的飞速发展大大提高了检测的灵敏度、特异性和准确性,并使得成分含量的定量溯源成为可能[8],因此,本研究基于ITS2序列建立的南柴胡、北柴胡及伪品柴胡多重实时荧光定量PCR检测体系将能更加准确、灵敏和快速地检测对应源性成分。
1 材料与方法
1.1 供试材料 北柴胡、南柴胡、竹叶柴胡标准品购自中国食品药品检定研究院;银州柴胡、小叶黑柴胡、锥叶柴胡、膜缘柴胡、藏柴胡、窄竹叶柴胡、白术、人参、党参、生地、石斛、山药、鸡血藤、川贝、枸杞等中药来自山东省食品药品检验研究院。
1.2 试剂与仪器 植物DNA提取试剂盒DNA分子量Marker DL2000、电泳上样缓冲液等PCR反应试剂购自宝生物工程(大连)有限公司。引物与探针由生工生物工程(上海)有限公司负责合成。2×TaqMan Master Mix为DBI Bioscience品牌。 DNA测序由山东省农业科学院生物技术研究中心测序中心完成。
ABI 7500荧光定量PCR仪(ABI公司);Takara PCR仪[宝生物工程(大连)有限公司];5424 D型高速离心机(Eppendorf公司);凝胶成像仪(Bio-Rad公司)。
1.3 方法
1.3.1 引物与探针的设计 ITS2 序列是介于5.8S和28S rRNA 基因之间的非编码序列,因其在核糖体rDNA 整体结构功能上的特殊,既具有一定的保守性,又具有较高的可变性,其序列在不同种类、或同种的不同个体中都可能存在较大差异,因此,利用ITS2 序列作为南、北柴胡鉴定靶基因具有既简明又可靠的特性。通过比对南、北柴胡ITS2序列特征,设计南、北柴胡的特异性引物和探针,以及柴胡的通用引物及通用探针(见表1)。

表1 引物与探针序列
1.3.2 柴胡干根DNA的提取 用无菌手术刀切片刮弃表皮,剪碎混合,取80 mg置于灭菌研钵中,液氮快速研磨。采用CTAB[9]法提取DNA,用1%的琼脂糖凝胶电泳检测提取DNA的质量。
1.3.3 单重荧光PCR检测方法的建立 通过对单一荧光定量PCR反应体系中的Taq酶用量、引物浓度、探针浓度和退火温度的优化,建立了南柴胡、北柴胡的单重荧光定量PCR方法。其中上下游引物以1.0、2.0、5.0、10.0 μmol·L-1为浓度梯度,探针浓度在0.1~5.0 μmol·L-1之间,以1.0 μmol·L-1梯度递增,每个浓度梯度做5个平行样,PCR反应条件:95 ℃ 2 min预变性;95 ℃ 10 s,58 ℃ 35 s(收集荧光信号),40个循环。在体系中引物和探针浓度优化后将退火温度设置为56~66 ℃,以2 ℃为一个梯度,共6个退火温度进行实时荧光定量PCR扩增,同一模板5个平行样的3次重复试验,对扩增所得数据进行分析,除了以产生Ct值最小、荧光信号强度最高和Ct值标准偏差最小综合指数最高为依据外,还要考虑既保证扩增效率的同时又要确保探针的特异性等条件,最终确立最佳的退火温度。
1.3.4 多重荧光PCR检测方法的建立 在单一荧光PCR建立的最优体系和确保试验特异性及稳定性的基础上,在同一反应体系中加入南柴胡、北柴胡通用引物和特异探针与柴胡通用引物与通用探针,并根据阈值(即Ct值)和荧光增量,对各引物、探针浓度及循环参数进行优化,确定多重实时荧光PCR检测体系和方法。
1.3.5 多重实时荧光PCR特异性试验 分别从北柴胡、南柴胡、银州柴胡、小叶黑柴胡、锥叶柴胡、竹叶柴胡、膜缘柴胡、藏柴胡、窄竹叶柴胡、白术、人参、党参、生地、石斛、山药、鸡血藤、川贝、枸杞等植物的药用部位提取基因组DNA为模板,按照上述优化的反应体系和反应条件进行荧光定量PCR,检测引物和探针的特异性。
1.3.6 多重实时荧光PCR灵敏度试验 将南、北柴胡的基因组DNA定量到50 ng,按5×梯度稀释,每个梯度均取2.0 μL为模板量,(即:10、2、0.4、0.08、0.016 ng),将每组检测设立3个平行样,每个样品重复3次,每次试验的结果一致才能确定该方法的检测限灵敏度。
1.3.7 实际样品检测 利用建立的多重实时荧光PCR检测方法对质检局提供的46份柴胡样品进行柴胡成分检测,并与DNA测序法进行比对,以验证方法的使用价值。
2 结果
2.1 单重荧光PCR检测方法的建立 最佳反应体系为20 μL,2×TaqmanMaster mix 10.0 μL,对引物浓度、探针浓度和退火温度的优化。确定最佳引物浓度为10.0 μmol·L-1,南柴胡探针终浓度为5.0 μmol·L-1,北柴胡探针终浓度为0.4 μmol·L-1,通用探针终浓度为2.0 μmol·L-1。
2.2 多重荧光PCR检测方法的建立 通过优化引物浓度和探针浓度,确定最佳引物混合物终浓度为10.0 μmol·L-1,探针混合物终浓度为5.0 μmol·L-1,总反应体系为20 μL,包括2×TaqmanMaster mix 10.0 μL,Primer Mix(10.0 μmol·L-1)1.0 μL,Probe Mix(5.0 μmol·L-1)1.0 μL,DNA Template(1~20 ng·μL-1)2.0 μL,ddH2O 6.0 μL(见表2)。PCR反应最佳反应条件为:95 ℃ 2 min;{95 ℃10 s;65 ℃35 s} 40个循环,在此收集信号。
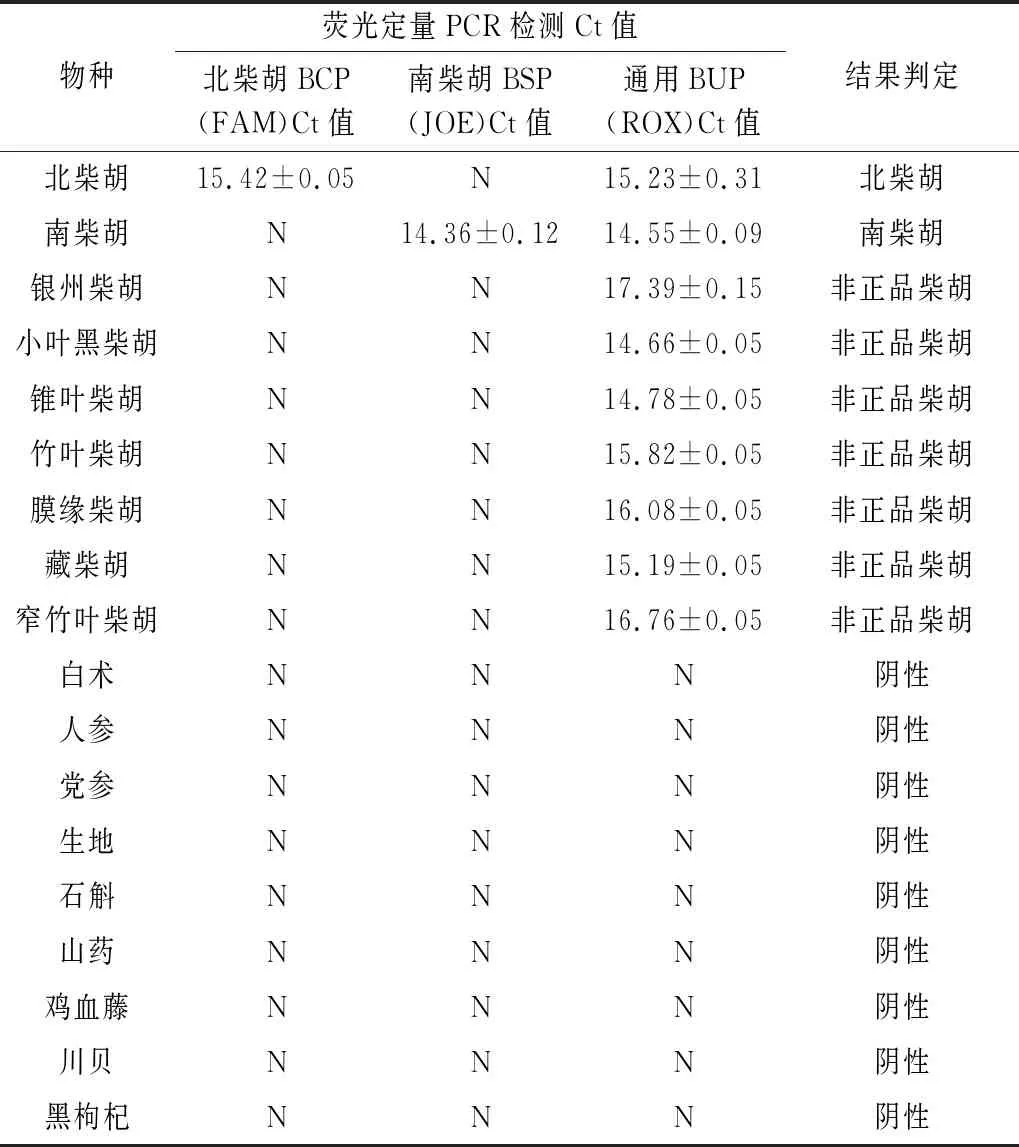
表2 南柴胡、北柴胡引物及探针特异性试验
注:N 代表Negative,阴性
2.3 多重荧光PCR特异性试验 按照“1.3.7”项下的方法针对南柴胡与北柴胡的引物和探针进行特异性检测,当FAM、ROX荧光修饰探针有扩增曲线时,且满足Ct≤35说明待检样本检出北柴胡成分(见图1A);当JOE、ROX荧光修饰探针有扩增曲线,且满足Ct≤35说明待检样本检出南柴胡成分(见图1B);当只有ROX荧光修饰探针有扩增曲线,且满足Ct≤35说明待检样本为伪品柴胡(见图1C)。另外,通过表2可以看出北柴胡和南柴胡源性成分均获得扩增曲线且Ct值,而其他样本没有扩增。综上表明,北柴胡和南柴胡的引物和探针具有很好的物种特异性。
2.4 多重荧光PCR灵敏度试验 分析结果显示:当南柴胡模板量为0.08 ng时,有扩增曲线且Ct值<35,当模板量为0.016 ng时,有扩增曲线但Ct值>35;当北柴胡模板量为0.08 ng时,有扩增曲线且Ct值<35,当模板量为0.016 ng时,无扩增曲线;因此,南、北柴胡的定量检测限为0.08 ng(见图2)。
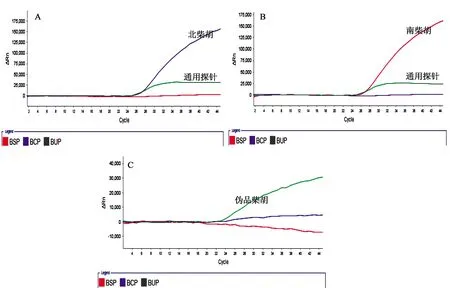
图1 南、北柴胡特异性扩增曲线图
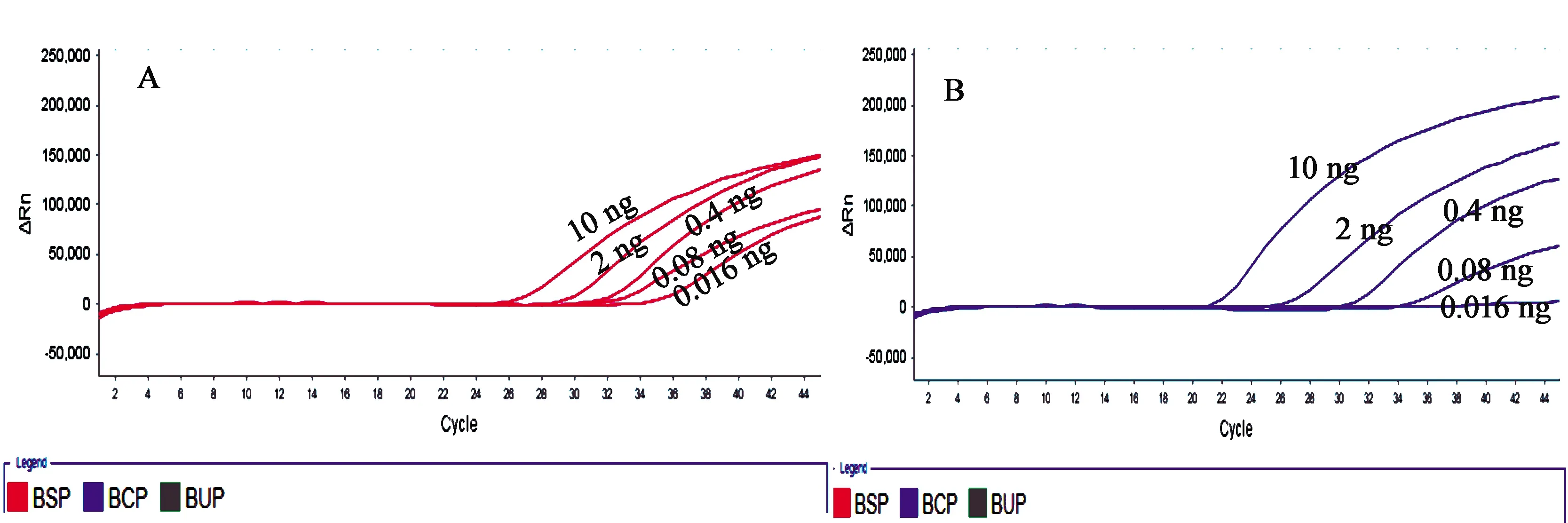
图2 南柴胡、北柴胡灵敏度扩增曲线图
2.5 实际样品检测 利用本试验建立的方法检测46份柴胡样品。其中17份检出北柴胡源性成分,5份为南柴胡,其他样品均检测为伪品柴胡。与DNA测序法结果一致,表明本方法具有一定的使用价值。
3 讨论
目前用DNA分子标记鉴定柴胡大部分是通过提取柴胡幼嫩组织,而柴胡入药部分多为含有大量次生代谢产物的茎或干根,并且经过进一步加工和炮制,这就为柴胡DNA的提取带来了困难。此外,在实际应用方面多数研究也没有获得柴胡特有的分子标记。因此,传统的鉴别方法不能满足当前市场对柴胡真伪鉴定的需求,而通过改进的柴胡基因组提取方法以及实时荧光定量PCR的特异性检测能很好地解决这类问题。王亚丹等[10-12]发现,基于ITS2序列可以准确可靠地鉴别柴胡药材及其混伪品。本研究通过比较南、北柴胡的ITS2序列,设计并筛选得到特异PCR引物和TaqMan探针,通过优化体系和条件,建立了南、北柴胡多重实时荧光PCR检测体系,能够快速鉴定柴胡及其制品中南柴胡、北柴胡源性成分。在柴胡生产加工质量监控及监管部门监管中具有很高的应用价值。
