玉米根系分泌物中关键抑菌物质对大豆疫霉的抑菌活性
2019-02-10张贺何依依吴家庆杨雨馨郑凯元杨敏朱书生何霞红朱有勇刘屹湘
张贺 何依依 吴家庆 杨雨馨 郑凯元 杨敏 朱书生 何霞红 朱有勇 刘屹湘

摘要 :間作是控制作物土传病害的有效手段,根系分泌物对病原菌生长的影响是间作具备控病效果的重要原因。本文研究了玉米根系对大豆疫霉游动孢子行为特征的影响,鉴定了玉米根组织中的关键抑菌活性物质,测定其对大豆疫霉菌丝生长和游动孢子行为的影响。结果表明,大豆与玉米间作能够显著降低大豆疫霉根腐病的发生,玉米根系和根系分泌物能够显著减弱根际大豆疫霉游动孢子的游动和根际大豆疫霉休止孢的萌发能力。通过HPLC对玉米根组织进行分析,发现玉米根组织中存在门布和苯并噻唑这两种抑菌物质,两者能显著抑制大豆疫霉游动孢子的游动和其休止孢的萌发能力; 在浓度为500 μg/mL时,其游动抑制率均达到100%; 而萌发抑制率分别为100%和81%。同时,门布和苯并噻唑都能显著抑制大豆疫霉的菌丝生长。在浓度为500 μg/mL时,其抑制率分别为100%和62.49%。综上所述,玉米根系组织中产生和分泌的门布和苯并噻唑对大豆疫霉具有抑菌活性,生产上可以利用玉米/大豆间作降低大豆疫病的危害。
关键词 :玉米/大豆间作; 大豆疫霉; 门布; 苯并噻唑
中图分类号:
S 435.65, S 476
文献标识码: A
DOI: 10.16688/j.zwbh.2018487
Inhibitory activity of the key antifungal substances in maize root
exudates against Phytophthora sojae
ZHANG He, HE Yiyi, WU Jiaqing, YANG Yuxin, ZHENG Kaiyuan, YANG Min,
ZHU Shusheng, HE Xiahong, ZHU Youyong, LIU Yixiang
(Yunnan Agricultural University, Key Laboratory of Agrobiodiversity and Pest Management,
Ministry of Education, State Key Laboratory for Conservation and Utilization
Bio Resources in Yunnan, Kunming 650201, China)
Abstract
Intercropping is widely used for suppression of soil borne diseases, and the interactions between maize roots and pathogens play an important role. The present research verified the inhibition of soybean Phytophthora root rot by maize/soybean intercropping, and measured the effect of maize roots on zoospore behaviors of Phytophthora sojae. Then the antimicrobial activity of the compounds in maize root extracts were identified by HPLC, and the effect of key compounds on mycelial growth and zoospore behaviors of P.sojae was detected. The results showed that maize/soybean intercropping could significantly reduce the incidence of Phytophthora root rot. Maize roots and root exudates could significantly inhibit the activity of zoospores and the germination of cystospores of P.sojae. Moreover, MBOA (6 methoxy 2 benzoxazolinone) and BZO (benzothiazole), which were identified by HPLC, could significantly inhibit the swimming of zoospores and the germination of cystospores of P.sojae. At the concentration of 500 μg/mL, the inhibition rate of MBOA/BZO against zoospore swimming and cystospore germination reached 100%/100% and 100%/81%, respectively. At the same time, MBOA and BZO could also significantly inhibit the mycelial growth of P.sojae. At the concentration of 500 μg/mL, the inhibition rates were 100% and 62.49%, respectively. In summary, MBOA and BZO produced in the root tissues of maize had antimicrobial activity against P.sojae, which may be the main reason for inhibition of P.sojae by maize roots.Hence maize/soybean intercropping can be utilized to suppress P.sojae root rot.
Key words
maize/soybean intercropping; Phytophthora sojae; MBOA; BZO
现代农业生产中,农作物大面积单一种植在提高产量的同时也增加了病虫害暴发风险。大量研究发现通过间作能够增加农田系统生物多样性并提高产量稳定性,同时降低病虫害的发生[1]。相对于单一种植,多样性种植能够有效稀释作物病原菌、并通过物理作用阻隔病害传播,同时改善田间小气候降低病害发生的严重度[23]。
土传病害是由土壤中的致病微生物侵染作物根系和茎基部所引起的一类分布广泛、危害严重、防治困难的植物病害,严重威胁到全球的粮食生产和安全。大豆疫霉根腐病(简称“大豆疫病”)是一种由大豆疫霉Phytophthora sojae引起的土传卵菌病害,其危害面积大、程度重,是世界大豆生产上的毁灭性病害之一[4]。在中国西南部地区,玉米和其他作物间作是保证粮食产量和控制病害发生的一种重要生产模式。研究发现玉米与大豆、辣椒、马铃薯等作物搭配进行多样性种植时,不但能有效地降低农作物叶部病害的发生,也能有效抑制疫病的传播和扩展[2,56]。Yang等[7]通过连续三年田间试验发现玉米/辣椒间作能够显著抑制辣椒疫病的扩展和传播,控病效果随着玉米密度增加显著增加; 其根系及分泌物对疫霉菌传播产生的物理阻碍和地下部化感作用是重要的控病因素。
根系分泌物是植物在生长过程中通过根的不同部位向基质(土壤、营养液等)中溢泌或分泌的一组种类繁多的物质[8],在植物根际病原菌互作中扮演着非常重要的角色[9]。已有研究表明[10],玉米根组织及根系分泌物中含有丰富的苯并恶嗪类物质门布(6 甲氧基 2 苯并唑啉酮,MBOA)和苯并噻唑類物质苯并噻唑(BZO)。这类化合物具有多种生物活性,包括抗虫性、对植物的毒性、抗病性及化感作用等。
本文以玉米/大豆间作为研究对象,针对玉米根系与大豆疫霉的互作行为特征,观察了玉米根际大豆疫霉孢子的行为特征,并通过HPLC鉴定玉米根系组织中是否存在门布和苯并噻唑; 并进行了门布和苯并噻唑对大豆疫霉的抑菌活性分析。以期为科学合理地利用玉米与大豆间作控制大豆疫霉根腐病提供理论基础。
1 材料与方法
1.1 供试菌株和材料
1)供试菌株:大豆疫霉Phytophthora sojae (2号生理小种:P6497),由中国农业大学种子病理药理研究室提供。
2)供试植物材料:玉米品种为玉米自交系‘B73,由四川农业大学提供; 大豆品种为感病品种‘Williams,由东北农业大学提供。
3)V8培养基:V8果汁 200 mL,CaCO33 g,琼脂粉 15 g,ddH2O 1 L。
4)供试标准品:噻唑,分子式C7H5NS,英文名及缩写为benzothiazole (BZO),中文名苯并噻唑,纯度97%。酮类,分子式C8H7NO3,英文名及缩写为6 methoxy 2 benzoxazolinone (MBOA),中文名6 甲氧基 2 苯并唑啉酮(门布),纯度97%; 两个标准品均购自SIGMA公司。
1.2 试验方法
1.2.1 菌种的活化和游动孢子液的制备
菌种的活化、培养:将大豆疫霉P6497从菌种保存管中转移至9 cm的V8培养基平板上于25℃光照培养箱中光暗交替培养4 d后,用直径6 mm的打孔器打取菌碟并转接在新的V8平板上,继续在25℃光照培养箱中光暗交替培养。
将培养6~8 d的大豆疫霉菌株P6497,用无菌打孔器沿菌落边缘打取直径为6 mm的菌丝块(所有菌丝块的菌龄一致),把菌丝块移入灭菌的装有10%液体V8培养基的三角瓶中,每皿移入20块菌碟,25℃黑暗培养48 h后,待菌丝长出,把菌丝块分别挑入灭菌培养皿中,并用无菌去离子水冲洗菌碟,冲洗4~5次,直至菌碟发白,菌丝充分展布开即可,每次冲洗时间间隔5~10 min,最后用一次性无菌注射器加入15 mL土壤浸提液,25℃黑暗培养12~15 h后,显微镜下观察即可看到大量游动孢子释放。吸出孢子悬浮液并用血球计数板观测浓度,稀释为105个/mL 的游动孢子悬浮液。
1.2.2 玉米根系对大豆疫霉游动孢子休止和休止孢萌发的影响
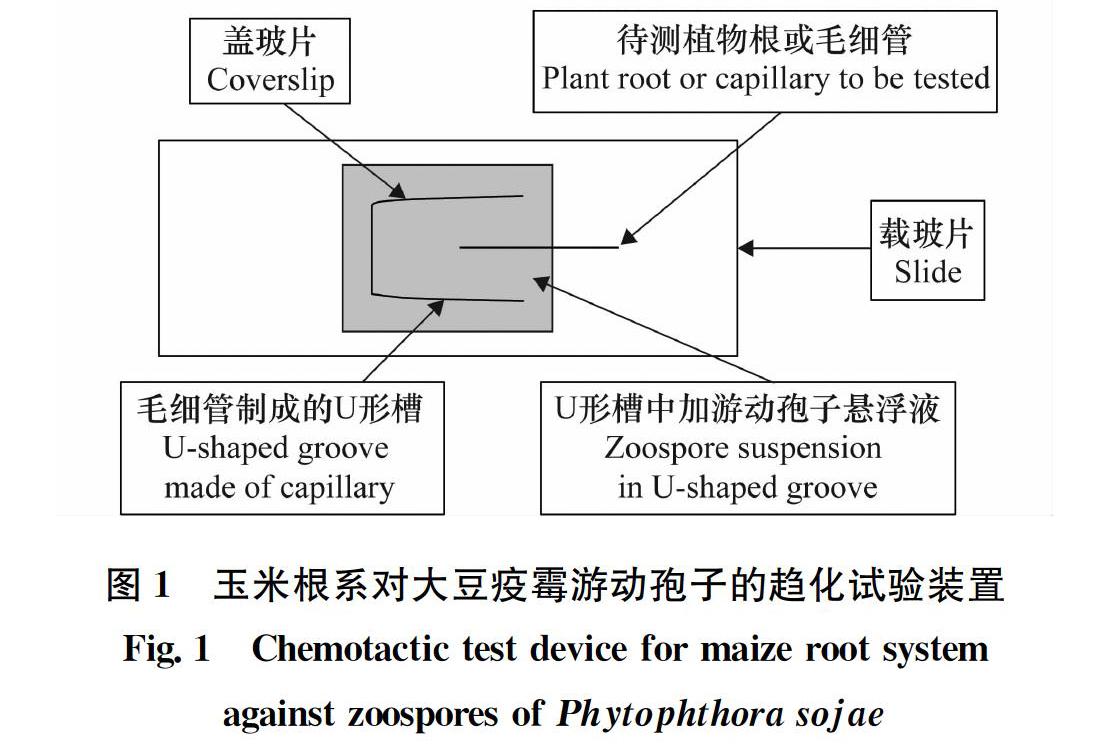
将籽粒饱满的玉米种子播种在灭菌的土壤中,置于温室25℃下光照12 h、黑暗12 h交替培养,种子萌发前加适量的水以保证其所需的湿度。当玉米根系生长到一定量时,即可取材进行下一步试验。参照 Fan等[11]的方法进行玉米根系对大豆疫霉游动孢子影响的观察。具体方法如图1所示,用直径1 mm 的毛细管制成一个 U 形管,两端加热封闭,然后将U形管置于载玻片上,盖上盖玻片后变成1个一端开口的槽(长50 mm×宽25 mm×高1 mm)。在槽中加入浓度为1×106 个/mL的游动孢子悬浮液。无损伤的待测玉米根系直接插入开口端,以一端放入直径为1 mm的封口的毛细管作为对照,在显微镜下观察游动孢子在玉米根际的行为。
另外,将大豆疫霉游动孢子吸入2 mL离心管中,在涡旋仪上振荡2 min,使其鞭毛断裂。后期方法同上,观察玉米根系对大豆疫霉游动孢子休止孢的萌发影响。
1.2.3 玉米根系分泌物对大豆疫霉游动孢子休止和休止孢萌发的影响
当玉米生长至4叶期时,进行玉米根系分泌物的收集。具体方法为:将15株玉米植株从土中取出,清洗根系后置于组培瓶中,加入150 mL超纯水确保淹没玉米根系,4 h后收集浸泡液,再加入150 mL超纯水重复收集一次浸泡液,每天进行两次分泌物收集,其余时间将玉米置于营养液中,连续收集3 d。收集的根系分泌物通过乙酸乙酯进行液液萃取,萃取比例为根系分泌物∶乙酸乙酯=1∶2。萃取所得萃取液通过旋转蒸发仪进行减压浓缩和氮吹至干,称重后用甲醇定容至2 mL。
经减压浓缩之后的根系分泌物母液用无菌水稀释成2.5、5、10、25、50 μg/mL系列浓度梯度的药液(稀释液中甲醇的含量控制在体积分数为1%以下)。试验以含有相同浓度甲醇的蒸馏水为空白对照。用移液器按照1∶4分别吸取门布和苯并噻唑系列浓度的药液和游动孢子悬浮液(制备方法见1.2.1)滴加到凹玻片上,25℃光照保湿培养,5 min(以实际对照的效果决定)后在显微镜下观察游动孢子停止的数量,并拍照记录。以含相同浓度甲醇的无菌水作为对照,每个浓度设置3次重复,每个重复计算1个视野内的游动孢子停止数量。并按以下公式计算停止率和抑制率。停止率=单个视野内孢子停止数/单个视野内总孢子数×100%; 抑制率=(对照游动率-处理游动率)/对照游动率×100%。
1.2.4 玉米根组织中关键活性物质检测
参照Ahmad等[12]的方法进行玉米根组织液的提取。将生长至4叶期的玉米植株地下部分剪下称重,然后将玉米根迅速用液氮冷冻并研磨成粉末后转移至 50 mL离心管中,加入5 mL甲醇,涡旋器上振荡30 s,超声10 min。超声结束后离心(10 000 r/min,10 min)。将离心后的上清液转移到新离心管中并用旋转蒸发仪将甲醇蒸干; 随后将蒸干的样品重新溶解于2 mL甲醇中,0.22 μm的有机相滤膜过滤后用于HPLC检测。
称取门布(购于Sigma公司,纯度97%)和苯并噻唑(购于Sigma公司,纯度97%)标准品各0.001 g,加入一定量的甲醇溶液配制成每1 mL分别含0.5、0.25、0.1、0.05、0.03 mg的标准品溶液,所得标准品溶液用0.45 μm滤膜过滤。对制得的根组织液和门布、苯并噻唑标准品进行超高效液相色谱仪LC 30A分析。检测条件如下:色谱柱 C18(4.6 m×150 mm,4 μm 120 ,Acclaim TM 120); 流动相由乙腈(A)和水(B)组成,0~10 min,20%~61%溶液 A; 10~11 min,61%~95%溶液 A; 11~26 min,95%溶液 A; 26~27 min,95%溶液 A; 27~29 min,20%溶液 A等度洗脱; 流速0.5 mL/min; 波长230 nm; 柱温30℃; 进样体积10 μL。根据标准品MBOA和BZO 的保留时间及质谱典型离子碎片检索玉米根组织的液谱和质谱数据,以鉴定是否存在这种物质。
1.2.5 门布和苯并噻唑对游动孢子游动的影响
供试原药均以甲醇为溶剂配制成浓度为1× 105μg/mL的母液,储存于4℃冰箱中备用。用无菌水稀释成5、150、250、500、1 250、2 500 μg/mL系列浓度梯度的药液(稀释液中甲醇的含量控制在体积分数为1%以下)。试验以含有相同浓度甲醇的蒸馏水为空白对照。
试验方法同1.2.3。
1.2.6 门布和苯并噻唑对游动孢子休止孢萌发的影响
将配制好的游动孢子悬浮液在涡旋仪上振荡 10 min使游动孢子休止。用移液器按照1∶4分别吸取门布和苯并噻唑系列浓度的药液和休止孢悬浮液滴加到凹玻片上,25℃光照保湿培养,1.5 h(以实际对照的效果决定)后在显微镜下观察游动孢子休止孢萌发的数量,并拍照记录。以含相同浓度甲醇的无菌水作为对照,每个浓度设置3次重复,每个重复计算1个视野内的游动孢子休止孢萌发数量。并按以下公式计算萌发率和抑制率。萌发率=单个视野内萌发休止孢数/单个视野内休止孢总数×100%; 抑制率=(对照休止孢萌发率-处理休止孢萌发率)/对照休止孢萌发率×100%。
1.2.7 门布和苯并噻唑对大豆疫霉菌丝生长的影响
参照朱书生等[13]的方法,采用菌丝生长速率法测定门布和苯并噻唑对大豆疫霉菌丝生长的影响。分别制备含有药液浓度为 0、1、30、50、100、250、500 μg/mL的培养基。用直径为5 mm的打孔器打取大豆疫霉菌饼,接种于培养基中央,每个浓度设置3次重复,置于25℃恒温光照培养箱内培养。培养5 d后,待空白对照菌落长到培养皿的2/3左右时,用“十字交叉法”测量出每一处理下的菌落生长直径,并计算不同处理的抑制率。抑制率=(对照菌落直径—处理平均菌落直径)/对照菌落直径×100%。
1.3 数据统计与分析
应用SPSS数据分析软件对不同处理的试验数据进行统计分析。
2 结果与分析
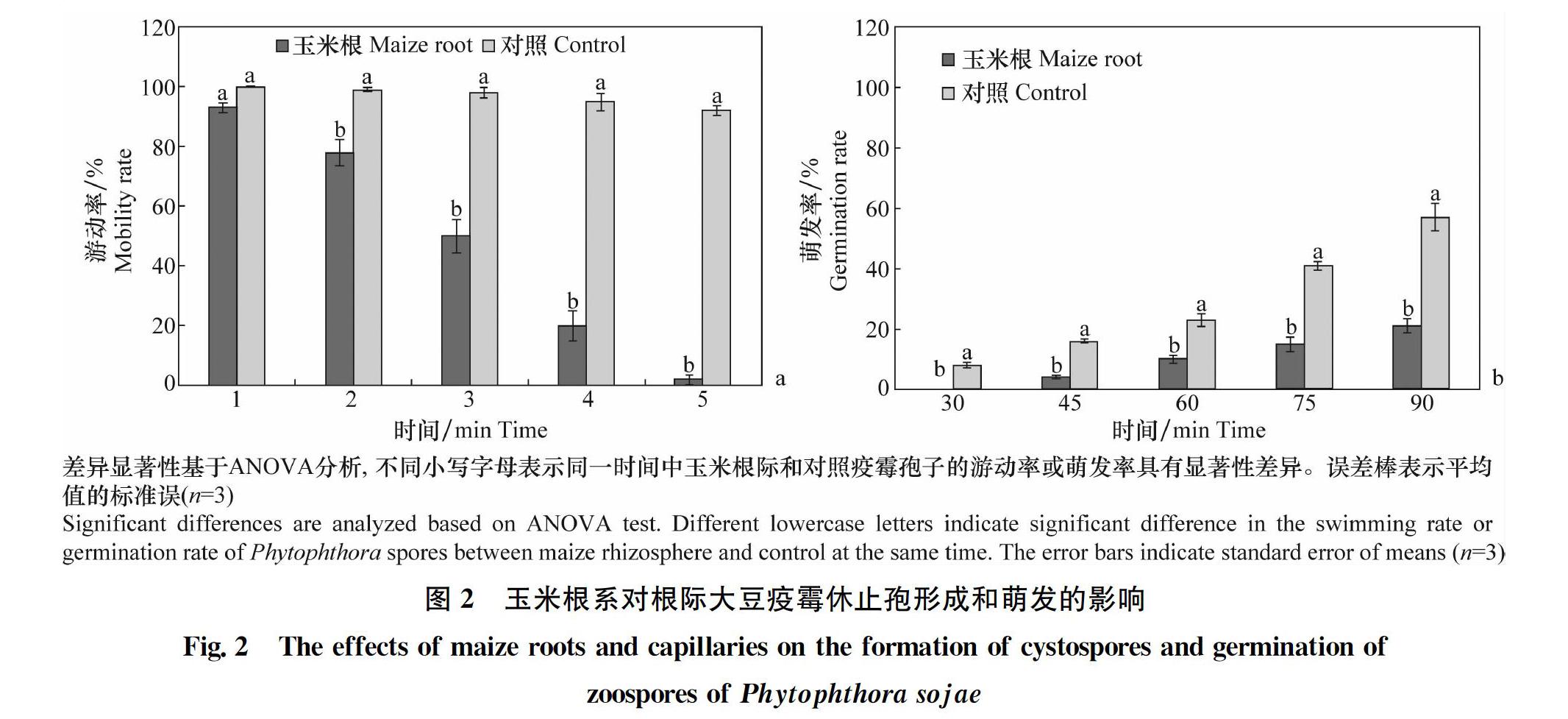
2.1 玉米根系对大豆疫霉游动孢子游动和休止孢萌发影响
试验结果表明(图2),玉米根系能够显著减弱根际大豆疫霉游动孢子的游动能力,且随着时间延长其抑制效果增强,5 min时玉米根际的大豆疫霉游动孢子几乎全部丧失游动能力,游动率为2%,而对照游动孢子游动率为92%(图2)。观察还表明,玉米根系能够延迟和抑制根际大豆疫霉休止孢的萌发。普通休止孢在30 min开始出现萌发,而玉米根际休止孢则45 min才出现萌发;直到90 min时,玉米根际对大豆疫霉休止孢萌发的抑制率达到57%(图2)。
2.2 玉米根系分泌物对大豆疫霉游动孢子游动和休止孢萌发影响
为了进一步验证玉米根系潜存的分泌物对大豆疫霉游动孢子及休止孢的影响,测定了玉米根系分泌物对大豆疫霉游动孢子和休止孢萌发的影响,结果表明(图3),玉米根系分泌物能显著抑制大豆疫霉游动孢子的游动能力和萌发能力,且抑制效果随着浓度增加显著增加,在浓度为30~75 μg/mL时,其抑制率分别为30%~48%和24%~30%。
2.3 玉米根组织中门布和苯并噻唑的HPLC分析
通过HPLC对玉米根组织提取液进行分析(图4),结果表明玉米根组织提取液中存在门布和苯并噻唑,门布标准品的保留时间为 8.635 min,苯并噻唑标准品保留时间为10.913 min(图4b,4c)。试验利用相同的条件对玉米植株根組织的检测结果表明(图4a),在8.632和 11.001 min分别出现 2 个可辨峰,8.632 min产生的峰与标准品门布一致,经过换算其在根组织中的浓度为22.988 9 μg/g; 11.001 min产生的峰与标准品苯并噻唑一致,浓度为2.245 6 μg/g。这一结果证明玉米根组织中存在门布和苯并噻唑两种化合物。
2.4 門布和苯并噻唑对大豆疫霉游动孢子游动及休止孢萌发的影响
试验结果表明(图5),门布和苯并噻唑都能显著抑制大豆疫霉游动孢子的游动能力,且抑制效果随着浓度增加显著增加,在浓度为100~250 μg/mL时,其抑制率分别为46%~100%和46%~81%。其中门布对孢子游动的抑制能力高于苯并噻唑,在浓度30 μg/mL和50 μg/mL时,其抑制率比苯并噻唑分别高12%和20%(图5a)。门布和苯并噻唑除了抑制大豆疫霉游动孢子的游动能力外,还能显著抑制其休止孢的萌发,在浓度为100~250 μg/mL时,其抑制率分别为46%~72%和41%~62%。其中门布对孢子萌发的抑制能力要高于苯并噻唑,在浓度为500 μg/mL时,其抑制率比苯并噻唑高19%(图5b)。
2.5 门布和苯并噻唑对大豆疫霉菌丝生长的影响
试验结果表明(表1),门布和苯并噻唑能显著抑制大豆疫霉的菌丝生长,当浓度为10~500 μg/mL时,其抑制率分别为17.33%~100%和13.02%~62.49%。其中,当浓度为100 μg/mL时,门布对大豆疫霉菌丝生长的抑制能力要低于苯并噻唑,其抑制率分别为26.57%和42.44%。而当浓度为250 μg/mL和500 μg/mL时,门布对大豆疫霉菌丝生长的抑制能力要高于苯并噻唑,门布的抑制率达64.65%~100%,而苯并噻唑为56.78%~62.49%。
3 讨论
土传病害是由土壤中致病微生物侵染作物根系和茎基部所引起的一类广泛分布、危害严重、防治困难的植物病害,严重威胁全球的粮食生产和安全。作物多样性种植不仅能有效控制以风为媒介传播的病原菌所引起的地上部病害,比如水稻稻瘟病[14]、白粉病[15]、花生叶斑病[16]等; 同时对于生产中难以防治的土传病害也有很好的控制效果,比如韭菜/番茄间作抑制番茄青枯病[17],西瓜/水稻和西瓜/小麦间作抑制西瓜枯萎病[1819],香蕉/韭菜间作抑制香蕉枯萎病[20],洋葱/番茄间作抑制番茄黄萎病[21]等。本研究发现玉米/大豆间作能够抑制大豆疫病的发生和传播,此研究结果与Yang等[7]发现玉米/辣椒间作可以抑制辣椒疫霉的研究结果一致。由此可见,作物多样性种植可以达到控制土传病害的良好效果。
“植物根系非寄主病原菌”的相互作用和调控是田间多样性种植能够控制土传病害的重要机制。本研究发现,玉米根系能够促使大豆疫霉游动孢子迅速休止,并抑制休止孢的萌发,使病原菌丧失侵染能力。而玉米根系分泌物也存在相同的现象。已有研究表明[7,22]在玉米根辣椒疫霉和油菜根烟草疫霉的相互作用中也存在类似的抑菌现象。因此,病原菌非寄主植物与寄主进行多样性间作能够有效抑制寄主作物病害的发生。这种模式可能是多样性种植能够控制疫病发生的重要机制,其深入机理有待进一步研究。
植物根系分泌化感物质是其具备抑菌和防御能力的直接原因[23]。这些化感物质往往具备广谱抑菌活性,常见作物番茄、豌豆、麦类、玉米和辣椒等根系分泌物中都含有具有抑菌活性的酚类、黄酮类及其他化合物[24]。Park等[25]研究表明,玉米可以通过根系分泌两种抗菌化合物(6R) 7,8 二氢 3 氧代 α 紫罗兰酮和(6R,9R) 7,8 二氢 3 氧代 α 紫罗兰醇抑制茄子枯萎病菌的生长。Ren等[26]发现,水稻和西瓜间作过程中水稻根系分泌物可以抑制西瓜枯萎病菌孢子萌发和菌丝生长。本研究发现玉米根系组织中含有抑菌活性物质苯并恶嗪类物质门布(MBOA)和苯并噻唑类物质苯并噻唑(BZO),MBOA和BZO都能够诱导大豆疫霉游动孢子迅速转化为休止孢,并抑制其萌发和菌丝生长。已有的研究表明,植物根组织细胞从根冠脱落是根系分泌化感物质的主要途径之一[27]。Yang等[7]的研究中也发现玉米根系能分泌抗菌化合物门布(MBOA)和苯并噻唑(BZO)抑制辣椒疫霉的生长。另外,Fang等[22]也发现油菜根系分泌物中的苯并噻唑,2 丁烯酸和戊酸等物质能够显著抑制噁疫霉的孢子游动萌发和菌丝生长。由此可见,玉米根系组织中门布和苯并噻唑的抑菌活性可能是其根系能够有效抑制大豆疫霉生长与传播的重要原因。因此,间作栽培模式下根系微生物相互作用应答并干扰病原菌的传播侵染行为可能是其抑制土传病害发生的重要机制。
玉米与大豆合理间作能有效地控制大豆疫霉根腐病的传播和蔓延,其中重要的可能原因是玉米根系分泌物具有限制大豆疫霉孢子游动和萌发的能力。玉米根组织中包含门布和苯并噻唑两种对大豆疫霉各生长阶段具备抑菌活性的物质,这两种化合物可能介导了“玉米根系大豆疫霉”的相互作用。因此,生产上可利用玉米与大豆间作来控制大豆疫霉根腐病的发生与危害。该研究为利用玉米与其他作物间作控制土传病害的危害提供了重要的理论依据。
参考文献
[1] RATNADASS A, FERNANDES P, AVELINO J, et al. Plant species diversity for sustainable management of crop pests and diseases in agroecosystems: a review [J]. Agronomy for Sustainable Development, 2012, 32(1): 273303.
[2] LI Chengyun, HE Xiahong, ZHU Shusheng, et al. Crop diversity for yield increase [J/OL]. PLoS ONE, 2009, 4(11): e8049.
[3] ZHU Youyong, FANG Hui, WANG Yunyue, et al. Panicle blast and canopy moisture in rice cultivar mixtures [J]. Phytopathology, 2005, 95(4): 433438.
[4] SCHMITTHENNER A F.Problems and progress in control of phytophthora root rot of soybean [J]. Plant Disease, 1985, 69(4): 362368.
[5] 孙雁, 周天富, 王云月, 等. 辣椒玉米间作对病害的控制作用及其增产效应[J]. 园艺学报, 2006, 33(5): 9951000.
[6] 付学鹏, 吴凤芝, 周新刚. 间作防控作物土传病害的機理研究进展[J]. 江苏农业科学, 2016, 44(1): 1620.
[7] YANG Min, ZHANG Yu, QI Lei, et al. Plant plant microbe mechanisms involved in soil borne disease suppression on a maize and pepper intercropping system [J/OL]. PLoS ONE, 2014, 9(12): e115052.
[8] BAIS H P, LOYOLA VARGAS V M, FLORES H E, et al. Root specific metabolism: the biology and biochemistry of underground organs [J]. In Vitro Cellular & Developmental Biology Plant, 2001, 37(6): 730741.
[9] WALKER T S, BAIS H P, GROTEWOLD E, et al. Root exudation and rhizosphere biology [J]. Plant Physiology, 2003, 132(1): 4451.
[10]NIEMEYER H M. Hydroxamic acids derived from 2 hydroxy 2H 1, 4 benzoxazin 3(4H) one: key defense chemicals of cereals [J]. Journal of Agricultural and Food Chemistry, 2009, 57(5): 16771696.
[11]FAN K W, VRIJMOED L L, JONES E B G. Zoospore chemotaxis of Mangrove thraustochytrids from Hong Kong [J]. Mycologia, 2002, 94(4): 569578.
[12]AHMAD S, VEYRAT N, GORDON WEEKS R, et al. Benzoxazinoid metabolites regulate innate immunity against aphids and fungi in maize [J]. Plant Physiology, 2011, 157(1): 317327.
[13]朱书生, 袁善奎, 范洁茹, 等. 六种杀菌剂对黄瓜霜霉病菌不同发育阶段的影响[J]. 农药学学报, 2005, 7(2): 119125.
[14]ZHU Youyong, CHEN Hairu, FAN Jinghua, et al. Genetic diversity and disease control in rice [J]. Nature, 2000, 406(6797): 718722.
[15]NEWTON A C, GUY D C. The effects of uneven, patchy cultivar mixtures on disease control and yield in winter barley [J]. Field Crops Research, 2009, 110(3): 225228.
[16]LI Xiaogang, WANG Xingxiang, DAI Chuanchao, et al. Effects of intercropping with Atractylodes lancea and application of bio organic fertiliser on soil invertebrates, disease control and peanut productivity in continuous peanut cropping field in subtropical China [J]. Agroforestry Systems, 2014, 88(1): 4152.
[17]YU Jingquan. Allelopathic suppression of Pseudomonas solanacearum infection of tomato (Lycopersicon esculentum)in a tomato chinese chive (Allium tuberosum) intercropping system [J]. Journal of Chemical Ecology, 1999, 25(11): 24092417.
[18]HAO Wenya, REN Lixuan, RAN Wei, et al. Allelopathic effects of root exudates from watermelon and rice plants on Fusarium oxysporum f.sp. niveum [J].Plant and Soil,2010,336(1/2):485497.
[19]XU Weihui, LIU Dan, WU Fengzhi, et al. Root exudates of wheat are involved in suppression of Fusarium wilt in watermelon in watermelon wheat companion cropping [J]. European Journal of Plant Pathology, 2015, 141(1): 209216.
[20]ZHANG Hui, MALLIK A, ZENG Rensen. Control of Panama disease of banana by rotating and intercropping with Chinese chive (Allium tuberosum Rottler): role of plant volatiles[J]. Journal of Chemical Ecology, 2013, 39(2): 243252.
[21]FU Xuepeng, WU Xia, ZHOU Xingang, et al. Companion cropping with potato onion enhances the disease resistance of tomato against Verticillium dahliae [J/OL]. Frontiers in Plant Science, 2015, 6: 726. DOI: 10.3389/fpls.2015.00726.
[22]FANG Yuting, ZHANG Limeng, JIAO Yongge, et al. Tobacco rotated with rapeseed for soil borne phytophthora pathogen biocontrol: mediated by rapeseed root exudates [J/OL]. Frontiers in Microbiology, 2016, 7: 894.
[23]BAIS H P, WEIR T L, PERRY L G, et al. The role of root exudates in rhizosphere interactions with plants and other organisms [J]. Annual Review of Plant Biology, 2006, 57: 233266.
[24]BEDNAREK P, OSBOURN A. Plant microbe interactions: chemical diversity in plant defense[J]. Science, 2009, 324(5928): 746748.
[25]PARK S, TAKANO Y, MATSUURA H, et al. Antifungal compounds from the root and root exudate of Zea mays [J].Bioscience Biotechnology and Biochemistry, 2004, 68: 13661368.
[26]REN Lixuan, SU Shiming, YANG Xingming, et al. Intercropping with aerobic rice suppressed Fusarium wilt in watermelon [J]. Soil Biology & Biochemistry, 2008, 40: 834844.
[27]廖靜静,张立猛,张潇丹,等.大蒜类似根缘细胞生物学特性及其对辣椒疫霉菌的抑制活性[J].植物保护,2015,41(5):3945.
(责任编辑:田 喆)
