应用UTMD技术联合脂质体转染介导人肝癌细胞表达miRNA-122的研究
2019-02-10李艳罗栩伟朱冬梅杨姣张英娟张慧陈思佳刘刚刘学彬
李艳,罗栩伟,朱冬梅,杨姣,张英娟,张慧,陈思佳,刘刚,刘学彬
(川北医学院第二临床医学院,南充市中心医院,四川 南充 637000)
肝细胞癌(hepatocellular carcinoma,HCC)是最常见的恶性肿瘤之一,占原发性肝癌的75%~85%,具有起病隐匿、进展快、易复发和预后差的临床特点[1-2]。虽然肝癌的治疗有了很大的提高,但由于耐药性和复发,死亡率仍然很高,中国每年约有383 000人死于肝癌。miR-122是肝脏含量最丰富的肝特异性微小RNA,占肝脏miRNAs的70%,其表达下调参与了肝癌的发生发展[3-5]。
超声靶向微泡破坏(ultrasound-targeted microbubble destruction,UTMD)是指利用超声波和携带靶基因的微泡来实现靶向基因的转染,近年来迅速发展起来的一种新的基因治疗方法[6-7]。它可以通过产生超声波来提高细胞摄取基因的能力,从而暂时提高细胞和毛细血管的通透性[8]。质粒具有高特异性、高敏感性、瞬时表达水平、低耗费和低免疫原性等特点,是UTMD研究的首选载体[9]。Lipofectamine2000是研究中常用的阳离子脂质体转染剂,但其介导质粒转染的效率有待提高[10]。微泡造影剂作为一种无创性载体携带质粒,在超声介导下可显著提高细胞基因转染率和细胞生存率,但微泡不能携带足够数量的基因[11-12]。考虑到脂质体转染和UTMD的优缺点,本研究小组推测这两种方法的结合将会产生更好的转染效果。本研究以肝癌细胞株HCCLM3为对象,构建pLMP-miR-122表达载体,应用UTMD技术联合脂质体介导miRNA-122在HCCLM3细胞中的表达,并探索miRNA-122对人肝癌细胞HCCLM3的生物学行为的影响,为肝癌的诊断和治疗提供新的方向和靶点。
1 材料与方法
1.1 实验仪器和试剂
人肝癌细胞系HCCLM3(购自武汉中国细胞研究中心);无血清高糖细胞 DMEM 培养基(Hyclone);100 U/mL penicillin和100 μg/mL streptomycin;磷酸盐缓冲液(PBS)(HyClone);胎牛血清(FBS)(HyClone);0.25%胰酶(HyClone)注射用六氟化硫微泡(SF6;Bracco Suisse SA,Manno,Switzerland);BCA蛋白定量试剂盒(Thermo Fisher);CCK-8试剂盒(吉凯基因);总RNA提取试剂盒(TIANGEN);细胞培养箱(Thermo Fisher);核酸扩增仪(T100,Thermo);BIO-RAD实时荧光定量PCR仪(ICYCLER IQ5);核酸微量分光光度计(Eppendorf);旋涡震荡器(Eppendorf);高低速离心机(Thermo)。
1.2 方法
1.2.1 质粒构建 根据文献[13]构建pLMP-miR-122质粒。利用生物信息学分析pre-miRNA-122启动子片段并扩增,经测序并序列比对分析后进行转染。
1.2.2 细胞培养、分组和转染 (1)细胞培养。人肝癌细胞株HCCLM3培养于DMEM培养基中,内含10%胎牛血清,100 U/mL青霉素,100 μg/mL链霉素。将HCCLM3细胞置于37 ℃、5%CO2培养箱内培养至对数生长期进行实验,隔2~3 d传代1次,细胞消化液为0.25%的胰酶。(2)细胞分组和转染。转染前1 d将细胞接入6孔板,24 h内待细胞生长密度达到50%~60%即可转染,参照脂质体 LipofectamineTM 2000说明书转染。将人肝癌细胞株HCCLM3分组如下:A组(空载组):转染空载质粒;B组(脂质体+质粒组):1 mL培养液加入10 μL Lipofectamine 2000和4 μg pLMP-miR-122质粒;C组(超声微泡+质粒+超声辐照组):0.9 mL细胞培养液中加入100 μL SF6微泡以及4 μg pLMP-miR-122质粒,然后进行超声辐照,D组(脂质体+超声微泡+质粒+超声辐照组):0.9 mL细胞培养液中加入10 μL Lipofectamine 2000、100 μL SF6微泡以及4 μg pLMP-miR-122质粒,然后进行超声辐照。超声辐照条件为:2.0 MHz(超声造影模式)、机械指数(MI)为 0.28,超声辐照40 s。辐照结束5 h后更换为正常培养液,继续培养。
1.2.3 荧光定量PCR技术检测基因表达水平 按照总RNA提取试剂盒说明书,提取转染48 h的各组细胞总RNA,经逆转录得到cDNA。应用荧光定量PCR(QRT-PCR)技术检测各组细胞pre-miRNA-122表达水平。引物序列见表1,U6为内源性对照。反应条件为:95 ℃预热15 min;94 ℃,15 s;55 ℃,30 s;70 ℃,30 s;共35个循环。每个反应孔的荧光信号达到设定阈值时的循环数即为Ct值。对检测得到的miRNA的CT值以相对定量的方法进行数据分析:miRNA的相对表达量用2-ΔCt来计算。每个基因重复反应3次,进行独立实验3次。选择空载组、以及转染效率最高的细胞组进行后续试验,记为con-LM3组、miR-122-LM3组。
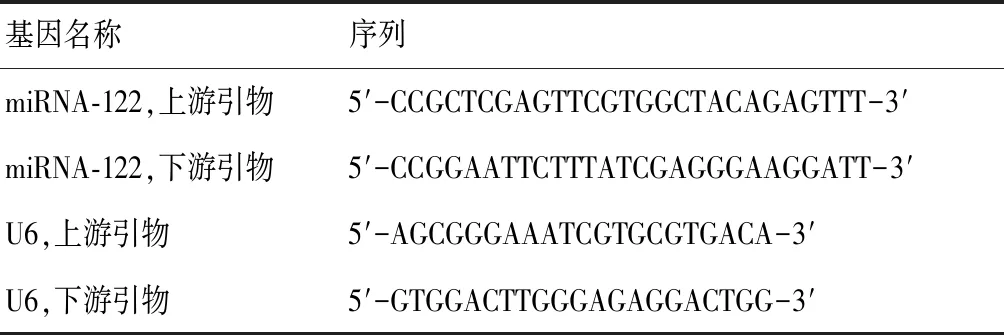
表1 引物序列表
1.2.4 CCK-8检测各组细胞活性 将con-LM3组、miR-122-LM3组细胞接种到96孔板中(104/孔),每组各作5个复孔,贴壁24 h后,即可开始加入10 μL CCK-8试剂孵育2 h后,用酶标仪测定在450 nm处的吸光度(OD值),作为第1天的细胞活性。共检测第1~5天的细胞活性。记录每组5孔的数据并取均数作图。细胞活性以平均OD值表示。
1.2.5 体外迁移和侵袭实验 (1)划痕实验:通过Wound healing assay观察con-LM3组、miR-122-LM3组细胞的迁移情况。培养2 d至细胞融合度为80%左右,血清饥饿16 h,以10 μL枪头划痕,0 h、24 h显微镜下拍照,观察细胞的迁移能力并计算细胞迁移率。细胞迁移率的计算公式=[迁移距离D(0 h)-迁移距离D(24 h)]/迁移距离 D(0 h)。 (2) Transwell 实验:通过Transwell实验分析两组细胞的侵袭能力,使用直径6.5 mm的聚碳酸酯过滤膜(8 μm孔径,BD Biosciences)。细胞(5×104)接种于无血清培养基上室,下室中加入含有20%FBS的DMEM培养基600 μL。孵育48 h后,取出小室,用棉棒拭去上室残留细胞,小室下面穿膜的细胞经4%多聚甲醛固定,0.1%结晶紫染色,PBS洗去残留结晶紫溶液,小室室温晾干后置于显微镜下随机观察6个视野并拍照,计数穿膜细胞数。侵袭实验时,在上室提前加入50 μL基质胶(1∶6,美国BD Biosciences),待胶凝固后加入细胞悬液,其他步骤同迁移。
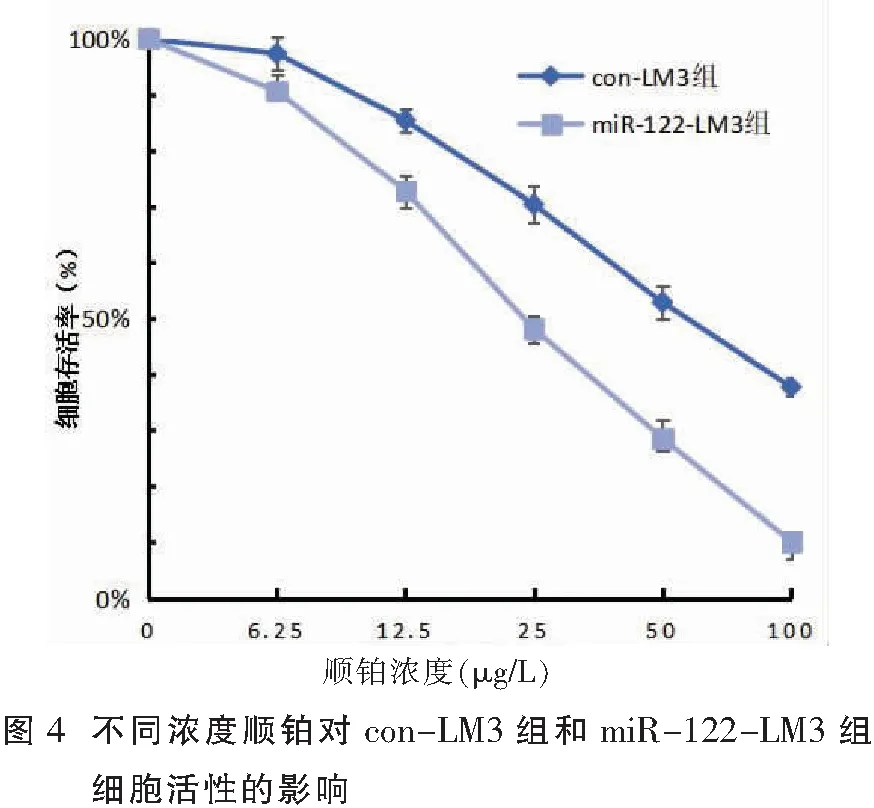
1.2.6 CCK-8检测对化疗敏感性的影响 将对数期的con-LM3组、miR-122-LM3组细胞各均分到96孔板中(104/孔),每组各5个复孔,贴壁24 h后,分别加入6.25、12.5、25、50、100 μg/L顺铂培养,于加药后48 h应用CCK-8法检测细胞OD值,方法同前。(OD正常组-OD药物组)/(OD正常组-OD空白组)×100%=细胞抑制率。细胞存活率=1-细胞抑制率,以细胞存活率绘图。IC50为细胞抑制率等于 50%时的药物浓度。
1.2.7 蛋白印迹(Western blotting)检测抗凋亡蛋白Bcl2的表达 将con-LM3组、miR-122-LM3组细胞均分到六孔板中,长至70%~80%融合后使用裂解液将细胞裂解提取蛋白样品,BCA蛋白定量试剂盒进行定量。取等量蛋白样品进行10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离后,转移至醋酸纤维膜(NC)膜上,5%脱脂奶粉常温封闭1 h,加一抗4 ℃过夜,洗膜后加二抗孵育1 h。一抗(均购自美国Abcam公司)包括:兔抗人甘油醛-3-磷酸脱氢酶(GAPDH,1∶2 000),兔抗人Bcl2(1∶500)。常规增强化学发光法曝光、扫描成像。
1.3 统计学分析

2 结果
2.1 各组细胞转染效率
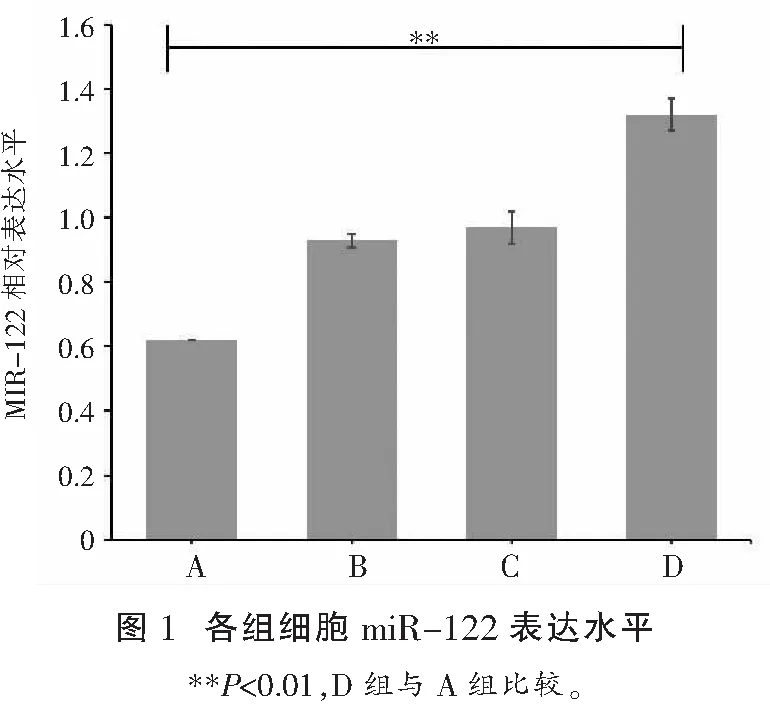
通过QRT-PCR技术检测五组细胞的pre-miRNA-122表达水平,提示D组细胞的miR-122表达水平高于其他各组细胞,差异具有统计学意义(P<0.05);而B、C组之间比较差异无统计学意义(P>0.05)。见图1。
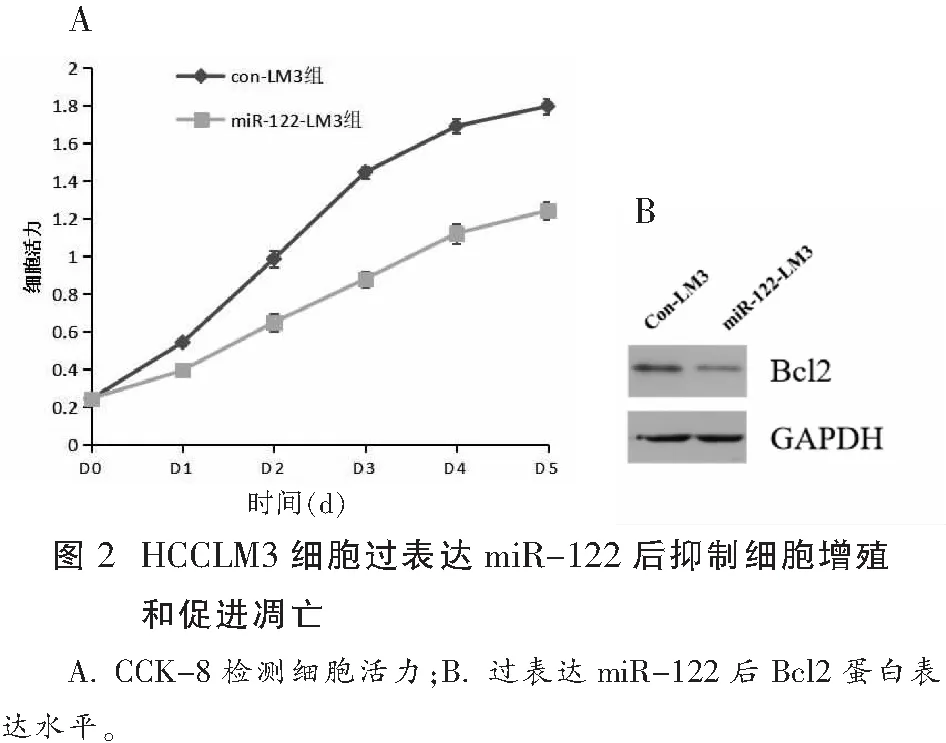
2.2 miRNA-122抑制HCCLM3增殖
与con-LM3组比较,miR-122-LM3组细胞生长明显受到抑制(P<0.05)。并且,我们发现miR-122-LM3组细胞Bcl2蛋白表达明显下调,与con-LM3组细胞相比(P<0.05)。见图2。
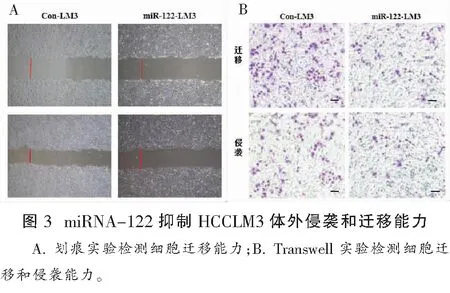
2.3 miRNA-122抑制HCCLM3体外侵袭和迁移能力
划痕实验结果显示,con-LM3组和miR-122-LM3组细胞的24 h迁移率分别是52%和20%,表明过表达miR-122后细胞迁移明显受到抑制,与对照组比较,差异具有统计学意义(P<0.05)。Transwell实验结果显示,miR-122-LM3组平均视野细胞数明显少于对照组,差异具有统计学意义(P<0.05)。 见图3A、图3B和表2。


组别细胞迁移细胞侵袭con-LM3组(n=3)178±12.493±8.52miR-122-LM3组(n=3)31±6.222±5.12
2.4 miRNA-122对HCCLM3细胞耐药性的影响
不同浓度的顺铂作用细胞48 h,miR-122-LM3组细胞对顺铂的敏感性高于con-LM3组(P<0.05),miR-122-LM3组的IC50是(24.12±1.33)μg/L,而con-LM3组细胞的IC50是(52.12±4.96)μg/L。见图4。
3 讨论
微小RNA(microRNA,miRNA)是一类长度约21~22个核苷酸序列的单链非编码小RNA,在肝脏中表达丰富,其通过调控特定的靶基因表达在新陈代谢、发育、凋亡、分化、病毒感染及肿瘤发生等过程中发挥重要作用[14]。研究[15]表明,miRNAs表达水平的变化可能是肝炎、肝癌发生的关键机制。其中miRNA-122是正常肝组织特异性高表达的miRNA,而在肝癌细胞中的表达显著下调[16]。并且,miRNA-122调控调节胆固醇代谢和促进肝细胞的终末分化,它的缺失损伤正常的肝功能,促进肝癌患者的发病和死亡[17-18]。此外,miR-122的表达水平与 HCC 患者的预后也密切相关,表达下调能够促进肿瘤转移和进展[19]。miR-122表达受抑制是HCC的特征,表现为侵袭能力增强、肿瘤复发和患者生存时间减少,因此miR-122 表达缺失可诱发肝癌细胞获得侵袭表型。
常用的基因转染方法(如病毒、脂质体等)不适用于体内基因转染。病毒介导的基因转染具有潜在的副作用,而脂质体介导的基因转染在体内的效率极低。目前,已有大量研究[20-23]认为UTMD能有效介导基因转染,具有安全、实用、靶向性强等优点,成为基因治疗的主要发展趋势之一。UTMD产生的空化效应是UTMD与脂质体结合介导基因转染的主要机制,也是提高脂质体转染效率的主要原因。并且,新型超声微泡造影剂的出现进一步提高了空化效应和在体外裸DNA转染基因的表达[24-25]。本研究通过联合UTMD技术和脂质体转染miRNA-122至HCCLM3细胞使其miRNA-122表达上调,通过RT-qPCR鉴定发现转染后的HCCLM3细胞可以稳定表达miRNA-122。此外,本研究结果显示,与其他方法比较UTMD技术结合常规脂质体转染方法可以增强转染效率。这与Wang等[26]联合UTMD和脂质体介导乳腺癌细胞增敲减强异黏蛋白(MTDH)表达效率的结果一致,这将为体内基因治疗奠定基础。
与此同时,本研究结果揭示过表达miRNA-122可以抑制HCCLM3细胞的增殖、侵袭能力,过表达miR-122后抗凋亡蛋白Bcl2表达下调。Bcl-2是能够阻止细胞色素c从线粒体释放到细胞质,从而抑制细胞凋亡的抗凋亡因子[27]。此外,顺铂是目前临床上频繁使用的一种具有广谱作用的抗肿瘤药物,但对 HepG2 细胞作用过程中存在的耐药性[28]。Wang等[29]的研究揭示miR-122水平可能是肿瘤细胞抗化疗的关键因素,于是本研究探索了miRNA-122是否参与肝癌细胞耐药,结果显示miRNA-122可以增加对顺铂的敏感性。虽然,本研究提示肝miR-122可作为抑制肿瘤发生的促凋亡因子,然而,其具体机制以及miR-122如何被调控表达的研究还需进一步探索。
综上,联合UTMD技术和脂质体成功转染人肝癌HCCLM3细胞过表达miRNA-122,miRNA-122上调后可以明显抑制HCCLM3增殖、迁移和侵袭能力,并且miRNA-122上调后细胞对化疗药物的敏感性增加。本结果有望为肝癌的诊断和基因治疗提供新的治疗靶点和新的思路。
