除草剂不同耐性水平烟草品种叶面微生物研究
2019-02-07朱晓明时焦张保全吴晶晶刘朝营陈强刘洋
朱晓明 时焦 张保全 吴晶晶 刘朝营 陈强 刘洋


摘 要:為探讨玉米田除草剂不同耐性水平烟草品种叶面可培养微生物的数量、耐药性及其与烟草耐药性的关系,以对玉米田除草剂(莠去津和硝磺草酮)高度耐药、中度耐药和高度敏感烟草品种为试验材料,采用稀释平板涂布法测定真菌、细菌和放线菌数量;利用含毒介质法筛选抗除草剂菌株,并对其16S rDNA序列进行测定与分析。结果显示,3种不同耐药性水平品种间叶面可培养真菌、细菌和放线菌总量存在显著差异(p<0.05),群落结构为细菌>放线菌>真菌。细菌和放线菌数量高度耐药性品种>中度耐药性品种>高度敏感性品种;真菌数量高度敏感性品种>中度耐药性品种>高度耐药性品种。从高耐药性烟草品种叶面筛选出5株对2种除草剂具有抗性的菌株,其16S rDNA序列比对均属芽孢杆菌属(Bacillus)细菌。耐药性烟草品种叶面具有大量抗药性菌株可能对烟草耐药性起到了积极作用。
关键词:烟草;叶面微生物;除草剂;耐药性
中图分类号:S435.72 文章编号:1007-5119(2019)06-0060-06 DOI:10.13496/j.issn.1007-5119.2019.06.009
Study on Foliar Microbes of Tobacco Varieties with Different Tolerant Levels to Herbicides
ZHU Xiaoming1, SHI Jiao1*, ZHANG Baoquan2, WU Jingjing2, LIU Chaoying2, CHEN Qiang2, LIU Yang3
(1. Tobacco Research Institute of Chinese Academy of Agricultural Sciences, Qingdao 266101, China; 2. China Tobacco Zhejiang Industrial Co., Ltd, Hangzhou 310009, China; 3. Linqu Branch of Shandong Tobacco Corporation, Linqu, Shandong 262600, China)
Abstract:In order to investigate the quantity and herbicide tolerance of cultivatable microbes on leaves of tobacco varieties which have different tolerant levels to corn herbicides (atrazine and mesotrione), 12 tobacco varieties with different tolerant levels to two corn herbicides were cultivated and used as experimental materials. The leaf samples from the main growing stages including seedling stage, fast-growing stage and maturity stage were collected. The second leaf from the top was used for all the treatments. The plate counting method was used to study the number of cultured fungi, bacteria and actinomycetes. The toxic medium method was used to screen resistant bacterial strains to two corn herbicides. The 16S rDNA of obtained resistant bacterial strains in this experiment were sequenced and analyzed. The experimental results showed that the total numbers of cultured microbes including fungi, bacteria and actinomycetes were significantly different among different tolerant levels of tobacco (p<0.05). The microbial community composition on the leaves of tobacco varieties with different tolerant levels indicated that bacteria > actinomycetes > fungi. The numbers of bacteria and actinomycetes in the order from high to low was highly tolerant varieties, moderately tolerant varieties and highly sensitive varieties. The numbers of fungi from high to low: highly sensitive varieties > moderately tolerant varieties > highly tolerant varieties. Five bacterial strains highly resistant to the two corn herbicides were identified from the dominant bacteria strains isolated from highly tolerant varieties. The 16S rDNA sequences of the five highly resistant strains were compared and analyzed. The analysis results showed that the five strains all belong to Bacillusbacteria. There were large numbers of resistant microbes on tobacco varieties highly tolerant to the two corn herbicides. Therefore it is possible that resistant microbes play an important role in tobacco tolerance to herbicides.
Keywords: tobacco; foliar microbes; herbicide; tolerance
研究表明,植物叶面微生物群落组成复杂,不仅存在能引起植物病害的微生物,还存在许多对植物有益的微生物,它们有的能促进植物生长,有的能增强植物抗性,还有的能降解环境中的污染物[1-3]。近年来应用微生物降解环境中农药的研究空前活跃[4-6],并在降解拟除虫菊酯类、二苯醚类和有机磷类农药方面取得了较好的进展[7-9]。目前,微生物防治作物药害的研究主要集中在应用微生物降解土壤中的残留农药[10-12],以減轻其对后茬作物的药害,而应用微生物保护作物叶片免受外来农药的为害尚未见报道。北方旱作烟区,小麦收获后短时间集中播种夏玉米,夏玉米播种后普遍喷施除草剂,有些除草剂漂移会引起邻作烟田发生药害[13],这一问题已成为阻碍烟草生产的新问题[14]。叶面微生物作为烟叶与外界环境的重要介导,可能在缓解烟草除草剂漂移药害这一过程中发挥作用。
先前的研究发现莠去津和硝磺草酮是对烟草比较安全的2种玉米田常用除草剂[13],同时发现不同烟草种质对玉米田除草剂的耐药性不同[15],在此基础上,本试验选择了12个对莠去津和硝磺草酮不同耐性水平的烟草品种作为供试材料,首先探明不同耐药性水平烟草品种叶面微生物差异,同时对分离到的细菌优势菌株进行抗除草剂筛选,并对筛选出的抗除草剂菌株进行16S rDNA分析与鉴定,以期为应用微生物缓解玉米田除草剂漂移对烟草的药害提供理论支持和技术探索。
1 材料与方法
1.1 试验设计
2018年2月在中国农业科学院烟草研究所的隔离温室中,将3种耐性水平烟草品种[15](高度耐药性品种:Beihart1000-1、Coker371-gold、Coker176、南江三号;中度耐药性品种:红花大金元、革新三号、小黄金1025、NC55;高度敏感性品种:中烟100、云烟87、云烟85、NC89)按照常规育苗方法育苗。所用烟草品种种子均由国家烟草种质资源中期库提供。育苗用具和土壤均严格消毒,烟苗于3~4片真叶期假植,待长至5~6片真叶时移栽至花盆中,并置于温室中培养,每个品种种植40盆。
分别于烟草苗期(第7片真叶期)、旺长期(移栽后35 d)和成熟期(移栽后70 d)取烟叶样品,每次每个品种取8株烟,苗期和旺长期取样叶位为顶部向下数第2片新展开叶片,成熟期取样叶位为顶部向下数第2片叶片,采集后烟叶装纸袋中,并编号。取样时佩戴手套以免污染,样品及时带回实验室保存。为减少雨水和日照对微生物的影响,均选择前2 d未下雨的上午取样。
试验用除草剂38%莠去津SC为江苏绿利来股份有限公司生产,15%硝磺草酮SC为中山化工有限公司生产。
1.2 微生物数量测定
采用稀释平板涂布法分离培养微生物:孟加拉红培养基分离真菌,牛肉膏蛋白胨琼脂培养基分离细菌,改良高氏一号培养基分离放线菌[16]。
叶面微生物悬浮液的制备:将样品表面的杂物用灼烧灭菌的镊子去掉,避免用手接触样品表面。用直径1.5 cm灭菌打孔器取叶圆片,每叶取5片,共取40片。将40片叶圆片放入灭菌三角瓶中,根据40片叶圆片的面积,加入无菌水,无菌水的体积(mL)为叶面积(cm2)的一半。将三角瓶置于200 r/min的振荡器上振荡30 min,然后用无菌水稀释悬浮液,依次按10倍梯度将原液稀释至10-1、10-2、10-3、10-4倍。
叶面微生物接种与培养:吸取100 μL不同浓度的叶面微生物悬浮液接种到培养皿中,每种菌分别接种2个浓度的叶面微生物悬浮液,其中真菌为1×10-1和1×10-2,细菌为1×10-2和1×10-3,放线菌为1×10-3和1×10-4,每个浓度重复3次。接种后用无菌玻璃棒涂布均匀,置于恒温培养箱中培养。真菌于28 ℃培养3~4 d计数,细菌于37 ℃培养2~3 d计数,放线菌于28 ℃培养5~7 d计数[16]。用下列公式计算微生物数量。
微生物数量(cfu/cm2)[17]=![]()
1.3 抗除草剂细菌的筛选
采用含毒介质法筛选抗除草剂细菌:首先用0.22 μm的细菌过滤器过滤除草剂,然后配制Ⅰ、Ⅱ、Ⅲ 3个除草剂浓度的培养基,即在灭菌的250 mL LB培养基中分别加入1 mL (Ⅰ)、0.5 mL (Ⅱ)和0.25 mL (Ⅲ)灭菌的除草剂,混匀、制板备用,并以加入1 mL无菌水的LB培养基为对照,每种除草剂单独使用。将待筛选菌株接种于装有NB液体培养基的三角瓶中,摇瓶容量250 mL,装液量50 mL,于200 r/min、28 ℃下振荡培养12 h,使用分光光度计测定各菌悬液OD值,并将各菌悬液OD值调至0.1,再按十倍稀释法将浓度稀释至103cfu/mL,吸取各菌悬液100 μL分别接种到Ⅰ、Ⅱ、Ⅲ 3种LB平板上,采用平板涂布法涂匀。然后置于37 ℃培养箱中培养24 h,观察并记录菌株生长情况。根据各菌株在Ⅰ、Ⅱ、Ⅲ 3个除草剂浓度平板上细菌菌落总数与对照的比值i将参试细菌菌株划分为高度敏感、中度抗药和高度抗药3种,i≤0.25的菌株为高度敏感,0.25<i≤0.75的菌株为中度抗药,i>0.75的菌株为高度抗药。
1.4 抗除草剂细菌的鉴定
采用细菌基因组DNA提取试剂盒(全式金),提取筛选获得的5株抗除草剂菌株的DNA,以提取的DNA为模板,利用PCR对16S rDNA序列进行扩增,PCR选用细菌通用引物27F:5'-AGAGTTTGATCCTGGCTCAG-3' 和1492R:5'-GGTTACCTTGTTACGACTT-3'。PCR反应体系总体积50 μL,包括引物27F /1492R各1 μL,模板4 μL,25 μL dNTPs Mix,ddH2O 19 μL。PCR反应程序:94 ℃ 3 min;94 ℃ 45 s,54 ℃ 45 s,72 ℃ 1.5 min,35個循环;72 ℃ 10 min。扩增产物经1.0%琼脂糖凝胶电泳检测后,由上海派森诺生物科技有限公司测序。双向测通拼接后,在NCBI网站上进行BLAST相似序列检索,选取相似性较高菌株的模式菌株为参比对象,采用MEGA 6.0软件最大似然法构建系统发育树。用Bootstrap(自展值1000)进行检验。
1.5 统计分析
利用DPS 3.01统计分析软件,采用Duncan新复极差法进行试验数据的差异显著性分析。
2 结 果
2.1 不同耐药性品种叶面可培养微生物数量
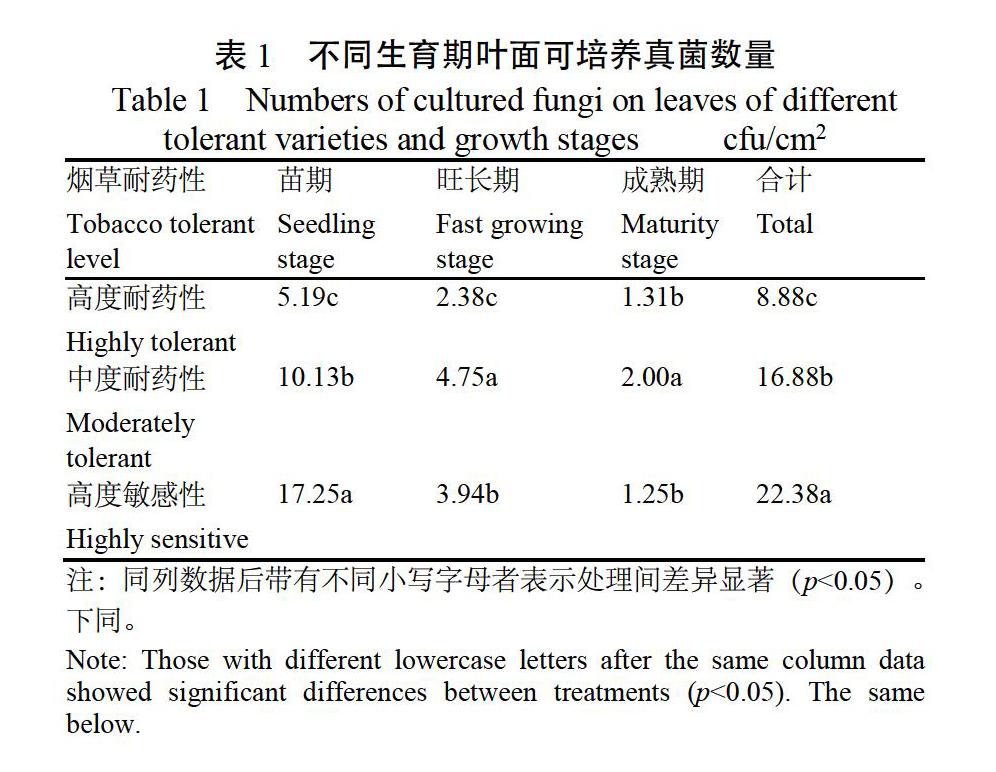
2.1.1 不同生育期叶面可培养真菌数量 表1数据表明,3种不同耐药性水平烟草品种叶面可培养真菌总量存在显著差异(p<0.05),高度敏感性品种总量最多为22.38 cfu/cm2,其次是中度耐药性品种为16.88 cfu/cm2,高度耐药性品种最少为8.88 cfu/cm2。高度耐药性品种苗期和旺长期分别为5.19 cfu/cm2和2.38 cfu/cm2,均显著低于中度耐药性和高度敏感性品种,成熟期显著低于中度耐药性品种。3种耐药性水平品种真菌数量从苗期到旺长期再到成熟期均呈递减趋势,其中,高度耐药性品种降幅较小。
2.1.2 不同生育期叶面可培养细菌数量 表2数据表明,不同耐药性水平烟草品种叶面可培养细菌总量存在显著差异(p<0.05),高度耐药性品种总量最多为1137.50 cfu/cm2,其次是中度耐药性品种为1132.50 cfu/cm2,高度敏感性品种最少为1126.08 cfu/cm2。高度耐药性品种苗期为20.00 cfu/cm2,显著低于中度耐药性和高度敏感性品种;旺长期和成熟期均位于中度耐药性和高度敏感性品种之间,分别为571.88和545.63 cfu/cm2。中度耐药性品种苗期为21.88 cfu/cm2,显著高于高度耐药性和敏感性
品种;旺长期中度耐药性品种是3个抗性水平品种中最高的为591.88 cfu/cm2。
高度、中度耐药性品种细菌数量从苗期到旺长期再到成熟期呈现先增加后减少的趋势,而高度敏感性品种呈现持续增加趋势。在实际生产中,邻作夏玉米田播种后出苗前喷施除草剂时,多数烟田正处在旺长期,本试验中,高度、中度耐药性品种的细菌数量在旺长期达到顶峰,且显著高于高度敏感性品种,推测细菌数量可能与品种耐药性存在一定关系。
2.1.3 不同生育期叶面可培养放线菌数量 表3数据表明,不同耐药性品种叶面可培养放线菌数量存在显著差异(p<0.05),高度耐药性品种总量最多为18.38 cfu/cm2,其次是中度耐药性品种为15.88 cfu/cm2,高度敏感性品种最少为8.69 cfu/cm2。高度耐药性品种和中度耐药性品种从苗期和旺长期放线菌数量大幅增加,旺长期达到峰值。成熟期3种耐药性品种放线菌数量均呈下降趋势,但高度耐药性品种降幅较小,放线菌数量为7.56 cfu/cm2。推测放线菌数量可能与品种耐药性存在一定关系。
2.2 抗除草剂细菌菌株筛选
参试的18株细菌菌株在含不同浓度莠去津和硝磺草酮培养基上的生长情况划分为3种类型,即高度敏感、中度抗药和高度抗药。其中,4株(GYX1、GYX2、GYX3、GYX13)为高度敏感;9株(GYX4、GYX5、GYX8、GYX9、GYX10、GYX11、GYX12、GYX15、GYX18)为中度抗药;5株(GYX6、GYX7、GYX14、GYX16、GYX17)高度抗药,表现出对2种除草剂的抗性(表4)。
2.3 抗除草剂细菌菌株鉴定
系统发育树分析结果表明(图1),菌株GYX6、GYX7、GYX14、GYX16、GYX17的16S rDNA序列与其对比的芽孢杆菌属同源相似度在100%,这表明筛选出的5株抗除草剂细菌菌株都属于芽孢杆菌属(Bacillus)细菌。其中,GYX6与坚强芽孢杆菌(Bacillus firmus),GYX7与土地芽孢杆菌(Bacillus humi),GYX16与地下芽孢杆菌(Bacillus subterraneus)的16S rDNA序列同源性为100%,且聚为一簇。菌株GYX14和GYX17 16S rDNA序列同源相似度较高,尚不能区分两者是否为同一个种,虽然16S rDNA序列广泛应用于细菌鉴定或构建细菌的系统进化关系,但在亲缘关系很近的分类类群间,会因序列间的相似度太高而难以区别[18-19]。
3 討 论
除草剂不同耐性水平烟草品种不同生育期叶面可培养微生物数量呈现出不同的变化,这与NORMANDER等[20]对大麦的研究结果,以及王海波等[21]对抗感黑胫病菌烟草品种根际微生物的研究结果趋于一致。除草剂不同耐性水平烟草品种叶面三大微生物群落结构为细菌>放线菌>真菌,这一结果与植烟土壤中不同时期和不同土层中细菌>放线菌>真菌的研究结果相似[22]。很可能在微生态环境中三大微生物的群落结构都趋于一致,有待进一步研究。
有些放线菌不仅可以抑制作物病害,而且可以促进作物生长与改善作物品质[23]。因为放线菌具有复杂的次级代谢系统,能产生诸多结构新颖、生物活性显著的代谢产物,通常放线菌数量增加会改善植物微生态环境[24]。本研究发现在对莠去津和硝磺草酮2种玉米田除草剂表现出不同耐性水平的烟草品种中,高度和中度耐药性烟草品种叶面可培养放线菌数量从苗期到旺长期激增,达到峰值,高度耐药性品种成熟期放线菌数量也很高。生产中烟田处在旺长期和开花现蕾期时,恰逢邻作夏玉米田喷施除草剂,因此旺长期放线菌数量达到峰值,可能存在对烟草品种的耐药性水平起到了积极作用的菌株,这有待进一步研究。
另外,旺长期细菌数量显著增多,成为叶面优势微生物。在细菌数量占据优势的旺长期,高度耐药性品种细菌数量(571.88 cfu/cm2)和中度耐药性品种细菌数量(591.88 cfu/cm2)均显著高于高度敏感性品种(518.13 cfu/cm2)(p<0.05),由此推测高度耐药性品种可能存在具有缓解药害作用的优势细菌菌株,能够减轻除草剂漂移引起的烟草药害。因而进一步对高度耐药性品种叶面分离得到的18株优势细菌菌株进行了抗除草剂筛选,结果得到5株细菌在含2种玉米田除草剂的LB培养基上能够正常生长,对2种玉米田除草剂表现出较好的抗性,5株抗除草剂细菌菌株都属于芽孢杆菌属(Bacillus)细菌,说明芽孢杆菌属细菌是抗除草剂烟草品种叶面优势菌种,与张鸽等[25]对四个国家雪茄外包皮烟叶表面细菌分离的结果相似。这对未来探讨利用抗除草剂细菌缓解除草剂漂移对邻田作物造成的药害,以及为烟草乃至作物非侵染性病害的预防奠定了基础。
4 结 论
对2种玉米田除草剂莠去津和硝磺草酮具有不同耐性水平烟草品种,不同生育期叶面可培养微生物数量存在显著差异(p<0.05),群落结构为细菌>放线菌>真菌。高度耐药性烟草品种叶面分离到5株抗药细菌菌株,均属于芽孢杆菌属(Bacillus)细菌,对2种玉米田除草剂表现出较高抗性。这些抗药菌株可能对烟草品种的抗药性起到了积极的作用。
参考文献
[1] KISHORE G K, PANDE S, PODILE A R. Phylloplane bacteria increase seedling emergence, growth and yield of field-grown groundnut[J]. Lett Appl Microbiol, 2005, 40(4): 260-268.
[2] ADRIANA B A, PATRICIA A, ENRIQUE H B. The importance of phylloplane micribial populations in nitrogen cycling in the Chaco semiarid woodland[J]. J Trop Ecol, 2004, 21(1): 103-107.
[3] 田春燕,徐军,董丰收,等. 微生物降解三唑类杀菌剂研究进展[J]. 农药学学报,2016,18(2):141-150.
TIAN C Y, XU J, DONG F S, et al. Research progress on microbial degradation of triazole fungicides[J]. Chinese Journal of Pesticide Science, 2016, 18(2): 141-150.
[4] 潘建刚,呼庆,齐鸿雁,等. 叶际微生物研究进展[J]. 生态学报,2016,31(2):583-592.
PAN J G, HU Q, QI H Y, et al. Advance in the research of phyllospheric microorganism[J]. Acta Ecologica Sinica, 2016, 31(2): 583-592.
[5] 周一明,赵鸿云,刘珊,等. 水体的农药污染及降解途径研究进展[J]. 中国农学通报,2018,34(9):141-145.
ZHOU Y M, ZHAO H Y, LIU S, et al. Research progress of pesticide pollution and degradation pathway in water[J]. Chinese Agricultural Science Bulletin, 2018, 34(9): 141-145.
[6] ZIPPER C, NICKEL K, ANGST W, et al. Complete microbial degradation of both enantiomers of the chiral herbicide mecoprop [(RS)-2-(4-chloro-2-methylphenoxy) propionic acid] in an enantioselective manner by Sphingomonas herbicidovorans sp. nov.[J]. Appl Environ Microbiol, 1996, 62(12): 4318-4322.
[7] 肖盈,陈少华,胡威,等. 微生物降解拟除虫菊酯类农药的最新研究进展[J]. 中国农学通报,2012,28(27):218-224.
XIAO Y, CHEN S H, HU W, et al. New progress and prospect for the microbial degradation of pyrethroid pesticides[J]. Chinese Agricultural Science Bulletin, 2012, 28(27): 218-224.
[8] 赵欢欢,徐军,吴艳兵,等. 微生物降解二苯醚类除草剂的研究进展[J]. 植物保护,2014,40(4):9-13,25.
ZHAO H H, XU J, WU Y B, et al. Progress in microbial degradation of diphenyl ether herbicides[J]. Plant Protection, 2014, 40(4): 9-13, 25.
[9] SHARDENDU K, GARIMA K, SURENDRA N. Microbial degradation of organophosphate pesticides: a review[J]. Pedosphere, 2018, 28(2): 190-208.
[10] 张娜娜,姜博,邢奕,等. 有机磷农药污染土壤的微生物降解研究进展[J]. 土壤,2018,50(4):645-655.
ZHANG N N, JIANG B, XING Y, et al. Microbial degradation of organophosphorus pesticide contaminated soils[J]. Soils, 2018, 50(4): 645-655.
[11] 赵玲,滕应,骆永明. 中国农田土壤农药污染现状和防控对策[J]. 土壤,2017,49(3):417-427.
ZHAO L, TENG Y, LUO Y M. Present pollution status and control strategy of pesticides in agricultural soils in China[J]. Soils, 2017, 49(3): 417-427.
[12] MACRAE I C, ALEXANDER M. Herbicide degradation, microbial degradation of selected herbicides in soil[J]. Journal of Agricultural & Food Chemistry, 1965, 13(1):72-76.
[13] 王钢,时焦,葛川,等. 玉米田除草剂对烤烟的药害作用[J]. 烟草科技,2019,52(1):15-21.
WANG G, SHI J, GE C, et al. Phytotoxicity of herbicide application in corn fields on intercropped flue-cured tobacco[J]. Tobacco Science &Technology, 2019, 52(1): 15-21.
[14] 王钢,时焦. 玉米田除草剂漂移对烟草的影响研究[D]. 北京:中国农业科学院,2018.
WANG G, SHI J. Study on the effects of corn herbicides drift on tobacco[D]. Beijing: Chinese Academy of Agricultural Sciences Dissertation, 2018.
[15] 王鋼,时焦,王昕,等. 不同烟草种质对玉米田除草剂的耐药性鉴定[J]. 中国植保导刊,2018,38(9):68-72.
WANG G, SHI J, WANG X, et al. Tolerance identification of different tobacco germplasm to herbicides in corn field[J]. China Plant Protection, 2018, 38(9): 68-72.
[16] 沈萍. 微生物实验[M]. 4版. 北京:高等教育出版社,2004:15-19.
SHEN P. Microbial experiment[M]. The 4th edition. Beijing: Higher Education Publisher, 2004: 15-19.
[17] 靳小刚,缑继斌,朱建兰. 不同生态条件下葡萄叶部微生物区系分析[J]. 植物保护,2010,36(3):106-109,120.
JIN X G, HOU J B, ZHU J L. Analysis of the adnascent microbial flora of grape leaves under different conditions [J]. Plant Protection, 2010, 36(3): 106-109, 120.
[18] 喻国辉,牛春艳,陈远凤,等. 利用16S rDNA结合gyrA和gyrB基因对生防芽孢杆菌R31的快速鉴定[J]. 中国生物防治,2010,26(2):160-166.
YU G H, NIU C Y, CHEN Y F, et al. Use of 16S rDNA, gyrA and gyrB gene sequence to identify a biocontrol bacillus sp. strain R31[J]. Chinese Journal of Biological Control, 2010, 26(2): 160-166.
[19] CHRISTENSEN H, NORDENTOFT S, OLSEN J E. Phylogenetic relationships of salmonella based on rRNA sequence[J]. International Journal of Systematic Bacteriology, 1998, 48(2): 605-610.
[20] NORMANDER B, PROSSER J I. Bacterial origin and community composition in the barley phytosphere as a function of habitat and pre-sowing conditions[J]. Applied and Environmental Microbiology, 2000, 66(10): 4372-4377.
[21] 王海波,時焦,雒振宁,等. 烟草嫁接苗对黑胫病的抗性鉴定[J]. 植物保护,2018,44(3):168-171.
WANG H B, SHI J, LUO Z N, et al. Resistant identification of tobacco grafted seedlings to black shank[J]. Plant Protection, 2018, 44(3): 168-171.
[22] 吴海勇,田峰,李明德,等. 免耕对湘西烟田土壤微生物和酶活性及烟叶经济性状的影响[J]. 中国烟草科学,2014,35(5):17-22.
WU H Y, TIAN F, LI M D, et al. Effects of no-tillage on soil microbes and enzyme activities and the economical characters of tobacco in Xiangxi of Hunan Province[J]. Chinese Tobacco Science, 2014, 35(5): 17-22.
[23] 李晓雯,王继红,王柯坛. 人参病原拮抗菌的筛选及抑菌活性的鉴定[J]. 东北农业大学学报,2019,47(9):91-95.
LI X W, WANG J H, WANG K T. Screening and identification of an antagonistic strain against phytopathogen and its antipathogenic activity[J]. Journal of Northeast Forestry University, 2019, 47(9): 91-95.
[24] LUO S, CHEN L, CHEN J, et al. Analysis and characterization of cultivable heavy metal-resistant bacterial endophytes isolated from Cd-hyperaccumulator Solanum nigrum L. and their potential use for phytoremediation[J]. Chemosphere, 2011, 85(7): 1130-1138.
[25] 张鸽,梁开朝,辛玉华,等. 四个国家雪茄外包皮烟叶表面细菌分离与活性测定[J]. 中国烟草科学,2018,39(2):82-88.
ZHANG G, LIANG K C, XIN Y H, et al. Isolation and activity determination of surface bacteria in cigar wrapper leaves from four different countries[J]. Chinese Tobacco Science, 2018, 39(2): 82-88.
