外源5-氨基乙酰丙酸对盐胁迫下花椰菜幼苗生理特性的影响
2019-02-07范夕玲杨亚苓任健高颖李爱高英李慧
范夕玲 杨亚苓 任健 高颖 李爱 高英 李慧


摘 要:以花椰菜‘津品70为试验材料,探究150 mmol·L-1 NaCl胁迫下不同濃度外源5-氨基乙酰丙酸(5-ALA)(0,1,10,25,50和100 mg·L-1,分别记作CK2、T1、T2、T3、T4、T5)对花椰菜幼苗生理特性的影响,以正常培养的花椰菜幼苗为CK1,分别测定各处理超氧化物歧化酶(SOD)和过氧化物酶(POD)活性及丙二醛(MDA)、可溶性蛋白和可溶性糖含量。结果表明:在150 mmol·L-1 NaCl胁迫下,T2和T5处理组花椰菜幼苗SOD活性与CK1差异不显著(P>0.05),三者显著高于CK2(盐对照)和其他5-ALA处理组(P<0.05);T1和T2处理组POD活性与CK1差异不显著(P>0.05),三者显著高于CK2和T4、T5处理组(P<0.05);T1、T2和T4处理组可溶性蛋白含量显著高于CK1和CK2(P<0.05);T3处理组可溶性糖含量显著高于CK1、CK2和其他5-ALA处理组(P<0.05);T2和T3处理组MDA含量显著低于CK1和CK2(P<0.05)。隶属函数综合评价表明,150 mmol·L-1 NaCl胁迫下,T2处理组(10 mg·L-1 5-ALA)对缓解花椰菜幼苗盐害效果最佳。
关键词:花椰菜;盐胁迫;5-氨基乙酰丙酸;缓解作用
中图分类号:Q945.78; S635.3 文献标志码:A DOI 编码:10.3969/j.issn.1006-6500.2019.12.001
Abstract: In this paper, cauliflower' Jinpin 70' was used as the experimental material to explore the effects of different concentrations of 5-aminolevulinic acid (5-ALA) (0, 1, 10, 25, 50 and 100 mg·L-1, recording as CK2, T1, T2, T3, T4, T5) on physiological characteristics of cauliflower seedlings under 150 mmol·L-1 NaCl stress, the normal cauliflower seedling was recorded as CK1. The activities of superoxide dismutase (SOD) and peroxidase (POD) and the contents of malondialdehyde (MDA), soluble protein and soluble sugar were measured. The results showed that under 150 mmol·L-1 NaCl stress, the SOD activities of T2 and T5 treatments had no significant difference with CK1(P>0.05), however, the SOD activities of T2, T5 and CK1 were significantly higher than those of CK2 and other 5-ALA treatments(P<0.05); the POD activities of T1 and T2 treatments had no significant difference with CK1(P>0.05), however, the POD activities of T1, T2 and CK1 were significantly higher than those of CK2, T4 and T5 treatments (P<0.05); the soluble protein contents of T1, T2 and T4 treatments were significantly higher than those of CK1 and CK2(P<0.05); the soluble sugar content of T3 treatment was significantly higher than that of CK1, CK2 and other 5-ALA treatments(P<0.05); the MDA contents of T2 and T3 treatments were significantly lower than those of CK1 and CK2(P<0.05). The evaluation by membership function analysis indicated that T2 treatment (10 mg·L-1 5-ALA) had the best effects on alleviating salt stress in cauliflower seedlings under 150 mmol·L-1 NaCl stress.
Key words:cauliflower; salt stress; 5-ALA; mitigation
盐胁迫可引起植物生理干旱,影响生理代谢与营养吸收,阻碍其正常生长,严重影响农作物产量和生态环境[1]。如何提高作物的抗盐性具有十分重要的科学和实践意义。相对于传统育种与分子育种而言,添加外源物质以提高作物抗盐性具有时间短、见效快的优势。5-氨基乙酰丙酸(5-aminolevulinic acid,5-ALA)是所有生物体内卟啉化合物合成的第一个关键前体,参与多种植物体内代谢过程,并对植物的生长发育具有一定的调节作用[2]。有研究表明,5-ALA可以提高作物的抗逆性[3-6],增加作物产量[7],改善作物品质[8]。
植物在正常环境下生长,其体内的活性氧含量相对稳定,处于产生与消除的动态平衡中,但在盐胁迫下活性氧会大量积累,从而破坏植物体细胞膜结构的稳定性。植物体内含有多种重要的抗氧化酶,如超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶(peroxidase,POD)等,抗氧化酶系统协同作用可降低活性氧含量,减轻植物细胞受逆境胁迫的伤害程度[9-10]。丙二醛(malondialdehyde,MDA)是植物体在逆境胁迫下膜脂过氧化的终产物,利用其含量可表示细胞膜脂过氧化程度,反映植物受逆境胁迫压力的大小[11]。盐胁迫会导致植物发生渗透胁迫,水分代谢失调。植物体中可溶性糖和可溶性蛋白可作为渗透调节剂,通过降低细胞水势、增强吸水等功能来提高植物对于盐胁迫的抵抗能力[12-13]。花椰菜(Brassica oleracea L. var. botrytis)为十字花科芸苔属一年生植物,其肉质细嫩,营养价值丰富,具有提高机体免疫力及抗癌等功效。本文以花椰菜为试验材料,研究外源5-ALA对NaCl胁迫下花椰菜幼苗生理特性的影响,探究缓解花椰菜盐害的最佳施用浓度,为明确5-ALA提高花椰菜抗盐性的效果及可能生理机理奠定基础,并为花椰菜在盐碱地的推广种植提供合理的科学依据。
1 材料和方法
1.1 试验材料
供试花椰菜品种为‘津品70,由天津科润蔬菜研究所惠赠。
1.2 试验方法
试验于2017年9—12月在天津农学院园艺中心实验室进行。将健康饱满的花椰菜种子浸种催芽,露白后,选取发芽状态良好的种子播种于配制好的基质(草炭 ∶ 蛭石 ∶ 珍珠岩=2 ∶ 1 ∶ 1)中,浇灌1/2 MS 营养液培养,培养至三叶一心时进行处理。以正常浇灌1/2 MS 营养液的空白对照组记作CK1;浇灌含150 mmol·L-1 NaCl的1/2 MS 营养液的盐对照组记作CK2;同时浇灌含150 mmol·L-1 NaCl和不同浓度5-ALA溶液的1/2 MS 营养液(1,10,25,50和100 mg·L-1)的处理组,分别记作T1、T2、T3、T4和T5。由于5-ALA在光照条件下不稳定,故各处理均于傍晚进行根施处理,每个处理20株幼苗(3组重复)。
盐胁迫处理幼苗10 d后,以不同处理花椰菜幼苗叶片为试验材料,采用SOD抑制氮蓝四唑(NBT)光化還原法测定SOD活性,愈创木酚显色法测定POD活性,硫代巴比妥酸法测定MDA含量[14];考马斯亮蓝法测定可溶性蛋白含量,蒽酮比色法测定可溶性糖含量[15]。
1.3 统计分析
利用SPSS统计软件(17.0版)对数据进行方差分析,并利用Microsoft Excel 2010进行隶属函数计算。
隶属函数值计算公式:
反隶属函数值计算公式:
式中,Xi为某一生理指标测定值,Xmin和Xmax分别为所有处理该指标的最小值和最大值。如果相应生理指标与植物耐盐性正相关则用R(Xi)正进行计算,负相关则用R(Xi)反进行计算,综合隶属函数为试验中所用生理指标隶属函数的平均值,用以评价不同5-ALA处理对盐胁迫下花椰菜幼苗抗性的提高程度。
2 结果与分析
2.1 不同浓度5-ALA对盐胁迫下花椰菜幼苗SOD和POD活性及MDA含量的影响
由表1可知,CK2组花椰菜幼苗的SOD和POD活性比CK1分别显著降低14.00%和48.30%(P<0.05),T1~T5处理组中SOD和POD活性与CK2相比均有不同程度的提高;CK2组花椰菜幼苗的MDA含量比CK1显著提高36.90%(P<0.05),T1~T5处理组MDA含量与CK2相比均显著降低(P<0.05)。当5-ALA浓度为100 mg·L-1(T5)时,SOD活性达到最大值,与10 mg·L-1处理(T2)差异不显著(P>0.05),二者分别比CK2显著提高17.50%和13.28%(P<0.05),但与CK1差异不显著(P>0.05);当5-ALA浓度为1 mg·L-1(T1)时,POD活性达到最大值,与10 mg·L-1处理(T2)差异不显著(P>0.05),二者分别比CK2显著提高138.69%和76.64%(P<0.05),但与CK1差异不显著(P>0.05);当5-ALA浓度为25 mg·L-1(T3)时,MDA含量达到最低值,与10 mg·L-1处理(T2)差异不显著(P>0.05),二者分别比CK2显著降低56.44%和48.38%(P<0.05),比CK1显著降低40.36%和29.32%(P<0.05)。综合说明适宜浓度的外源5-ALA能够提高150 mmol·L-1 NaCl胁迫下花椰菜幼苗SOD和POD活性,减少MDA积累。
2.2 不同浓度5-ALA对盐胁迫下花椰菜幼苗渗透调节物质的影响
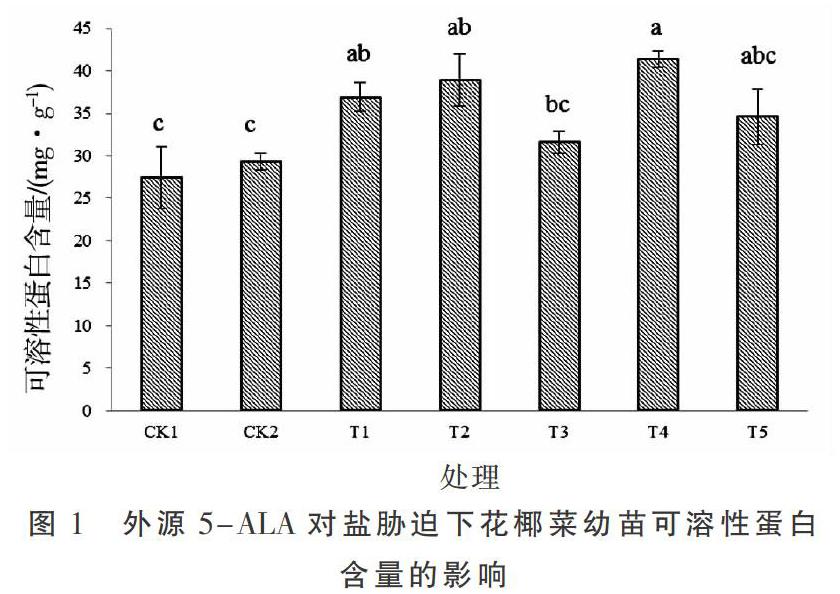
由图1可知,CK2组花椰菜幼苗的可溶性蛋白含量较CK1稍有提高(6.78%),但二者差异不显著(P>0.05);T1~T5处理组可溶性蛋白含量较CK2均有不同程度的提高,其中当5-ALA浓度为50 mg·L-1(T4)时,可溶性蛋白含量达到最大值,与10 mg·L-1(T2)和1 mg·L-1(T1)处理差异不显著(P>0.05),三者分别比CK2显著提高了41.33%,32.82%和25.85%(P<0.05),分别比CK1显著提高了50.91%,41.83%和34.39%(P<0.05)。
由图2可知,CK2组花椰菜幼苗的可溶性糖含量较CK1稍有降低(18.74%),但二者差异不显著(P>0.05);150 mmol·L-1 NaCl胁迫下,随着5-ALA浓度的提高,花椰菜幼苗可溶性糖含量呈先升后降的趋势,当5-ALA浓度为25 mg·L-1(T3)时,可溶性糖含量达到峰值,比CK2显著提高58.69%(P<0.05),比CK1显著提高29.14%(P<0.05),当5-ALA浓度增至100 mg·L-1(T5)时,可溶性糖含量低于CK2,差异不显著(P>0.05),但比CK1显著降低26.72%。综合说明适宜浓度的外源5-ALA能够提高150 mmol·L-1 NaCl胁迫下花椰菜幼苗可溶性蛋白和可溶性糖含量,而高浓度5-ALA不利于可溶性糖含量的积累。
2.3 隶属函数综合评价
利用隶属函数综合分析了150 mmol·L-1 NaCl胁迫下对照和不同处理组的耐盐性,结果见表 2。SOD 活性、POD 活性、可溶性蛋白含量和可溶性糖含量与植物耐盐性呈正相关,隶属函数按R(Xi)正计算;丙二醛含量与植物耐盐性呈负相关,按R(Xi)反计算。综合各生理指标分析,在150 mmol·L-1 NaCl胁迫下,不同浓度的外源5-ALA处理中10 mg·L-1 5-ALA处理(T2)对缓解花椰菜幼苗盐害的效果最佳。
3 结论与讨论
5-ALA具有调节叶绿素的合成、提高光合效率、提高抗氧化酶酶活性、保护细胞膜稳定性、促进植物组织分化等多种生理功能,参与植物生长发育的调节过程,是具有类似植物激素的生理活性调节物质[16-17]。据报道,外源5-ALA处理可使盐胁迫下菘蓝幼苗[18]、小型西瓜幼苗[19]、半夏幼苗[20]、西葫芦[21]、葡萄[22]、枣树[23]等抗氧化酶酶活性提高;使盐胁迫下美国山核桃幼苗[24]、酸枣种子及幼苗[25]、决明子幼苗[26]等丙二醛含量降低。本研究结果显示,150 mmol·L-1NaCl胁迫下,施用5-ALA能提高花椰菜幼苗叶片抗氧化酶(SOD、POD)活性,降低MDA含量,与前人研究结果一致。由此表明,花椰菜抗氧化系統保护机制在5-ALA作用下增强,从而能有效降低细胞膜结构和功能的损伤程度[27]。但外源5-ALA是作为抗氧化剂直接参与了活性氧的清除,还是作为信号因子诱导抗氧化酶基因的表达有待进一步研究。
有研究表明,外源5-ALA可使盐胁迫下黄瓜幼苗[28]、黄连幼苗[29]等可溶性蛋白和可溶性糖含量提高。本研究与前人研究结果一致,在150 mmol·L-1 NaCl胁迫下,施用不同浓度外源5-ALA可提升花椰菜幼苗可溶性蛋白含量,其中T1、T2和T4处理组与盐对照组(CK2)和空白对照组(CK1)均达到了显著水平(P<0.05);花椰菜幼苗可溶性糖含量随着5-ALA浓度的提高呈先升后降的趋势,其中T1~T4处理均高于盐对照组(CK2),以50 mg·L-1外源5-ALA(T3)处理可溶性糖含量最高,显著高于盐对照组(CK2)和空白对照组(CK1)(P<0.05)。由此表明,适宜浓度的外源5-ALA处理可使花椰菜的渗透调节机制得以正常运转,可溶性蛋白和可溶性糖继续积累,以保证植物的水分平衡,增强其抵抗盐胁迫的能力。外源5-ALA处理是否能有效提高盐胁迫下花椰菜幼苗另一重要渗透调节物质-脯氨酸的含量有待于进一步的研究。
综合而言,在150 mmol·L-1NaCl胁迫下,适宜浓度5-ALA能提高盐胁迫下花椰菜幼苗抗氧化酶活性、可溶性蛋白和可溶性糖含量,并显著降低花椰菜幼苗MDA含量。通过隶属函数综合评价,施加10 mg·L-1外源5-ALA对缓解花椰菜幼苗盐害的效果最佳。
参考文献:
[1]黄镇,杨瑞阁,徐爱遐,等.盐胁迫对3大类型油菜种子萌发及幼苗生长的影响[J].西北农林科技大学学报(自然科学版),2010,38(7):49-53.
[2]AKRAM N A, ASHRAF M. Regulation in plant stress tolerance by apotential plant growth regulator, 5-Aminolevulinic acid[J]. Journal of plant growth regulation, 2013, 32(3): 663-679.
[3]BALESTRASSE K B, TOMARO M L, BATLLE A, et al. The role of 5-aminolevulinic acid in the response to cold stress in soybean plants[J]. Phytochemistry, 2010,71(17-18): 2038-2045.
[4]高年春,孙永平,张琼,等.外源5-氨基乙酰丙酸(ALA)对NaCl胁迫下草莓植株光合作用的影响[J].江苏农业学报,2010,26(6):1329-1333.
[5]康琅,程云,汪良驹.5-氨基乙酰丙酸对秋冬季大棚西瓜叶片光合作用及抗氧化酶活性的影响[J].西北植物学报,2006,26(11):2297-2301.
[6]LIU L, NGUYEN N, UEDA A, et al. Effects of 5-aminolevulinic acid on Swiss chard seedling growth under saline conditions[J]. Plant growth regulation, 2014, 74(3):219-228.
[7]HOTTA Y, TANANKA T, TAKAOKA H, et al. Promotive effects of 5-aminolevulinic acid on the yield of several crops[J]. Plant growth reg, 1997, 22: 109-114.
[8]郭磊,蔡志翔,张斌斌,等.5-氨基乙酰丙酸促进桃果皮提前着色机制研究[J].园艺学报,2013,40(6):1043-1050.
[9]赵可夫,卢元芳,张宝泽,等.Ca对小麦幼苗降低盐害效应的研究[J].植物学报,1993,35(1):51-56.
[10]DENG Y M, SHAO Q S, LI C C, et al. Differential responses of double petal and multi petal jasmine to shading: II. Morphology,anatomy and physiology[J]. Scientia horticulturae, 2012, 144(3):19-28.
[11]刘卫琴,康琅,汪良驹.ALA对草莓光合作用的影响及其与抗氧化酶的关系[J].西北植物学报,2006,26(1): 57-62.
[12]於丙军,章文华,刘友良.NaCl对大麦幼苗根系蛋白质和游离氨基酸含量的影响[J].西北植物学报,1997,17(4):439-445.
[13]杜长霞,李娟,郭世荣,等.外源亚精胺对盐胁迫下黄瓜幼苗生长和可溶性蛋白表达的影响[J].西北植物学报,2007,27(6):1179-1184.
[14]苍晶,赵会杰.植物生理学实验教程[M].北京:高等教育出版社,2013:145-151.
[15]赵世杰.植物生理学实验指导[M].北京:中国农业科学技术出版社,2002:84-85,98-99.
[16]孟长军,邹志荣.外源ALA对樱桃番茄幼苗盐伤害的缓解效应[J] .江苏农业学报,2011,27(2) : 378-381.
[17]柳翠霞,罗庆熙,李跃建,等.外源5-氨基乙酰丙酸(ALA)对弱光下黄瓜生长指标及抗氧化酶活性的影响[J].中国蔬菜,2011(16) : 72-78.
[18]吕婷婷,肖云华,吴群,等.外源5-氨基乙酰丙酸对盐胁迫下菘蓝种子萌发及幼苗抗氧化酶活性的影响[J].西北植物学报,2013,33(10): 2037-2042.
[19]陈罡,管安琴,万云龙,等.外源5-氨基乙酰丙酸(ALA)对盐胁迫下小型西瓜幼苗抗氧化酶活性的影响[J] .江苏农业科学,2016,44(6):252-255.
[20]梁琴,谢英赞,王朝英,等.外源ALA对半夏幼苗耐盐性及其总生物碱含量的影响[J].广东农业科学,2013,40(15): 31-35.
[21]童金珠.外源ALA处理对NaCl胁迫下西葫芦植株的缓解效应[D].杨凌:西北农林科技大学,2009.
[22]刘鹏.ALA对葡萄盐胁迫缓解效应的研究[D].石河子:石河子大学,2014.
[23]李汉钊.外源ALA对NaCl胁迫下枣树生理特性影响的研究[D].石河子:石河子大學,2017.
[24]生静雅,张普娟,朱海军,等.外施ALA对盐胁迫下薄壳山核桃幼苗的生长发育的影响[J].扬州大学学报(农业与生命科学版),2014,35(3):90-94.
[25]李芳芳.外源5-氨基乙酰丙酸对酸枣种子及幼苗NaCl胁迫缓解效应的研究[D].石河子:石河子大学,2017.
[26]谢英赞,何平,韦品祥,等.外源5-氨基乙酰丙酸对盐胁迫下决明幼苗生理特性的影响[J]. 广西植物,2013,33(1): 102-106.
[27]ZHANG Z P, MIAO M M, WANG C L. Effects of ALA on photosynthesis, antioxidant enzyme activity, and gene expression,and regulation of proline accumulation in tomato seedlings under NaCl stress[J]. Journal of plant growth regulation, 2015, 34(3):637-650.
[28]燕飞.外源5-氨基乙酰丙酸(ALA)对盐胁迫下黄瓜幼苗生理调控效应研究[D].杨凌:西北农林科技大学,2014.
[29]张春平,何平,胡世俊,等.外源5-氨基乙酰丙酸对盐胁迫下黄连种子萌发及幼苗生理特性的影响[J].中草药,2014,45(24):3618-3626.
