不同小麦品种穗发芽特性的鉴定及TaRHA2b基因序列差异分析
2019-01-29李冬兵吕桂珍杜红旭牛洪斌
李冬兵,左 宁,吕桂珍,杜红旭,牛洪斌,尹 钧
(1.河南农业大学/河南粮食作物协同创新中心/小麦玉米作物学国家重点实验室/国家小麦工程技术研究中心,河南 郑州 450002; 2.华南师范大学 生命科学学院/广东省高校生态学与环境科学重点实验室,广东 广州 510631)
小麦是世界上重要的粮食作物之一,提高其产量有助于保障全球粮食安全。小麦穗发芽是影响小麦生产的一种世界性重要灾害,不仅降低产量而且严重劣化品质(尤其是加工品质) 和种用价值[1]。种子休眠水平是影响小麦穗发芽抗性的一个主要遗传因素,种子的休眠和破眠机制已经研究得非常清楚。目前,已在小麦的2B、2D、3A、3B、3D、4A、4B、5A、6B、7D等染色体上发现了与小麦穗发芽抗性相关的各种类型的分子标记、QTL位点和基因[2],这些研究使得分子育种成为降低穗发芽的一种有效方法。
BU等[3]研究发现,RING finger型E3连接酶RHA2a在脱落酸(ABA)介导的种子萌发和萌发后早期生长阶段中发挥正调控作用,过表达RHA2a基因的转基因拟南芥种子对ABA的敏感性显著上升,种子休眠性增强,萌发速率显著降低,RHA2a通过泛素化正调控ABA信号途径中的一些关键调控因子。与RHA2a 互作的蛋白包括2个高度相关的NAC家族蛋白ANAC019 和 ANAC055[4]。RHA2b与RHA2a同源性极高,功能也较为相似,同样参与了ABA的信号转导途径。RHA2a和RHA2b在ABA的信号转导途径中具有累加效应。过表达RHA2a和RHA2b的拟南芥种子对外源ABA更敏感,有更强的休眠性和更低的发芽率[3,5]。
教育部“长江学者和创新团队发展计划”创新团队中尹钧教授领衔的小麦生长发育分子调控研究团队前期采用RT-PCR及RACE扩增,首次从小麦和萝卜中分别克隆获得TaRHA2b和RsRHA2b基因,基因登录号分别为JN661690.1和KR349970.1,并且已经获得了转RsRHA2b基因小麦,转基因株系的休眠性和抗穗发芽能力显著提高,RsRHA2b基因介导的转基因小麦抗穗发芽机制研究也已有初步进展(相关文章尚未发表)。RsRHA2b和TaRHA2b的基因结构分析显示,这2个基因编码的蛋白质均含有长度为49个氨基酸残基的基序(RING-H2基序),其保守序列为CX2CX14~15CXHX2HX2CX3WX6~8CPXC,属于RING finger型E3连接酶[6]。RING finger 蛋白具有富含半胱氨酸及组氨酸的功能域。根据Zn2+结合残基Cys和His的数量和位置不同,RING finger家族又可分为 RING-HC、RING-H2、RING-v、RING-C2、RING-D、RING-S/T、RING-G、RING-mH2和 RING-mHC 9大亚类[5]。RING finger蛋白参与蛋白质与蛋白质的互作及蛋白质复合体的形成[7]。拟南芥中至少有477种RING finger蛋白,在其发育进程中起到了关键性的作用[8]。目前,关于TaRHA2b基因的研究还很有限,利用TaRHA2b基因开发新的抗穗发芽分子标记的研究尚未见报道。为此,选取前期研究获得的50个发芽指数有显著差异的小麦品种种子进行穗发芽特性分析,并对其TaRHA2b基因进行克隆和测序,揭示发芽指数高、低小麦品种TaRHA2b基因的序列差异,并进一步探索不同品种该基因的酶切位点差异,以期为进一步开展小麦抗穗发芽分子改良和应用提供理论依据。
1 材料和方法
1.1 试验材料
尹钧教授课题组前期已对200多个小麦品种进行了穗发芽特性鉴定(预试验),从中选择发芽指数有显著差异的50个小麦品种作为本研究的试验材料,进行穗发芽特性鉴定的正式试验。其中,发芽指数高的品种包括郑99379、鑫农518、西农167、濮兴8号、中育01089、郑0943、周40、洛28、众麦166、许科718、淮麦304、濮02056、中育1152、烟农19、周99343、西农132、西农3号、豫麦56、豫农416、川麦32、绵阳35号、科农605、郑麦9023、白硬冬3号、新麦19等25个品种,发芽指数低的品种包括济麦32、中麦247、平安8号、中国春、郑09596、郑麦366、糯麦、淮麦0360、绵资02-12、CAO175、济南17、油麦、漯麦4-168、周麦24、郑05706、中麦895、未来0818、汶农14、泛麦13、皖科636、郑09303、许农186、永川白麦子、郑育麦16、周33等25个品种。供试小麦材料分别于2015年和2016年进行穗发芽特性鉴定。
1.2 小麦穗发芽特性的鉴定
在生理成熟期收获小麦穗,分别对穗上的籽粒进行手动脱粒,保持籽粒的休眠性。每个品种分别取约200粒种子,腹沟朝下置于放有湿润滤纸的培养皿中,于20 ℃、黑暗条件下发芽,第4天记录不同发芽等级(0:未发芽,1:露白,2:芽长为种子长1/2,3:芽长与种子等长,4:芽长长于种子)种子的萌发数,计算萌发率。连续2 a对刚收获的种子进行上述操作。
1.3 不同小麦品种TaRHA2b基因的序列分析
采用CHEN等[9]改进的CTAB 法提取小麦幼苗叶片基因组总 DNA。以供试材料基因组DNA为模板,利用引物TaRHA2b-F(5′-CGCCATGGCCCATCTCAAATCCACTTATT-3′)和TaRHA2b-R(5′-CGAGATCTAGCTATTTGGAGAAGTTAAAATTTG-3′)扩增TaRHA2b基因。PCR扩增反应体系如下:基因组DNA 1.5 μL,2×TaqPCR Master Mix 10 μL,10 μmol/L的上、下游引物各0.5 μL,补充蒸馏水至总体积20 μL。PCR扩增程序为:95 ℃ 3 min;95 ℃ 30 s、50 ℃ 30 s、72 ℃ 1 min ,36个循环; 72 ℃ 10 min。在1.0%的琼脂糖凝胶电泳上检测PCR扩增产物,并用琼脂糖凝胶回收试剂盒回收,然后送华大基因有限公司测序。
1.4 生物信息学分析
利用DNAMAN软件进行序列比对和查找序列酶切位点。
2 结果与分析
2.1 不同小麦品种的穗发芽特性
对2015年和2016年收获的50个小麦品种的穗发芽特性进行鉴定(表1)发现, 25个高发芽指数品种第1年的总发芽率介于43.18%~100.00%,其中,郑99379、西农167、濮兴8号、中育01089、郑0943、周40的总发芽率均高达100.00%,新麦19的总发芽率最低,为43.18%;第2年的总发芽率介于45.66%~99.66%,其中,郑99379的总发芽率最高,为99.66%,新麦19的总发芽率最低,为45.66%;2 a平均发芽率介于44.42%~99.83%。25个低发芽指数品种第1 年的总发芽率介于0~7.23%,其中,济麦32的总发芽率最高,为7.23%,中麦247的总发芽率为5.88%,平安8号的总发芽率为6.18%,中国春的总发芽率为0.31%,其他品种的总发芽率均为0;第2年的总发芽率介于0~6.25%,济麦32的总发芽率最高,为6.25%,中麦247的总发芽率为4.76%,中国春的总发芽率为1.11%,郑09596的总发芽率为0.71%,其他品种的总发芽率均为0;2 a平均发芽率介于0~6.74%。综上所述,所选的25个高发芽指数品种与25个低发芽指数品种在穗发芽特性方面差异明显,可以用于后续试验。
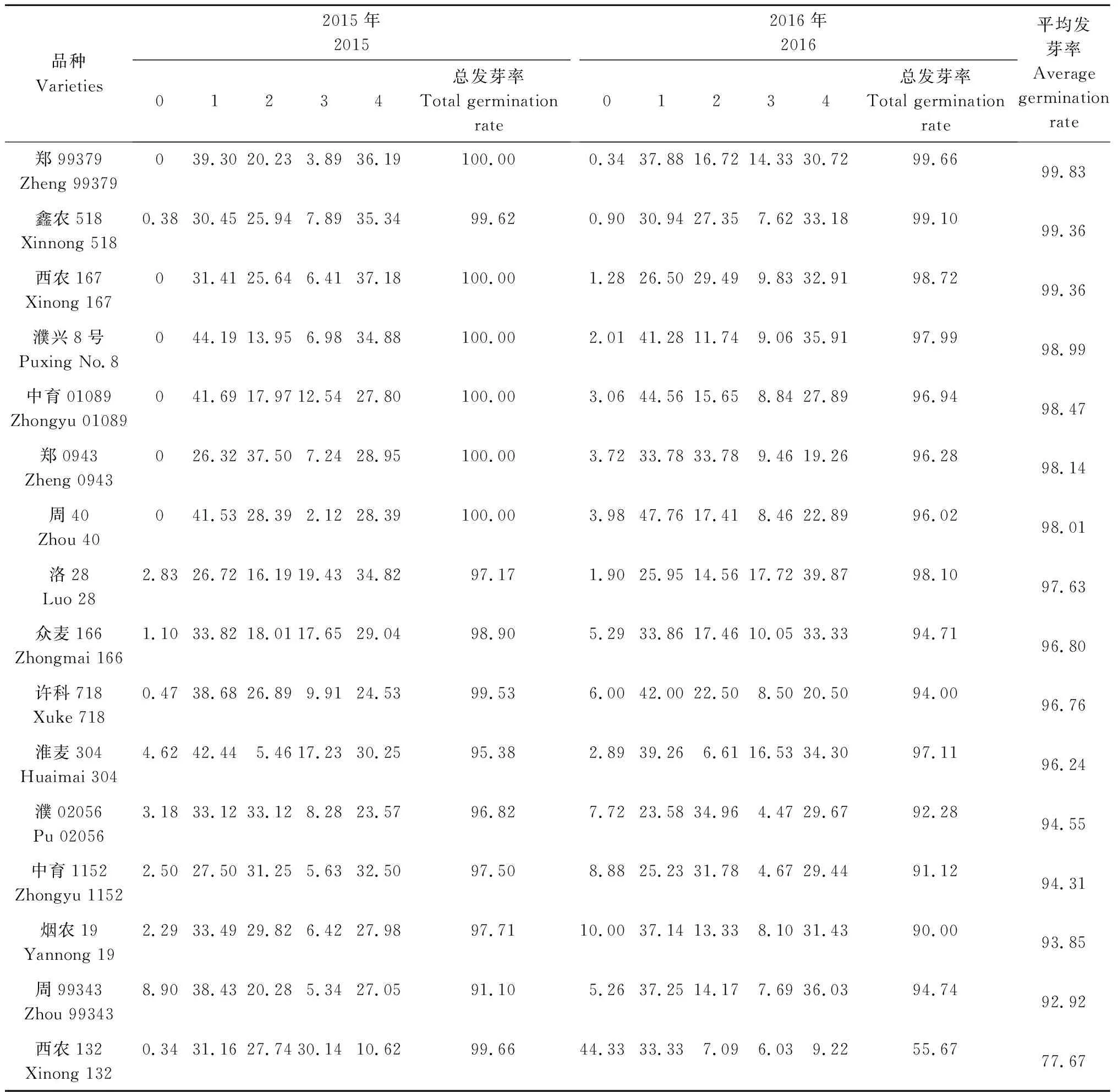
表1 不同小麦品种的穗发芽率Tab.1 Spike germination rate of different wheat varieties %
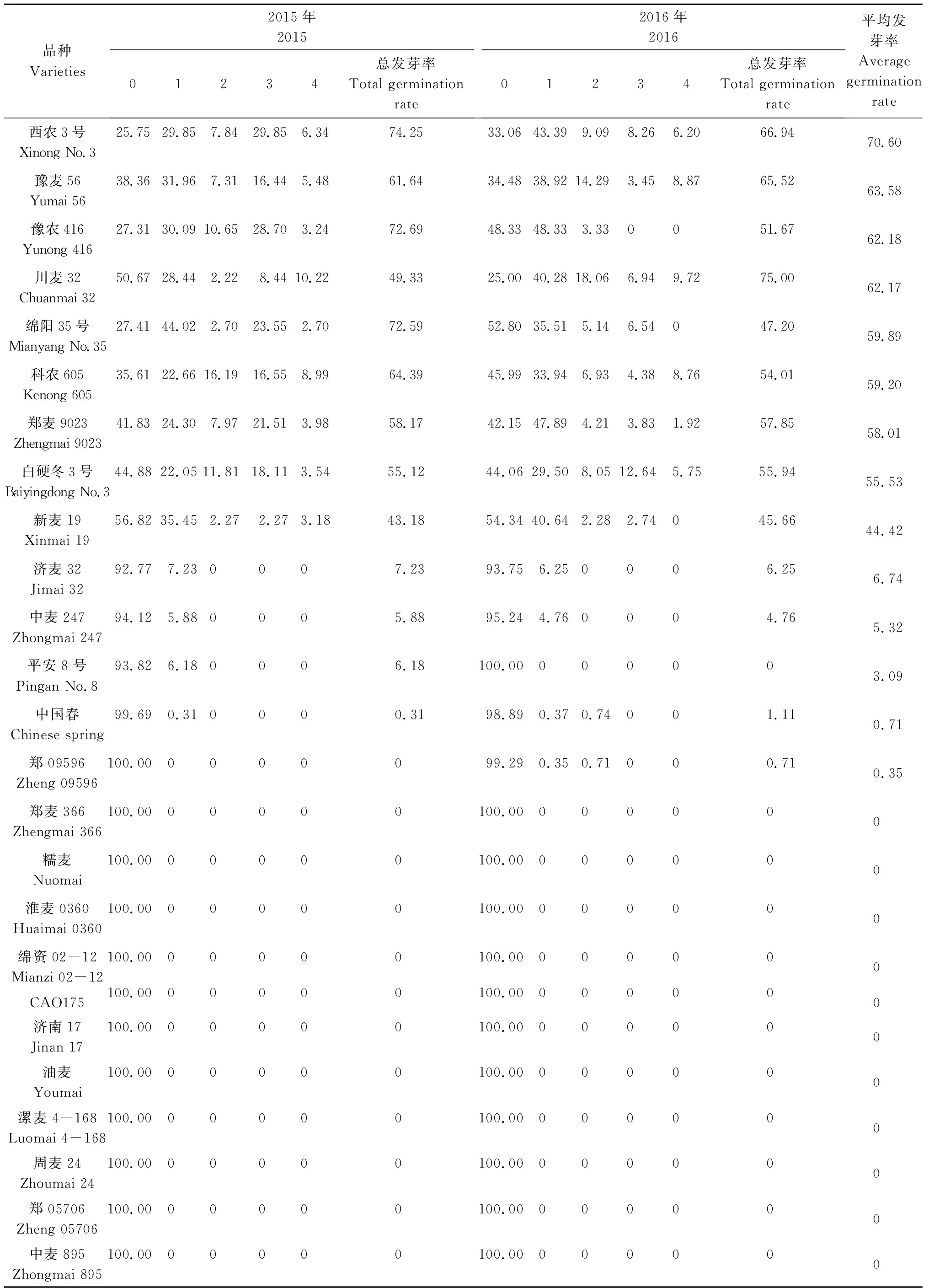
续表1 不同小麦品种的穗发芽率Tab.1 (Continued)Spike germination rate of different wheat varieties %
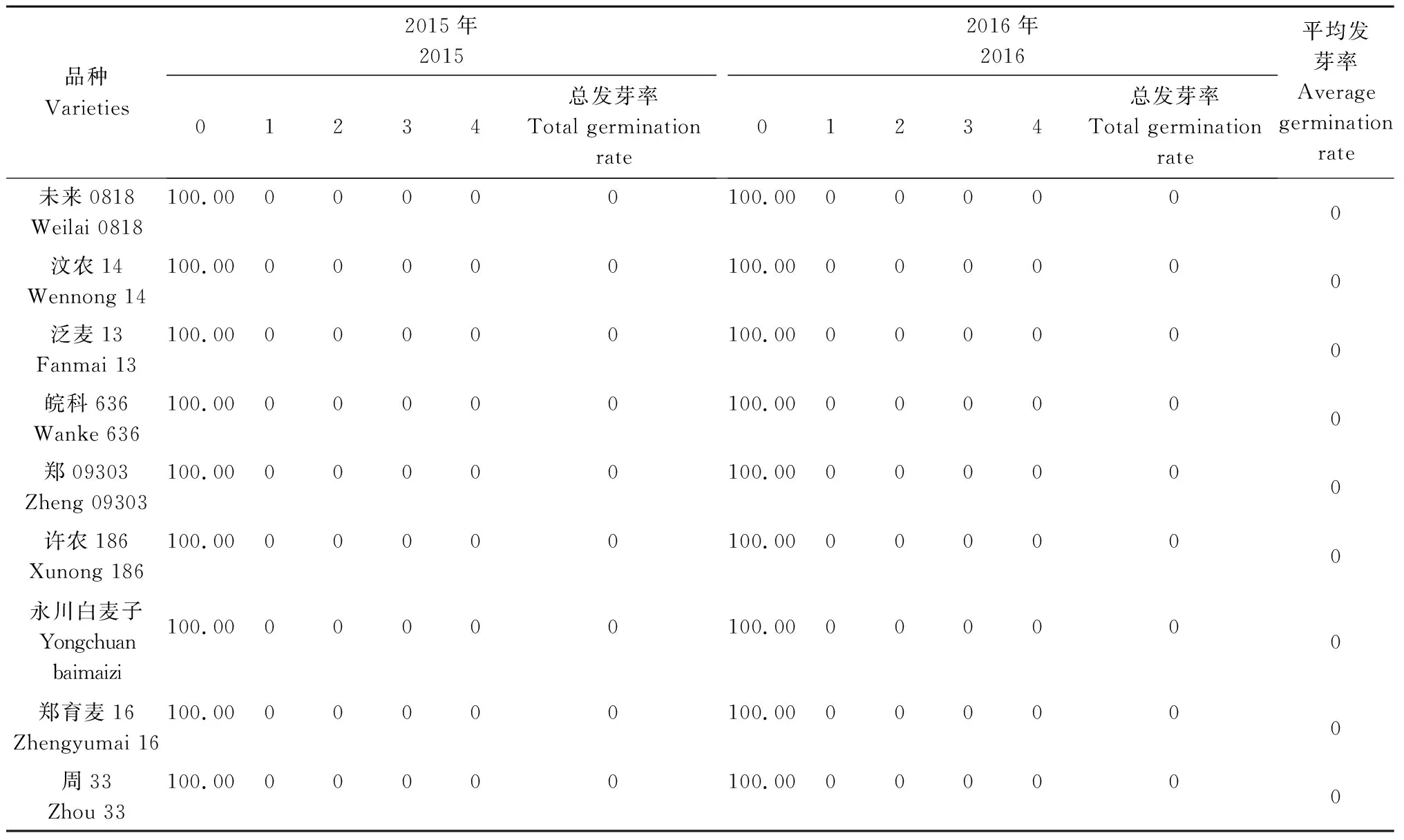
续表1 不同小麦品种的穗发芽率Tab.1 (Continued)Spike germination rate of different wheat varieties %
2.2 不同小麦品种TaRHA2b基因的序列差异分析
对50个穗发芽指数有明显差异的小麦品种的TaRHA2b基因进行PCR扩增(图1)发现,各引物扩增片段大小与预期结果一致,约为825 bp。对50 个小麦品种TaRHA2b基因的PCR扩增产物进行测序,然后对序列进行分析发现,50个小麦品种中扩增得到的高发芽指数品种TaRHA2b基因序列与低发芽指数品种的一致性为99.16%,高发芽指数品种与低发芽指数品种TaRHA2b基因序列的第47、124、373、645、767、777位碱基存在差异,主要为碱基替换、缺失(图2—7)。对高、低发芽指数品种TaRHA2b基因序列进行酶切位点分析发现,高发芽指数品种酶切位点的总数为55个,低发芽指数品种酶切位点的总数为50个。对高、低发芽指数品种TaRHA2b基因差异序列进行酶切位点分析(表2)发现,高、低发芽指数品种TaRHA2b基因第47位碱基的差异(T—C),造成EcoICRⅠ/Ecl136Ⅱ和SacⅠ/SstⅠ特异性酶切位点的产生,这2个酶切位点可以用来鉴定其他小麦品种的穗发芽特性。
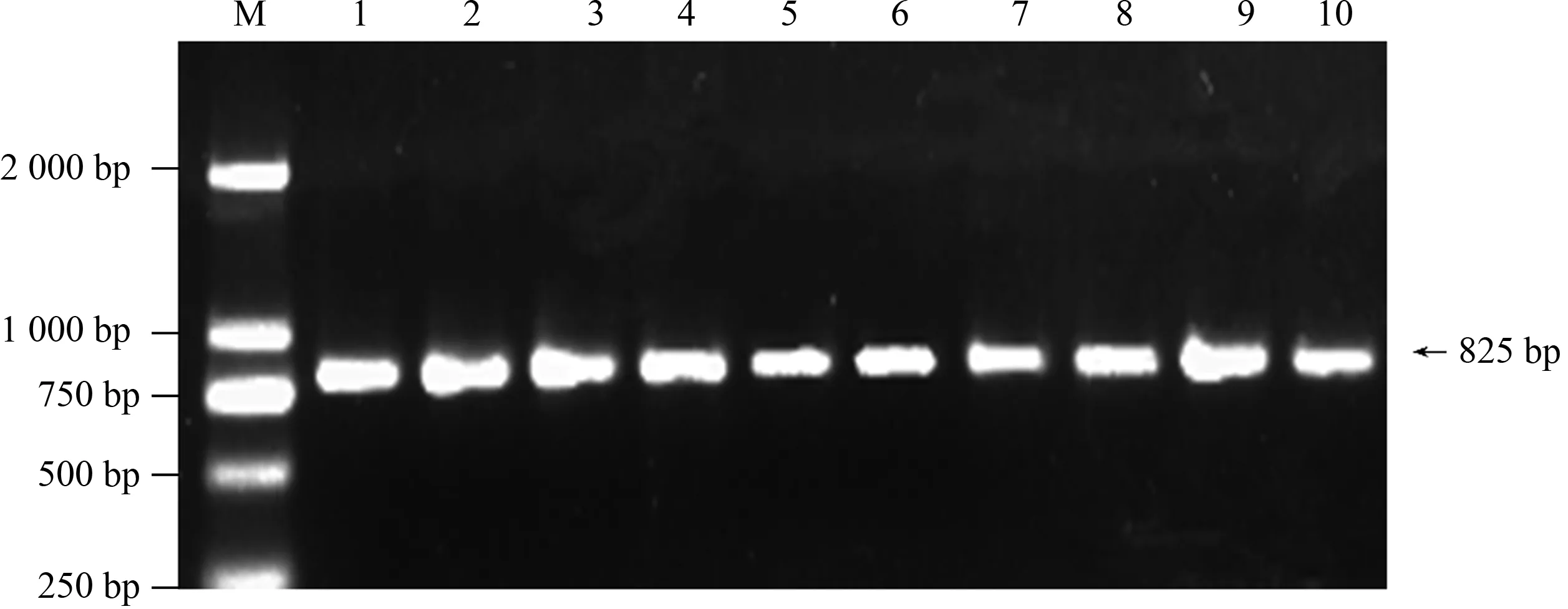
M:DNA Marker DL2000;1—10:50个小麦品种中的部分品种 M:DNA Marker DL2000; 1—10: Some of the 50 wheat varieties图1 TaRHA2b基因PCR扩增产物电泳结果Fig.1 Electrophoresis result of PCR amplification products of TaRHA2b gene
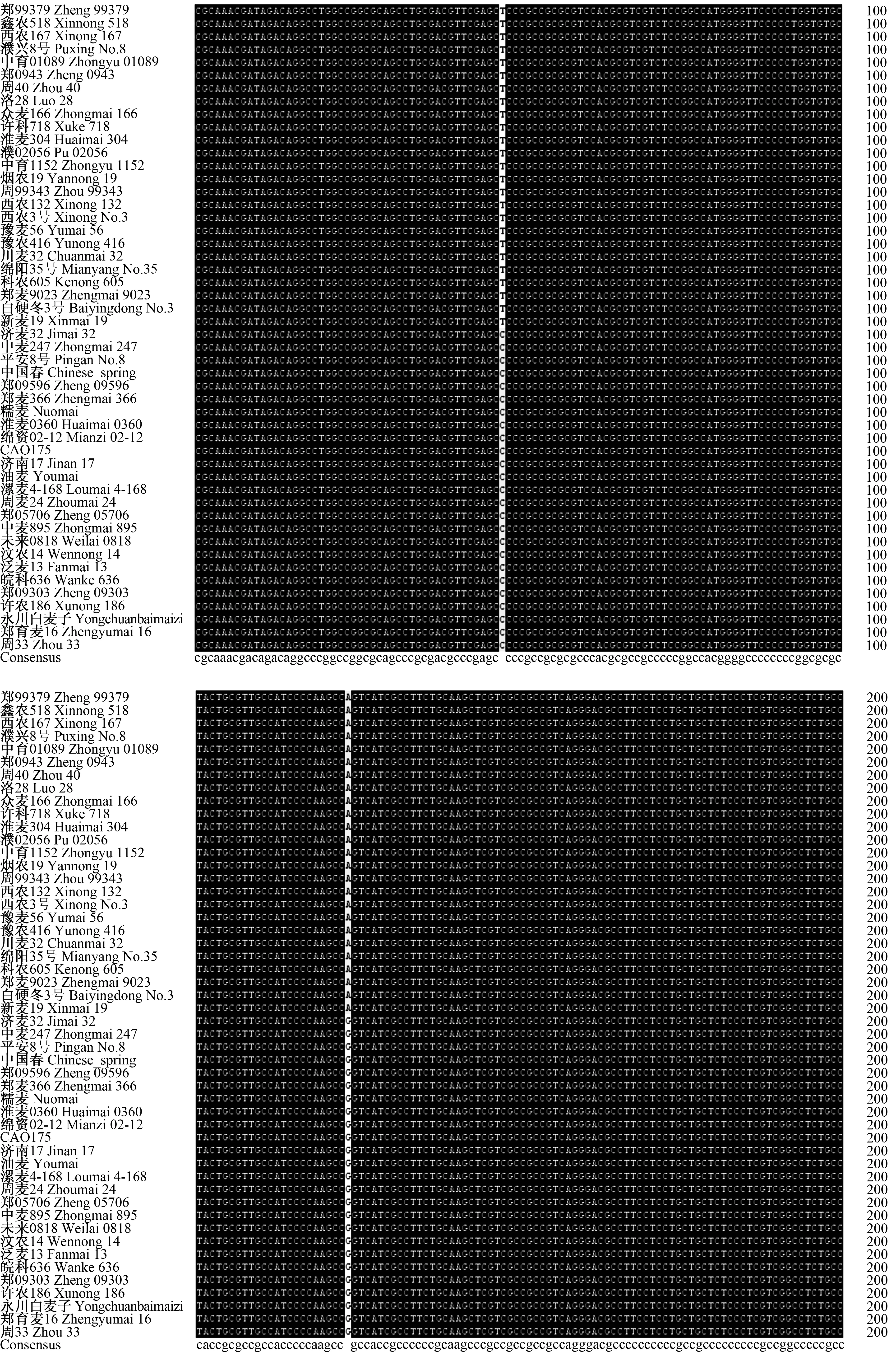
图2 50个小麦品种TaRHA2b基因序列比对分析(1—200 bp)Fig.2 Sequences alignment of TaRHA2b gene of 50 wheat varieties(1—200 bp)
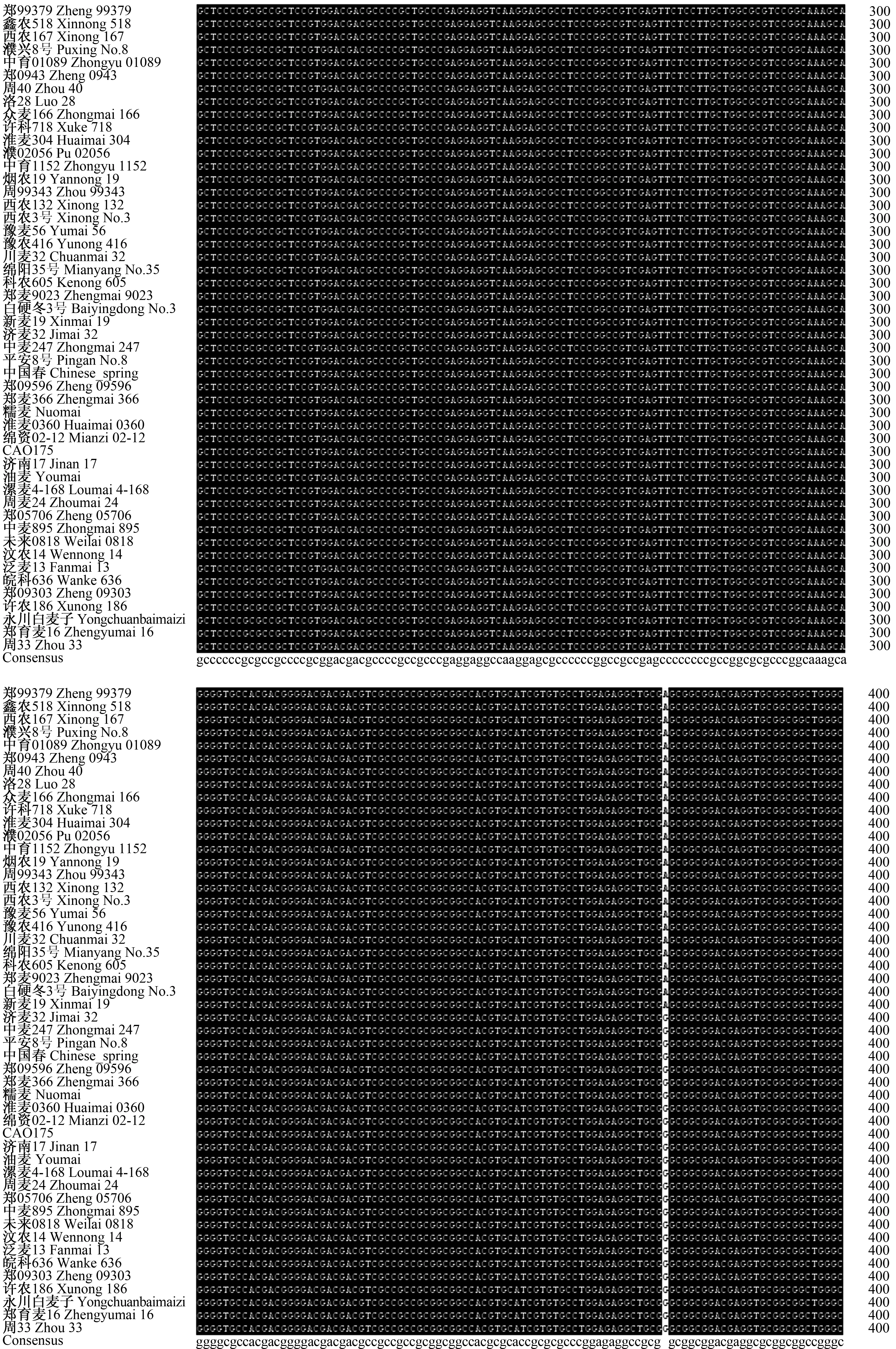
图3 50个小麦品种TaRHA2b基因序列比对分析(201—400 bp) Fig.3 Sequences alignment of TaRHA2b gene of 50 wheat varieties(201—400 bp)

图4 50个小麦品种TaRHA2b基因序列比对分析(401—600 bp) Fig.4 Sequences alignment of TaRHA2b gene of 50 wheat varieties(401—600 bp)
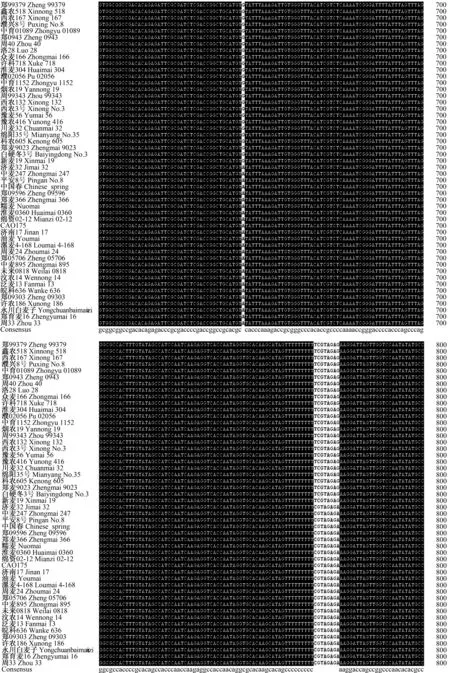
图5 50个小麦品种TaRHA2b基因序列比对分析(601—800 bp) Fig.5 Sequences alignment of TaRHA2b gene of 50 wheat varieties(601—800 bp)

图7 高、低发芽指数小麦品种TaRHA2b基因序列差异位点比较 Fig.7 Comparison of different sites in TaRHA2b gene sequences between wheat varieties with high germination index and low germination index表2 高、低发芽指数小麦品种TaRHA2b基因差异序列导致的酶切位点差异Tab.2 Differences in enzyme cutting sites caused by different sequences of TaRHA2b gene between wheat varieties with high germination index and low germination index

限制性核酸内切酶Restriction endonuclease识别序列Recognition sequence酶切位置Enzyme cutting site高发芽指数品种Varieties with high germination index 低发芽指数品种Varieties with low germination index EcoICRⅠ/Ecl136ⅡGAGCTC46+-SacⅠ/SstⅠGAGCTC48+-
注:+表示核苷酸序列上存在该酶切位点,-表示核苷酸序列上不存在该酶切位点。
Note:+ indicates that there is this enzyme cleavage site in the nucleotide sequence,and-indicates that there isn’t this enzyme cleavage site in the nucleotide sequence.
3 结论与讨论
ABA在调控种子休眠过程中发挥着重要作用,与种子休眠有关的大多数基因都被证实参与ABA合成和ABA信号转导[10]。TaRHA2b基因的同源基因AtRHA2b在ABA 介导的种子萌发和萌发后早期生长阶段中发挥正调控作用[3],而参与ABA信号转导的小麦Viviparous-1(TaVp-1)基因是重要的种子休眠相关转录因子基因[11]。前人研究鉴定了TaVp-1B的3个等位基因,分别命名为TaVp-1Ba、TaVp-1Bb和TaVp-1Bc,基于等位基因变异,开发了STS标记Vp1B3,SSR标记Vp1-b2和Xgwm15,STMS标记Xwmc468和Xgwm397[12]等,这些标记与小麦穗发芽性状显著相关[13],已应用于小麦穗发芽抗性的分子标记筛选和转基因研究。ZHANG等[14]克隆了小麦种子休眠基因TaSdr-A1,并开发了TaSdr-A1基因的特异性标记。在小麦中,已发现的与种子休眠相关的基因数量仍然较少,并且可用于筛选高发芽指数品种的功能标记也有限,而与穗发芽相关的分子标记开发应用前景十分广泛。因此,有必要克隆新基因并开发种子休眠的可靠功能标记。本研究结果表明,50个小麦品种的抗穗发芽能力有明显差异;不同小麦品种间TaRHA2b基因序列的长度变化不大,但是存在6个单核苷酸多态性位点,其中第47位碱基的差异造成了EcoICRⅠ/Ecl136Ⅱ和SacⅠ/SstⅠ这2个酶切位点的差异,这2个酶切位点可以用来鉴定其他小麦品种的穗发芽特性。
