硫酸右旋糖酐通过影响TGF⁃β/Smad4信号通路抑制人胃癌细胞的迁移和侵袭
2019-01-28马艳梅王潇飞王文莙杨媛媛徐远义黄允宁
马艳梅 王潇飞 王文莙 杨媛媛 徐远义 黄允宁
1宁夏医科大学基础医学院病理学系(银川 750004);2宁夏回族自治区人民医院胃肠外科(银川 750001)
随着医疗技术的进步,胃癌的预后有了很大的改善,但其仍然是世界范围内最常见的恶性肿瘤,也是导致癌症死亡的主要原因之一。腹膜转移是胃癌死亡的主要原因[1],腹膜转移的胃癌患者的5年生存率仅为2%[2]。所以能有效抑制胃癌的腹膜转移对提高胃癌的生存率非常重要。
硫酸右旋糖酐(Dextran Sulfate,DS)是一种大分子硫酸右旋糖酐衍生物,本课题组前期的实验表明,应用DS可以显著减少裸鼠胃癌腹膜腔种植转移瘤结节的数量及体积[3],也逐步探索了DS抑制胃癌腹膜转移一些可能的分子机制[4-5]。肿瘤的侵袭、转移与TGF⁃β/Smad4信号通路有着密切的关系,本研究将探讨DS是否通过影响TGF⁃β/Smad4信号通路而抑制胃癌的转移,并为DS抑制胃癌的腹膜种植转移提供更多的理论依据。
1 材料与方法
1.1 材料
1.1.1 试剂胃癌细胞株(MGC⁃803),由上海华东师范大学生命科学实验室赠予。RPMI⁃1640培养基购自Hyclone公司;胎牛血清,购自FUMENG GENE公司;胰蛋白酶⁃EDTA消化液、青链霉素购自北京Leagene生物公司。
1.1.2 药物DS购自Sigma公司,将DS溶于磷酸缓冲液(phosphate buffered saline,PBS),配制浓度为0.3%,用22 μm的过滤器灭菌后,用于细胞培养。
1.1.3 抗体小鼠抗人单克隆TGF⁃β抗体,购自abcam公司;兔抗人多克隆Smad4抗体购自protein⁃tech生物公司;兔抗人多克隆E⁃cadherin抗体,购自Santa Cruz公司;小鼠抗人单克隆N⁃cadhenrin抗体,购自cellsignal公司;抗β⁃tubulin鼠单克隆抗体购自中国北京康为世纪公司;山羊抗兔、山羊抗小鼠荧光抗体、DAPI、山羊血清购自自北京中杉金桥公司。
1.2 方法
1.2.1 细胞培养完全培养基培养MGC⁃803细胞,将培养瓶置于无菌恒温培养箱(37℃、5%CO2)中,每两天更换培养液一次,每3天传一代,当细胞至对数生长期,收集并计数,种于60 mm培养皿中,接种数为2×106/皿,共八个皿。观察细胞贴壁后,对照组加入PBS,实验组加入0.3%DS,继续置于培养箱,培养2、8、12、24 h,分别收集各组细胞备用。
1.2.2 克隆形成实验将对照组加入PBS,实验组加入0.3%DS继续培养24 h,消化、计数后,分别以1 000个细胞/孔的密度接种到6孔板中,重复3孔。继续培养2周,4%多聚甲醛固定20 min,PBS洗涤,0.1%结晶紫染色15 min。计数超过50个细胞的集落形成数。
1.2.3 划痕实验将细胞接种于6孔板中,待细胞融合率达到70%~80%时,用1 000 μL的枪头比着直尺划横线,PBS冲洗3次,拍照。对照组和实验组分别加入无血清培养基和0.3%DS,重复3孔,培养24 h,显微镜下观察,拍照。
1.2.4 Transwell侵袭实验将预制小室从-20℃中取出,再水化后,实验组和对照组均按5×104/孔接种于上室,下室为含有10%FBS的完全培养基,重复3孔。培养箱中培养24 h,4%多聚甲醛固定20 min,PBS洗涤,0.1%结晶紫染色15 min,显微镜下观察,拍照,计数。
1.2.5 免疫荧光双染细胞爬片,4%多聚甲醛固定20 min,Triton⁃100孵育20 min,3%过氧化氢反应15 min,山羊血清封闭20 min,孵育不同种属来源的一抗置于4℃冰箱过夜,设阴性对照,荧光二抗孵育置于37℃温箱、避光60 min,加DAPI,封片。在400倍镜下随机选取的5个视野,采图。TGF⁃β和Smad4主要分布于胞质和胞核,TGF⁃β蛋白用红色荧光标记,Smad4蛋白用绿色荧光标记,DAPI发蓝色荧光用来标记细胞核。应用Image⁃Pro Plus软件测定光密度(optical density,OD)值,各组均取5张图的平均光密度值,应用Adobe Pho⁃toshop CS5合并图片。
1.2.6 Western blot裂解蛋白,EP管冰上放置5 min,振荡30 s,重复5次,然后离心去除细胞碎片及杂质,换新的EP管分装蛋白。应用BCA法检测蛋白浓度,100℃煮蛋白10 min。配胶、上样、进行SDS⁃PAGE胶电泳,切胶、转膜、封闭、一抗孵育、二抗孵育。用ECL化学发光液显影、曝光。应用Image J软件测量各条带的灰度值,以β⁃tubulin为内参,用四个时间点目的蛋白与内参蛋白表达灰度值的比值来表示相对蛋白量。
1.2.7 RT⁃PCR检测TGF⁃β、Smad4的mRNA表达水平用试剂盒分别提取对照组和实验组4个时间点细胞的总RNA,用反转录试剂盒(OMEGA)将其反转录为cDNA。引物均为上海生工生物公司合成,TGF⁃β引物,F:5′⁃AACCCACAACGAAATCTAT⁃GAC⁃3′,R:5′⁃GCTGAGGTATCGCCAGGAAT⁃3′,扩增片段为205 bp。Smad4引物,F:5′⁃AACTTTCCC⁃AACATTCCT⁃3′,R:5′⁃TGCTGCTGTCCTGGCTGA⁃3′,扩增片段为113 bp。GAPDH引物,F:5′⁃AGG⁃TCCACCACTGACACGTT⁃3′,R:5′⁃GCCTCAAGAT⁃CATCAGCAAT⁃3′,扩增片段为310 bp。用Image J进行灰度值分析,以目的条带比内参条带灰度值表示相应mRNA的相对表达水平,比较实验组与对照组不同时间TGF⁃β、Smad4的mRNA表达水平。
1.3 统计学方法使用SPSS 22.0软件对实验数据分析,各组数据均呈正态分布且存在方差齐性,采用独立样本t检验进行各时间点两组间比较。结果P<0.05为差异有统计学意义。
2 结果
2.1 DS抑制人胃癌细胞的增殖、迁移和侵袭
2.1.1 DS对人胃癌细胞增殖的影响克隆形成实验结果显示(图1),对照组克隆形成数为(257.7±3.528),实验组克隆形成数为(142.3±9.025),差异具有统计学意义(P<0.001),表明DS可以减弱胃癌细胞的增殖。
2.1.2 DS对人胃癌细胞迁移的影响划痕实验结果显示(图2),0 h实验组划痕距离为(296±3.055),对照组划痕距离为(298.3±4.055),差异无统计学意义(P<0.05)。24 h实验组划痕距离为(295.3±2.028),而对照组划痕距离为(213.3± 5.044),差异具有统计学意义(P<0.001)。表明DS减弱了胃癌细胞的迁移能力。
2.1.3 DS对人胃癌细胞侵袭的影响Transwell实验结果显示(图3),对照组从上室侵入下室的细胞数为(252.7±5.783),实验组侵袭的细胞数为(149.3±5.608),差异具有统计学意义(P<0.001),证明应用DS可以显著降低胃癌细胞的侵袭能力。

图1 DS对MGC⁃803细胞增殖的影响Fig.1 Effect of DS on proliferation of MGC⁃803 cells

图2 DS对MGC⁃803细胞迁移的影响Fig.2 Effect of DS on migration of MGC⁃803 cells
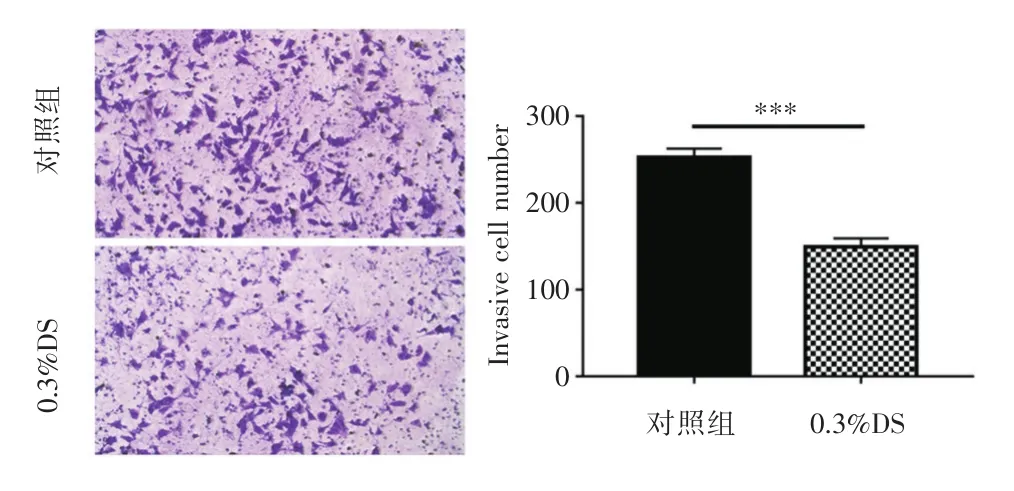
图3 DS对MGC⁃803细胞侵袭的影响Fig.3 Effect of DS on invasion of MGC⁃803 cells
2.2 DS抑制胃癌细胞TGF⁃β表达、促进Smad4表达
2.2.1 DS对人胃癌细胞TGF⁃β、Smad4蛋白表达的影响荧光显微镜下可见,TGF⁃β蛋白表达处发红色荧光,主要分布于胞质和胞核,Smad4蛋白表达处发绿色荧光,主要分布于胞质和胞核。将图片合并后可见红绿光重叠处发黄色荧光,说明TGF⁃β与Smad4存在共定位现象(图4A)。对照组TGF⁃β荧光亮度在2、8、12、24 h,呈现逐渐增高的趋势(0.054±0.003)、(0.064±0.004)、(0.063 ±0.002)、(0.065± 0.003),应用DS后各时间点荧光亮度比对照组明显降低(0.050±0.000 5)、(0.045±0.000 7)、(0.051±0.003)、(0.042±0.001),8、12、24 h差异有统计学意义(P8<0.005,P12<0.01,P24<0.001,图4B),2 h差异无统计学意义。实验组 Smad4荧光亮度(0.055±0.005)、(0.048±0.005)、(0.063±0.000 8)、(0.065±0.002)与对照组(0.036±0.003)、(0.025±0.004)、(0.034±0.001)、(0.045± 0.002)相比呈逐步升高,2、8、12、24 h差异均 有统 计学 意义(P2<0.01,P8<0.005,P12<0.001,P24<0.005,图4C)。

图4 细胞免疫荧光检测对照组与实验组2、8、12、24 h胃癌细胞TGF⁃β和Smad4的表达Fig.4 The expressions of TGF⁃β and Smad4 in gastric cancer cells were detected by immunofluorescence assay in the control group and the experimental group at 2,8,12 and 24 hours(× 400)
Western blot实验结果见图5A。对照组TGF⁃β蛋白2、8、12、24 h高表达(0.55± 0.01)、(0.63±0.04)、(0.69±0.04)、(0.74±0.03),应用DS后表达均降低(0.51±0.02)、(0.50±0.01)、(0.37±0.04)、(0.26±0.02),4个时间点差异均有统计学意义(P2<0.05,P8<0.005、P12<0.001,P24<0.001,图5B)。对照组Smad4蛋白2、8、12、24 h表达量明显减少(0.70±0.01)、(0.53±0.03)、(1.03±0.05)、(0.44±0.03),而应用DS后实验组Smad4蛋白表达逐渐增高(0.88±0.07)、(1.16±0.02)、(1.31±0.08)、(0.72±0.10),各个时间点差异均有统计学意 义(P2<0.05、P8<0.001,P12<0.01,P24<0.05图5C)。表明DS可以抑制胃癌细胞TGF⁃β蛋白表达、促进Smad4蛋白表达。

图5 Western blot分别检测对照组与实验组2、8、12、24 h TGF⁃β和Smad4的表达Fig.5 Western blot was used to detect the expression of TGF⁃β and Smad4 in the control group and the experimental group at 2,8,12 and 24 hours
2.2.2 DS对人胃癌细胞TGF⁃β、Smad4mRNA表达的影响RT⁃PCR实验结果见图6A。应用DS后检测TGF⁃β、Smad4的mRNA表达水平,实验组TGF⁃β低表达(0.23±0.01)、(0.46±0.11)、(0.20 ±0.001)、(0.49±0.003)与对照组(0.25±0.01)、(1.03± 0.01)、(0.51±0.02)、(0.86±0.01)相比2、8、12、24 h四个时间点表达量均减少,8、12、24 h差异有统计学意义(P8<0.05,P12<0.005,P24<0.001,图6B),2 h差异无统计学意义。对照组Smad4在2、8、12、24 h表达量均明显减少(0.60±0.02)、(0.80±0.02)、(0.56±0.03)、(0.51±0.03),而应用DS后2、8、12、24 h,实验组Smad4表达逐渐增高(0.91±0.02)、(1.05±0.02)、(0.67±0.02)、(1.21±0.01),四个时间点差异均有统计学意义(P2<0.001,P8<0.001,P12<0.05,P24<0.001,图6C)。表明 DS 可以抑制人胃癌细胞TGF⁃β mRNA表达、促进Smad4 mRNA表达。
2.3 DS对人胃癌细胞EMT的影响Western blot结果见图7A。对照组2、8、12、24 h胃癌细胞中E⁃cadherin低表达,(1.32±0.04)、(1.25±0.02)、(1.28± 0.05)、(1.24±0.03),应用DS后各个时间点E⁃cadherin表达增高,(1.91±0.04)、(1.96±0.01)、(1.79± 0.07)、(2.15± 0.04),差异具有统计学意义(P2<0.001,P8<0.001,P12<0.001,P24<0.001,图7A)。对照组N⁃cadherin在胃癌细胞中2、8、12、24 h均高表达(1.20±0.14)、(1.09±0.08)、(1.23±0.16)、(1.37±0.11),应用DS后各个时间点N⁃cad⁃herin表达降低,(0.58±0.09)、(0.72±0.05)、(0.49 ±0.03)、(0.41±0.04),差异具有统计学意义(P2<0.001,P8<0.005,P12<0.005,P24<0.001,图7B)。
3 讨论
胃癌是我国癌症死亡的第二大原因,约占所有癌症死亡人数的17.6%[6],尽管随着诊疗技术的提高,其病死率在全球范围内有所下降,但患者复发转移率高,预后仍然较差。腹膜转移是预后不良的重要临床指征,在转移性胃癌中,超过55%~60%的患者存在腹膜腔转移[7]。腹膜转移的胃癌患者不能进行根治性手术,而由于静脉化疗药物分布不充分,腹膜屏障阻滞及肿瘤化疗耐药,化疗效果有限[8]。因此,迫切需要开发预防及治疗胃癌的腹膜转移药物,以改善胃癌患者的预后,而DS正是具有这种潜力的药物。
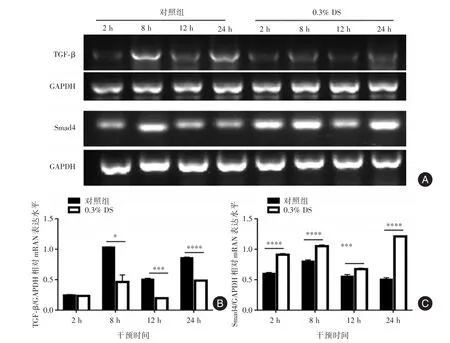
图6 RT⁃PCR检测对照组与实验组2、8、12、24 h 胃癌细胞TGF⁃β和Smad4的表达Fig.6 RT⁃PCR was used to detect the expression of TGF⁃β and Smad4 in gastric cancer cells of control group and experimental group at 2,8,12 and 24 hours
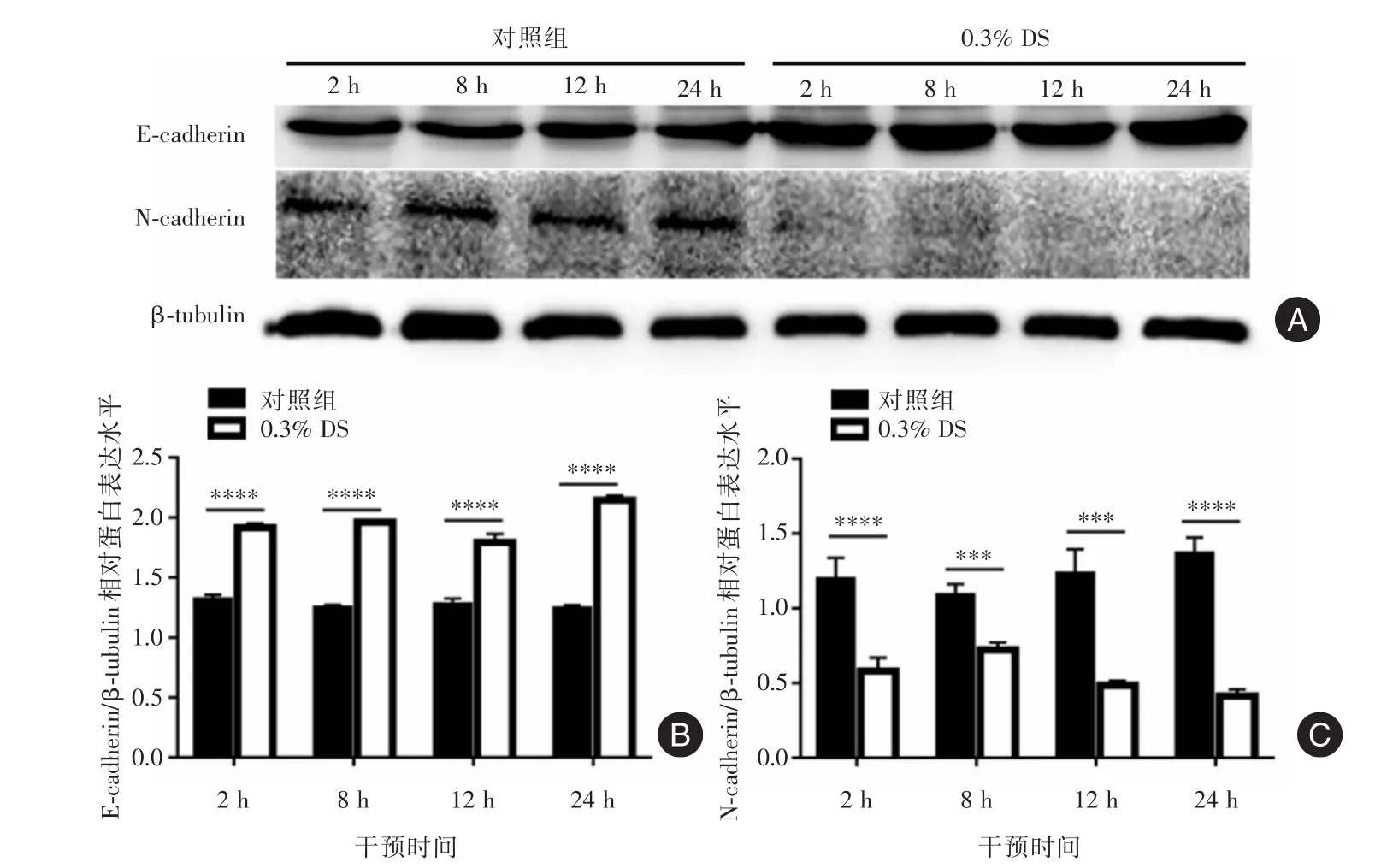
图7 Western blot检测对照组与实验组2、8、12、24 h 胃癌细胞N⁃cadherin和E⁃cadherin的表达Fig.7 Western blot analysis of N⁃cadherin and E⁃cadherin expression in gastric cancer cells of control group and experimental group at 2,8,12 and 24 hours
本组的细胞克隆形成实验、划痕实验及Tran⁃swell侵袭实验结果表明,与对照组相比实验组胃癌细胞的增殖、迁移和侵袭显著被抑制,证明了DS可以抑制胃癌细胞的增殖、迁移和侵袭。
TGF⁃β/Smad4信号通路控制着细胞膜至细胞核的信号转导,在癌症的发生和发展中起着重要作用[9]。
TGF⁃β1可以增强癌细胞的浸润能力,促进肿瘤的进展[10]。胰腺导管腺癌衍生的细胞表现出特别高的TGF⁃β1表达,癌症晚期阶段,TGF⁃β在肿瘤组织中积聚,最终导致EMT、迁移、侵袭和转移形成[11]。研究[12]表明,胃癌患者血清和癌组织中TGF⁃β1高表达并与淋巴结受累和不良预后相关。本研究通过细胞免疫荧光双染、Western blot、RT⁃PCR检测不同时间点细胞中TGF⁃β的表达,发现在胃癌细胞中TGF⁃β在蛋白水平和mRNA水平均呈现高表达,而应用DS后各个时间点TGF⁃β的表达明显降低,且随着作用时间的延长这种抑制作用更为显著,表明DS可能通过抑制TGF⁃β的表达,来抑制胃癌的侵袭和转移。
Smad4作为Smads蛋白家族的重要成员,是TGF⁃β/Smads信号传导的关键组件。研究表明,Smad4缺失使得非小细胞肺癌小鼠模型肿瘤体积的增大和恶性程度增高,还可引发自发性肺肿瘤形成并促进其的生长[13]。ZHENG 等[14]的研究表明,胃癌中Smad4呈低表达,且与肿瘤的侵袭、转移和淋巴结转移相关,Smad4可以抑制胃癌细胞的生长、侵袭和转移,说明Smad4在胃癌发展过程中发挥抑癌功能。本研究通过细胞免疫荧光双染、western blot、RT⁃PCR实验,检测胃癌细胞不同时间点Smad4的表达,结果显示,对照组Smad4在四个时间点均呈低表达,表明在胃癌细胞中Smad4可能是一种抑癌基因,这与ZHENG等[14]研究结果一致。而应用DS后,Smad4表达显著增高,表明DS通过促进胃癌细胞Smad4的表达,而发挥抑癌作用。
上皮间质转化(epithelial⁃mesenchymal transi⁃tion,EMT)与肿瘤的转移密切相关。在此过程中上皮细胞的极性丧失,与周围细胞和基质接触减少,迁移和运动能力增强,同时上皮表型丢失而逐渐获得间质表型[15]。发生 EMT 的标志是 E⁃cad⁃herin表达降低,伴随着N⁃cadherin或Vimentin表达的增加[16]。本实验通过Western blot检测了上皮标志物 E⁃cadherin和间充质标志物 N⁃cadherin,发现对照组各个时间点E⁃cadherin低表达而N⁃cadherin均为高表达,而应用DS后不同时间点E⁃cadherin表达增高,N⁃cadherin表达降低,证明DS可以抑制胃癌细胞的EMT。
综上所述,DS可以显著抑制人胃癌细胞增殖、迁移和侵袭,其可能的分子机制是DS通过影响人胃癌细胞TGF⁃β/Smad4信号通路,从而抑制胃癌细胞的EMT,进而抑制胃癌细胞的增殖、迁移和侵袭。
