MicroRNA- 135a通过靶向Rap2a对肾细胞癌细胞迁移侵袭的影响
2019-01-25陈文炜高星健张华陈沁江涛高锐毛厚平
陈文炜,高星健,张华,陈沁,江涛,高锐,毛厚平
(福建医科大学附属第一医院 泌尿外科,福建 福州 350005)
肾细胞癌(renal cell carcinoma,RCC)是泌尿系统最常见的恶性肿瘤之一,每年新发RCC病例约295 000 例,20%~30%的RCC患者在诊断和肾切除术时已发生转移,预后极差,5年生存率不足10%[1]。因此,深入研究RCC发生、发展的分子机制具有重要的临床意义。Ras超家族由Rap家族与Ras共同组成,可参与细胞增殖、周期、分化等多种生物学过程,Rap家族共有5个成员,分别为Rap1a、Rap1b、Rap2a、Rap2b和Rap2c,Rap2a在多种类型肿瘤中表达显著上调[2- 3]。在RCC中,Rap2a可通过激活p- Akt途径参与肾癌发展恶化[4]。MicroRNA(miR)是一种长约18~22个核苷酸的单链非编码RNA,可作为原癌基因或抑癌基因在肿瘤发生发展中发挥关键的调控作用[5]。研究发现,miR- 135a与肿瘤发生密切相关,其可通过靶向调节骨髓细胞瘤病毒癌基因(cellular- myelocytomatosis viral oncogene,c- Myc)表达来抑制RCC细胞增殖[6]。然而,miR- 135a对RCC侵袭转移作用的研究报道较少。本研究利用Target Scan软件预测出与Rap2a的3′UTR互补结合的miRNA—miR- 135a,并进一步揭示miR- 135a对RCC细胞迁移侵袭的影响及潜在的分子机制。
1 材料与方法
1.1 细胞培养
293T细胞、正常肾组织细胞HK- 2及RCC细胞Ketr- 3、786- O、ACHN购自上海艾睿生物科技有限公司,293T、HK- 2、Ketr- 3、ACHN用含10%FBS(Hyclone,美国)+DMEM(Hyclone,美国)、786- O用RPMI 1640(Hyclone,美国)置于37 ℃、含5%CO2的细胞培养箱中培养。
1.2 细胞转染
MiR- 135a和阴性对照模拟物购自Gene Pharma(中国上海)公司。用PCR扩增Rap2a的编码序列并克隆至pcDNA3.1质粒(Addgene,美国)中,构建外源过表达Rap2a质粒。用PCR扩增Rap2a的3′UTR片段并克隆至pmirGLO质粒(Promega,美国),构建野生型报告质粒(Rap2a- WT),用TakaRa点突变试剂盒将野生型质粒上miR- 135a结合位点进行突变,构建突变型报告质粒(Rap2a- Mut)。参照Lipofectamine 2000(Invitrogen,美国)说明书进行细胞转染。
1.3 蛋白质印迹法实验
收集细胞,用含PMSF裂解液提取蛋白,于4 ℃、12 000×g离心15 min,取上清液,用BCA法测蛋白浓度。SDS- PAGE分离蛋白质并转移到PVDF膜上,切膜并用一抗稀释液孵育,于4 ℃过夜,二抗稀释液常温2 h,曝光显影。抗体:Rap2a(1∶1 000,CST,美国)、Akt(1∶1 000,CST,美国)、p- Akt(1∶1 000,CST,美国)。β- actin(1∶1 000,CST,美国)作为内参。
1.4 双荧光素酶报告基因检测实验
将pmirGLO- Rap2a- WT、pmirGLO- Rap2a- Mut质粒与miR- 135a或阴性对照模拟物共转至293T细胞,48 h 后用双荧光素酶活性试剂盒(Promega,美国)检测荧光素酶活性变化。
1.5 细胞侵袭迁移检测
侵袭小室分两种,一种无预铺胶用于细胞迁移实验,另一种有预铺胶用于细胞侵袭实验。将200 μl含5× 104个细胞的培养液接种至上室中,下室中加入500 μl完全培养液,每组3个复孔,孵育48 h后用棉签将上室中残留物擦掉,磷酸盐缓冲盐水(PBS)洗3次,4%多聚甲醇固定10 min,晾干后结晶紫染色10 min,双蒸水洗3次于镜下观察,每个小室随机选择3个视野进行细胞计数。
1.6 统计学处理

2 结 果
2.1 Rap2a在RCC细胞系中高表达
见图1。Rap2a在RCC细胞系Ketr- 3、786- O和ACHN中的表达明显高于正常肾组织细胞HK- 2(P<0.05),其中Ketr- 3中Rap2a表达相对最高,故后续实验选取Ketr- 3作为研究对象。

图1Rap2a在肾细胞HK-2和RCC细胞786-O、ACHN、Ketr-3中的表达
2.2 Rap2a是miR- 135a的靶基因
Target Scan软件预测发现,Rap2a是miR- 135a的靶基因,Rap2a的3′UTR中含有与miR- 135a种子区反向互补的核苷酸序列(图2A)。将野生型Rap2a- WT和突变型Rap2a- Mut报告质粒与miR- 135a或阴性对照模拟物共转染入293T细胞,孵育48 h后双荧光素酶报告基因实验检测发现,过表达miR- 135a可显著下调Rap2a- WT的荧光素酶活性,而对Rap2a- Mut的荧光素酶活性无明显影响(图2B),表明Rap2a是miR- 135a的靶基因。

A.miR- 135a与Rap2a的3′UTR结合位点示意图;B.报告质粒pmirGLO联合miRNA模拟物共转染入293T细胞后荧光素酶活性变化;与阴性对照组比较,aP<0.05
图2miR-135a与Rap2a的3′UTR结合位点示意图及对转染Rap2a报告质粒的293T细胞荧光素酶活性的影响
2.3 miR- 135a可抑制Rap2a及其下游信号通路
见图3、表1。与阴性对照组相比,过表达miR- 135a后Ketr- 3细胞中Rap2a及其下游蛋白p- Akt表达显著下调;而miR- 135a和Rap2a共表达后Ketr- 3细胞中Rap2a及其下游p- Akt表达恢复(P<0.05)。

图3Ketr-3细胞中Rap2a、p-Akt、Akt蛋白电泳图
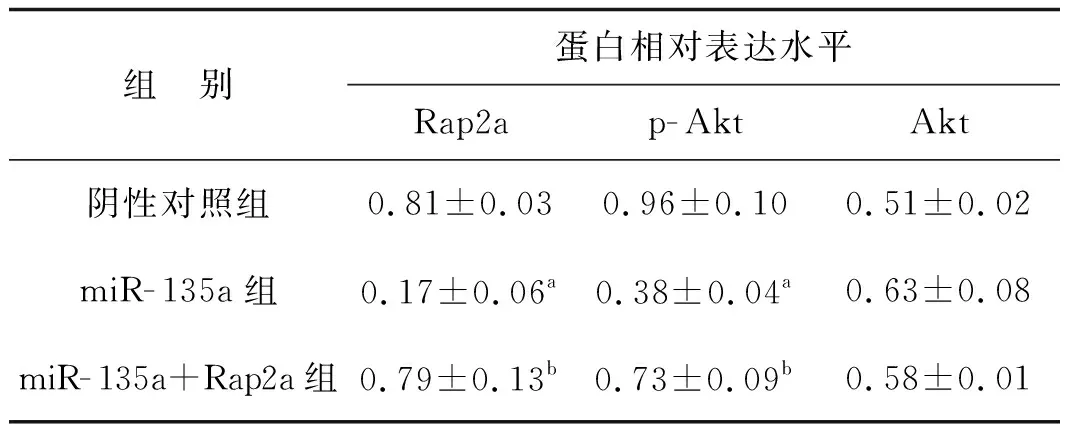
组 别蛋白相对表达水平Rap2ap-AktAkt阴性对照组0.81±0.030.96±0.100.51±0.02miR-135a组0.17±0.06a0.38±0.04a0.63±0.08miR-135a+Rap2a组0.79±0.13b0.73±0.09b0.58±0.01
与阴性对照组比较,aP<0.05;与miR- 135a组比较,bP<0.05
2.4 miR- 135a靶向Rap2a对细胞迁移侵袭影响
Transwell检测发现,与阴性对照组相比,过表达miR- 135a可显著抑制Ketr- 3细胞的迁移侵袭能力,而miR- 135a和Rap2a共表达后Ketr- 3细胞迁移侵袭能力恢复(P<0.05)(图4A、B)。
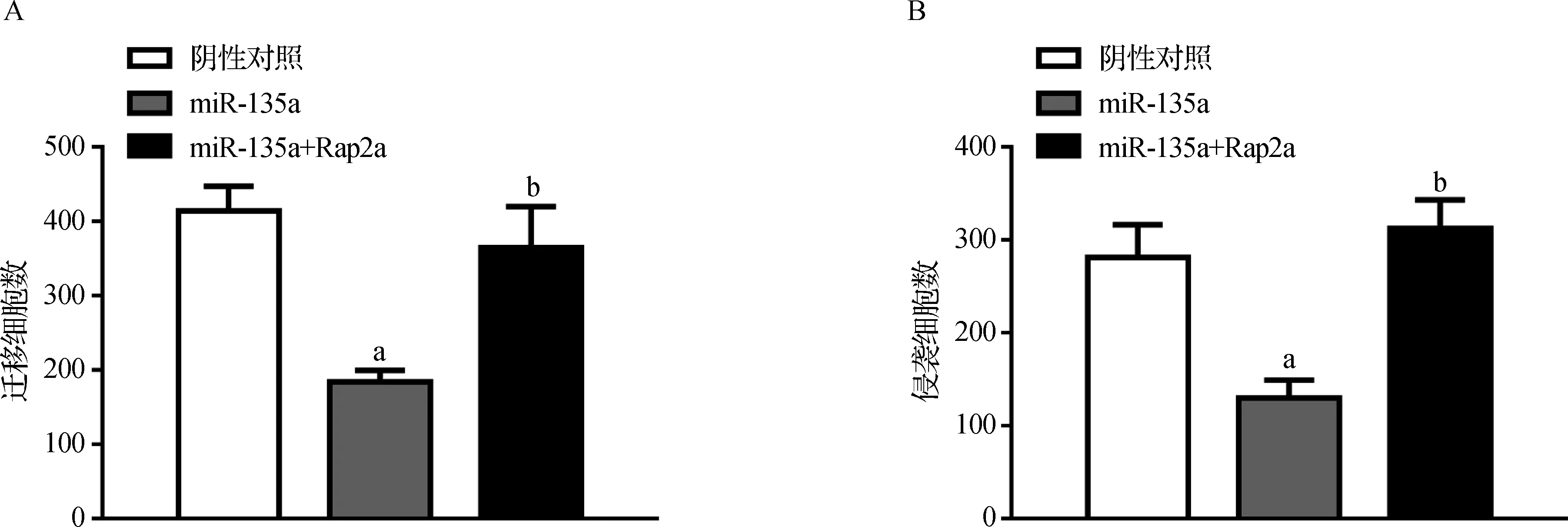
A.miR- 135a对细胞迁移的影响;B.miR- 135a对细胞侵袭的影响;与阴性对照组比较,aP<0.05;与miR- 135a组比较,bP<0.05
图4miR-135a对细胞迁移侵袭能力影响
3 讨 论
RCC是泌尿系统最为常见的恶性肿瘤之一,放、化疗及生物免疫治疗均不敏感,手术是目前主要的治疗手段,但有20%~30%的患者在就诊之初已发生转移,严重影响预后[7]。肿瘤转移是一个多步骤、多因素相互作用的复杂生物学过程,其中细胞迁移侵袭是恶性肿瘤转移的关键[8]。因此,针对肿瘤细胞侵袭转移的干预是肿瘤治疗的切入点之一。
Rap2a是Rap GTP结合蛋白家族的成员之一,属Ras超家族,其可调控细胞的多种生物学进程,如细胞黏附、分化和增殖等[9]。近年来越来越多的研究发现,Rap2a与肿瘤的形成及恶化有关。有研究报道,Rap2a的下游效应因子Rap2相互作用蛋白9(Rap2 interacting protein 9,RPIP9)在乳腺癌中的表达增高,且与乳腺癌的恶性程度密切相关,其另一下游效应因子丝裂原活化蛋白激酶激酶激酶激酶4(mitogen- activated protein kinase kinase kinase kinase4, MAP4K4)在多种肿瘤组织中均高表达,且与肿瘤的侵袭及转移相关[10- 11]。Prabakaran等[12]发现,Rap2a在从滤泡型甲状腺癌组织中分离的具有高侵袭能力的癌细胞中高表达,且与甲状腺癌浸润转移高度相关。上述研究表明,Rap2a在多种恶性肿瘤中高表达,且与肿瘤细胞迁移侵袭密切相关。本研究蛋白质印迹法检测发现,Rap2a在正常肾组织细胞中低表达,而在RCC细胞中高表达,这与先前文献研究[4]结果相一致。然而,其在RCC细胞中高表达的机制仍未完全阐明,推测表观遗传的改变可能是导致其高表达的原因之一。
MicroRNA是表观遗传学中的研究热点之一,其在调节许多蛋白质编码基因表达能力方面是独一无二的,一个miRNA能够靶向调控许多基因,全面参与调控多种生物过程[13]。MiR- 135a作为一类与肿瘤发生发展密切相关的小分子RNA,在多种肿瘤中呈低表达。Dang等[14]研究发现,miR- 135a在胰腺癌组织中的表达较癌旁组织显著下调,并可通过靶向抑制B细胞 特异的莫洛尼鼠白血病毒插入位点1基因(B cell- specific Moloney murine leukemia virus integration site 1, Bmi1)的表达进而抑制胰腺癌细胞的增殖和侵袭。Hidaka等[15]在研究肾癌miRNA表达谱中也发现miR- 135a显著低表达。此外,Yamada等[6]发现,miR- 135a作为抑癌因子可通过靶向抑制c- Myc表达来抑制肾癌细胞增殖。上述研究表明,miR- 135a在多种恶性肿瘤中低表达,且过表达miR- 135a可抑制肿瘤细胞的增殖和迁移侵袭能力。本研究通过TargetScan软件预测、双荧光素酶报告基因检测和蛋白质印迹法实验证实,Rap2a是miR- 135a的靶基因,并且在RCC细胞Ketr- 3中,过表达miR- 135a可通过靶向抑制Rap2a/p- Akt信号进而抑制细胞迁移侵袭能力,miR- 135a在RCC中亦同样发挥抑癌基因功能。
综上所述,本研究证实,miR- 135a作为肿瘤抑制因子,可通过靶向调控Rap2a抑制RCC细胞的迁移和侵袭,并下调Akt信号通路的活化。本研究从表观遗传学角度阐释Rap2a在RCC中高表达的可能机制,为深入了解RCC恶化转移机制提供了新见解,同时也为RCC的临床治疗提供了新靶点。
