慢性萎缩性胃炎大鼠胃黏膜中Hp阳性对表皮生长因子表达的影响
2019-01-25杨静冯庆涛杨铸锋龙润杨金国郭虹忆
杨静,冯庆涛,杨铸锋,龙润,杨金国,郭虹忆
(河北省中医院 1.消化内镜科;2.功能科;3.脾胃病二科 河北 石家庄 050011)
慢性萎缩性胃炎(chronic atrophic gastritis, CAG)是临床上常见的一种严重危及消化系统和人类健康的疾病[1- 2]。近年来,CAG的发病率在世界范围内呈上升趋势,并且癌变率较高,世界卫生组织WHO已将其列为胃癌的癌前疾病[3]。CAG是胃黏膜损伤与修复的一种慢性过程,是胃黏膜遭到外界或毒性因素破坏,胃部黏膜内免疫防御系统失衡的胃黏膜慢性炎性疾病,其主要表现为胃黏膜的慢性炎症、胃黏膜变薄及固有腺体的萎缩、黏膜层内的慢性炎症细胞浸润,胃黏膜固有腺体的数量减少或消失,并伴有大量的纤维组织增生和黏膜层增厚,以及不同类型的胃黏膜上皮肠化生和异型增生等情况[4- 6]。大量临床和基础研究证实,幽门螺杆菌(Hp)是CAG的主要致病因素[7]。由于人群中感染Hp耐药菌株的比例逐渐上升、常规临床的三联疗法对Hp的根除率逐渐降低及抗生素的不良反应等问题,使得临床治疗和根治CAG变得十分困难。本研究通过采用化学药物损伤的方法建立CAG大鼠模型,并给予Hp菌悬液灌胃,旨在观察慢性萎缩性胃炎大鼠胃黏膜中Hp阳性对表皮生长因子(EGF)表达的影响。
1 材料与方法
1.1 实验动物、主要试剂与仪器
60只成年雄性SD大鼠,购于北京维通利华实验动物技术有限公司。大鼠饲养在SPF级动物实验室,室温为(22±2) ℃,12 h/12 h循环昼夜光照。悉尼标准Hp菌株购于北京细胞生命科学研究所。一抗兔抗单克隆抗体EGF和β- 肌动蛋白(ACTB)、吲哚美辛、水杨酸钠、乙醇均购于美国Santa Cruz生物技术有限公司;二抗山羊抗兔IgG购于上海碧云天生物技术有限公司;SDS- PAGE电泳设备及转膜仪购于美国Bio- rad公司。
1.2 胃炎模型制备[8]和各组给药
将Hp菌株进行复苏,并接种在Hp布式琼脂平板上,密封后置入培养箱中培养48 h。收集生理盐水制备的Hp菌悬液并调整菌悬液菌量为1×1012CFU·ml-1。造模成功判断标准为光镜下显示胃黏膜固有腺体减少[9]。
对照组:采用生理盐水2 ml行大鼠灌胃,1次·d-1,共14周。
模型组:大鼠灌胃前禁食12 h,然后给予配制好的抗生素(灭滴灵、四环素和丽珠得乐混合液2 ml·只-1·d-1)连续3 d灌胃以清除胃内杂菌,第4天起采用吲哚美辛溶液(2 ml·只-1·d-1)进行连续2 d灌胃,破坏胃黏膜屏障,再给予大鼠水杨酸钠和乙醇混合溶液(2 ml·只-1·d-1)灌胃,连续8周,制作慢性萎缩性胃炎模型。
实验组:大鼠在模型组基础上,给予大鼠Hp菌悬液2 ml灌胃,1次·d-1,连续6 d。
1.3 HE染色和Hp阳性观察
大鼠腹腔注射麻醉后取胃黏膜标本。沿胃大弯剪开,一半胃黏膜进行Hp检测;另一半胃黏膜进行常规脱水透明,并用石蜡包埋,连续切片6张,厚5 μm,苏木素染色,二甲苯透明,行HE染色,观察大鼠胃黏膜的变化。
1.4 免疫组织化学染色检测大鼠胃黏膜EGF的表达
取胃黏膜石蜡标本,用5%血清室温封闭40 min,加入(1∶1 000)EGF单克隆抗体,4 ℃过夜孵育。隔天加入二抗(1∶1 000),于37 ℃孵育30 min,加入SP后恒温反应持续30 min,加入DAB显色液显色,中性树胶封片。EGF阳性表达主要表现为大鼠胃黏膜细胞内检测到棕黄色的颗粒。切片随机选择6个高倍镜视野(×400)进行计数,计算大鼠胃黏膜组织中EGF蛋白表达的平均光密度。
1.5 蛋白质印迹法检测大鼠胃黏膜EGF蛋白表达
取胃部标本放试管中冰上裂解2 h,待裂解完全后放入离心机,以1 500 r·min-1离心15 min,调整各组蛋白浓度总量调整为30 g·L-1,加至10% SDS聚丙烯酰胺凝胶中进行电泳,转膜至PVDF膜后加入单克隆抗体EGF和二抗。ECL显色剂显色,Bio- Pro凝胶成像分析仪成像,Quantity- one软件对各泳道条带进行灰度扫描分析。
1.6 统计学处理
2 结 果
2.1 大鼠胃黏膜HE染色结果
见图1。

图1大鼠胃黏膜HE染色×400
对照组胃黏膜上皮完整,可以观察到正常的黏液细胞;模型组大鼠胃黏膜固有层腺体厚度正常或变薄,仅有少量炎症细胞浸润;实验组胃黏膜腺体明显减少或消失,胃黏膜细胞萎缩破裂,出现大量空泡,淋巴细胞和嗜酸粒细胞浸润,并伴有大量的纤维组织增生和黏膜增厚。
2.2 大鼠胃黏膜Hp阳性率
模型组Hp阳性率为65.00%,实验组Hp阳性率为95.00%,差异有统计学意义(χ2=5.625,P=0.018)。
2.3 大鼠胃黏膜EGF免疫组化结果
见图2。
大鼠胃黏膜EGF阳性蛋白表达的平均光密度对照组为0.64±0.11,模型组为1.34±0.23,实验组为1.58±0.19。与对照组和模型组相比,实验组EGF阳性蛋白表达的平均光密度明显升高(F=5.937,P<0.05)。
2.4 大鼠胃黏膜EGF蛋白表达
见图3。

图2大鼠胃黏膜EGF免疫组化×400
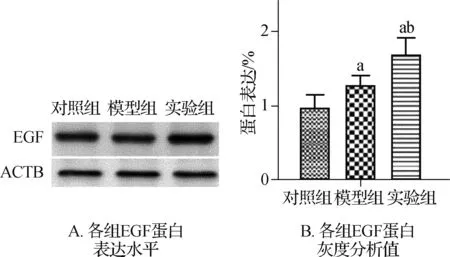
与对照组比较,aP<0.05;与模型组比较,bP<0.05
图3EGF蛋白表达
与对照组比较,模型组和实验组EGF蛋白表达显著升高(P<0.05);与模型组相比,实验组EGF蛋白表达显著升高,差异均有统计学意义(P<0.05)。
3 讨 论
目前研究己经确认,在60%~90%慢性胃炎患者的胃黏膜中可培养出Hp,Hp作为慢性萎缩性胃炎的主要致病因素,可引起慢性胃炎,并导致胃溃疡和CAG,严重者则发展为胃癌[10- 11]。Hp致病是多因素共同作用的结果[12],其致病性主要表现在:(1)Hp可以促进机体产生多种酶类及相关代谢产物,对胃黏膜上皮细胞进行分解和破坏,导致胃黏膜组织损伤;(2)Hp菌体细胞壁具有lewisx、lewisy抗原和抗体包裹,容易引发自身免疫反应;(3)Hp可以诱导胃黏膜产生炎症因子,使大量巨噬细胞和中性粒细胞活化和浸润;(4)Hp可以产生空泡毒素,引发细胞空泡变性的分泌型毒素蛋白表达;(5)Hp可诱发胃上皮细胞的凋亡和死亡,破坏胃黏液层的生理结构和黏膜屏障。
本研究首先采用非甾体抗炎药吲哚美辛予大鼠灌胃,破坏胃黏膜的修复和防御功能;并给予大鼠抗生素灌胃,杀灭和消除大鼠胃内正常革兰阳性菌、厌氧菌和常驻菌群等,破坏胃黏膜表面的黏液-碳酸氢盐屏障,降低胃内正常菌群的免疫防护作用;然后给予水杨酸钠及乙醇混合溶液予大鼠灌胃,构建慢性萎缩性胃炎大鼠模型;最后采用含有细胞毒素基因和空泡毒素基因的Hp灌胃,构建Hp感染慢性萎缩性胃炎大鼠模型。
本研究结果显示,对照组大鼠胃黏膜上皮完整,可以观察到正常的黏液细胞;模型组大鼠胃黏膜固有层腺体厚度正常或变薄,仅有少量炎症细胞浸润;实验组胃黏膜腺体明显减少或消失,胃黏膜细胞萎缩破裂,出现大量空泡,淋巴细胞和嗜酸粒细胞浸润,并伴有大量的纤维组织增生和黏膜增厚。说明在化学药物的基础上给予大鼠Hp悬液灌胃会显著增加其胃黏膜的刺激和损伤。
细胞内EGF在胃黏膜的损伤和修复过程中有十分重要的作用。EGF能够提高机体对葡萄糖和氨基酸的吸收,刺激体内蛋白质DNA和RNA的合成,具有促进上皮细胞、纤维细胞及黏膜组织等多种细胞有丝分裂的作用。EGF作为胃黏膜的的保护因子,调节参与胃黏膜的生长和成熟促进胃黏膜的再生与修复,可与靶细胞膜上EGF特异性受体结合,并参与胃上皮细胞的增殖和迁移,参与促进胃溃疡的愈合[13- 14]。EGF在维持胃肠黏膜完整性,促进胃上皮细胞的增殖分化,保护胃黏膜免受炎症因子的破坏等方面起到重要作用[15- 16]。在胃肠道黏膜内,EGF可以通过促进胃黏膜细胞的黏蛋白及前列腺素PGE2合成、刺激黏液和nco- 5的分泌,发挥扩张血管、促进黏膜内的血流循环及抑制胃酸和胃蛋白酶的分泌的作用。同时,EGF还可通过促进绒毛增生、隐窝细胞的增殖,促进胃肠道黏膜的成熟、修复和再生。本研究结果表明,实验组EGF阳性蛋白表达的平均光密度和蛋白的表达水平比模型组明显升高,说明在Hp感染的慢性萎缩性胃炎大鼠中EGF参与胃黏膜组织的损伤过程。
综上所述,EGF参与慢性萎缩性胃炎的胃黏膜损伤的修复过程,Hp阳性可明显加重胃黏膜的损伤程度,与慢性萎缩性胃炎的胃黏膜损伤具有更明显的相关性。因此,临床上可针对EGF靶向治疗Hp引起的胃部胃黏膜损伤。
