LncRNA-ATB在非小细胞肺癌细胞中的作用及其机制探讨*
2019-01-24李柏森姜鹤群文敏易红梅李涛
李柏森,姜鹤群,文敏,易红梅,李涛
[1.西南医科大学附属医院 肿瘤科,四川 泸州 646099;2.成都医学院第一附属医院 肿瘤科,四川 成都 610500;3.电子科技大学医学院附属肿瘤医院(四川省癌症防治中心),四川成都 610041;4.成都医学院第一附属医院 胸心外科,四川 成都 610500]
约80%肺癌为非小细胞肺癌(non-small cell lung cancer, NSCLC)[1],其预后差,总体生存率<20%[2]。远处转移是NSCLC死亡的主要原因[3]。因此,深入阐明其发生、发展中的分子机制有巨大的现实意义。长链非编码RNA(long non-coding RNA activated by transforming growth factor β, LncRNA-ATB)是一类转录本>200 nt的几乎不具有蛋白编码能力的RNA[4]。近年来,许多LncRNA被证实在NSCLC侵袭和转移过程中发挥重要作用[5-6]。然而,LncRNA-ATB在NSCLC中的表达及功能尚未充分阐明。本研究拟探索LncRNA-ATB在NSCLC中的表达及其功能。
1 材料与方法
1.1 材料
NSCLC和正常支气管上皮细胞(human bronchial epithelial cells, HBEC)选取2012年3月7日—2015年5月8日在四川省肿瘤医院就诊的患者。NSCLC分为A549和HCI-H23细胞。用Trizol(美国Sigma公司)提取RNA,RNA逆转录和实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction, qRT-PCR)试剂盒购自日本TaKaRa公司,qRT-PCR引物由上海生工生物工程股份有限公司合成,Transwell小室(美国Millipore公司),基质胶(美国BD公司),萤光素酶报告基因检测试剂盒(上海碧云天生物技术有限公司)。
1.2 方法
1.2.1 RNA的提取及逆转录 将细胞铺6孔板培养过夜至汇合度为80%,每孔加入1 ml Trizol裂解30 min,4℃、12 000 r/min离心5 min,上清转移至一新离心管中。加入裂解液1/5体积的氯仿,用力振荡至充分乳化。4℃、12 000 r/min离心15 min,吸取上清液至一新的离心管中,加入等体积异丙醇,上下颠倒15次,静置10 min。4℃、12 000 r/min离心15 min,弃上清,加入75%乙醇1 ml,14℃、12 000 r/min离心5 min。所得沉淀加入20μl去离子水,即为所需RNA。
1.2.2 逆转录 将 1μl RNA,2μl 5× PrimeScript RT Master,7μl去离子水轻柔混匀后,进行逆转录反应。反应条件为:37℃15 min,85℃5 s,4℃储存。
1.2.3 qRT-PCR 总反应体系25μl,具体如下:SYBR premix Ex TaqⅡ 12.5μl,正义链反义链引物各1μl,实时定量产物2μl,去离子水8.5μl。PCR反应条件为: 95℃预变性30 s,95℃变性15 s,60℃退火30 s,共30个循环。反应结束后样品保存于4℃。采用 2-ΔΔCt法计算,LncRNA-ATB/microRNA-141(miR-141)相对表达量=2-(CTLncRNA-ATB/miR-141-CTU6)待测样本-(CTLncRNA-ATB/miR-141-CTU6)校准样本。
1.2.4 Transwell实验 在 Transwell下室中加入600μl含10%胎牛血清的1640培养基(细胞侵袭实验采用预先铺好基质胶的Milipore小室,细胞转移实验采用Milipore小室),上室中加入200μl约2×105个细胞,置于细胞培养箱中培养48 h。弃上室液体,小心取出小室,湿棉签去除未穿过膜的细胞。甲醇固定2 min,结晶紫染色5 min,PBS洗涤,切下小室膜,封片。显微镜200倍视野下统计随机10个视野的细胞数,拍照并绘制统计图。
1.2.5 细胞划痕实验 将NSCLC细胞铺板,孵育过夜至细胞融合率达100%。用1 ml枪头均匀地在细胞培养孔中划痕,划痕后用PBS洗涤细胞3次,加入不含血清的培养基,拍照,此时细胞间距离为0 h距离。置于细胞培养箱中继续培养24 h,再次拍照,此时细胞间距离为24 h距离。细胞迁移距离为2次细胞间距离之差再除以2。
1.2.6 荧光素酶报告基因实验 细胞培养过夜至汇合度达70%后,共转染miR-141 mimics/miR-141 NC和pmiR-GLO-WT质粒。裂解细胞后,取10μl样品加入100μl荧光素酶检测试剂,上机测定荧光值。
1.3 统计学方法
数据分析采用SPSS 22.0统计软件,计量资料以均数±标准差(±s)表示,比较用t检验或方差分析,方差分析后的两两比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 LncRNA-ATB在NSCLC和HBEC细胞中的表达
qRT-PCR结果显示,LncRNA-ATB在HBEC细胞中的相对表达量为(1.000±0.050),在NSCLC的A549细胞中相对表达量为(4.319±0.158),在NSCLC的NCI-H23细胞中相对表达量为(4.753±0.031)。经方差分析,差异有统计学意义(F=25.417,P=0.011)。进一步两两比较经LSD-t检验,NSCLC的A549和NCI-H23细胞中LncRNA-ATB表达水平高于HBEC细胞(t=5.435和6.416,P=0.016和0.014)。见图1。
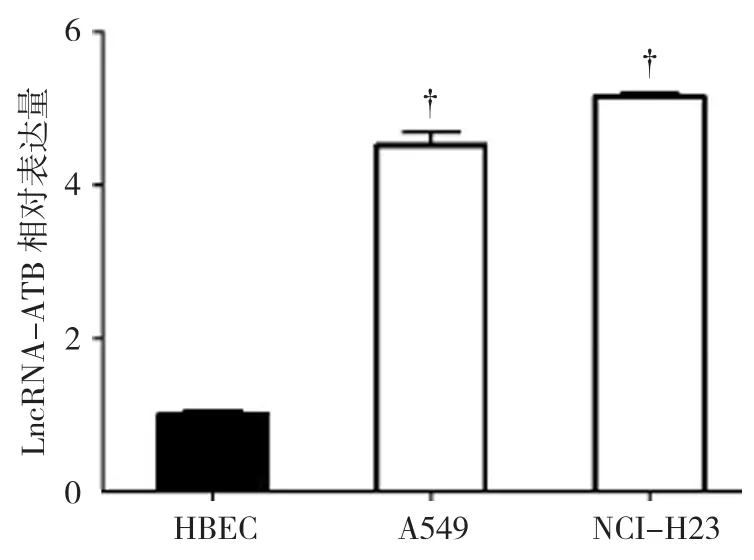
图1 NSCLC和HBEC细胞中LncRNA-ATB的表达水平比较 (±s)
本研究合成特异性沉默LncRNA-ATB表达的shRNA,qRT-PCR结果显示,转染LncRNA-ATB NC的A549和NCI-H23细胞中LncRNA-ATB的相对表达量均为(1.000±0.050);转染LncRNA-ATB shRNA的A549和NCI-H23细胞中LncRNA-ATB的相对表达量分别为(0.228±0.027)和(0.332±0.019),经t检验,两组间LncRNA-ATB表达差异有统计学意义(A549:t=5.731,P=0.021;NCI-H23:t=4.135,P=0.029)。LncRNA-ATB shRNA 可有效地沉默NSCLC细胞中LncRNA-ATB的表达(见图2)。
2.2 LncRNA-ATB与NSCLC细胞转移能力的关系
转染LncRNA-ATB NC的A549和NCI-H23细胞的相对转移细胞率为(100.0±5.0)%;转染LncRNA-ATB shRNA的A549和NCI-H23细胞的相对转移细胞率为(25.3±3.2)%和(30.9±3.8)%,经t检验,差异有统计学意义(A549:t=4.332,P=0.033;NCI-H23:t=3.451,P=0.037),沉默 Lnc-ATB可抑制NSCLC细胞的转移能力。见图3、4。
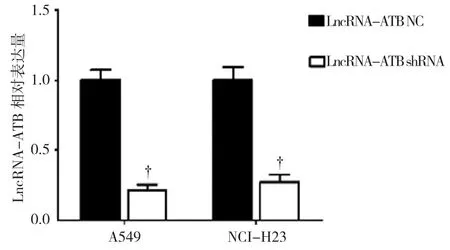
图2 转染LncRNA-ATB NC和LncRNA-ATB shRNA的A549、NCI-H23细胞中LncRNA-ATB的表达水平比较 (±s)
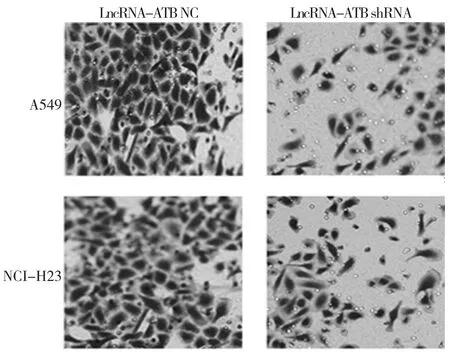
图3 LncRNA-ATB促进NSCLC细胞转移 (×200)
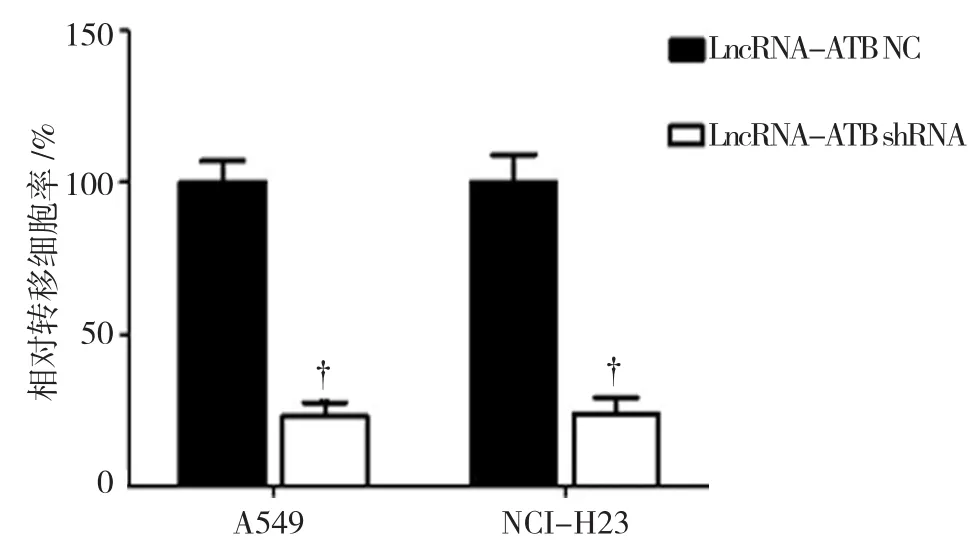
图4 转染LncRNA-ATB NC和LncRNA-ATB shRNA的A549、NCI-H23细胞的相对转移细胞率比较 (±s)
2.3 LncRNA-ATB与NSCLC细胞侵袭能力的关系
转染LncRNA-ATB NC的A549和NCI-H23细胞的相对侵袭细胞率为(100.0±5.0)%;转染LncRNA-ATB shRNA的A549和NCI-H23细胞的相对侵袭细胞率为(20.8±2.2)%和(24.9±1.7)%,经t检验,差异有统计学意义(A549:t=5.482,P=0.017;NCI-H23:t=4.513,P=0.021),沉默 Lnc-ATB可抑制NSCLC细胞的侵袭能力。见图5、6。

图5 LncRNA-ATB促进NSCLC细胞侵袭 (×200)

图6 转染LncRNA-ATB NC和LncRNA-ATB shRNA的A549、NCI-H23细胞的相对侵袭细胞率比较 (±s)
2.4 LncRNA-ATB与NSCLC细胞转移距离的关系
转染LncRNA-ATB NC的A549和NCI-H23细胞的相对转移距离均为(1.000±0.050)μm;转染LncRNA-ATB shRNA的A549和NCI-H23细胞的相对转移距离为(0.423±0.024)和(0.381±0.029)μm,经t检验,差异有统计学意义(A549:t=2.317,P=0.042,NCI-H23:t=2.726,P=0.039),沉默 Lnc-ATB可缩短NSCLC细胞的转移距离。见图7、8。
2.5 LncRNA-ATB在NSCLC细胞中吸附miR-141
生物信息学预测结果显示,LncRNA-ATB存在miR-141结合位点。荧光素酶报告基因结果显示,转染miR-141 NC和miR-141 mimics的pmirGLOLncRNA-ATB相对荧光强度分别为(1.000±0.050)和(0.346±0.029),经t检验,差异有统计学意义(t=2.817,P=0.037),miR-141 mimics可特异性地与pmirGLO-LncRNA-ATB结合,并降低其荧光强度。见图9。

图7 LncRNA-ATB延长NSCLC细胞转移距离 (×100)

图8 转染LncRNA-ATB NC和LncRNA-ATB shRNA的A549、NCI-H23细胞的相对转移距离比较 (±s)

图9 两组相对荧光强度比较 (±s)
2.6 LncRNA-ATB在NSCLC细胞中下调miR-141的表达
转染miR-141 NC的A549和NCI-H23细胞中LncRNA-ATB的相对表达量均为(1.000±0.050);转染miR-141 mimics的A549和NCI-H23细胞中LncRNA-ATB的相对表达量分别为(1.032±0.019)和(0.983±0.029),经t检验,差异无统计学意义(A549:t=0.618,P=0.295;NCI-H23:t=0.561,P=0.332),转染miR-141 mimics不能降低NSCLC细胞中LncRNA-ATB的表达水平(见图10)。转染LncRNA-ATB NC的A549和NCI-H23细胞中miR-141的相对表达水平均为(1.000±0.050);转染LncRNA-ATB shRNA的A549和NCI-H23细胞中miR-141的相对表达水平为(3.517±0.132)和(2.771±0.216),经t检验,差异有统计学意义(A549:t=5.321,P=0.009;NCI-H23:t=4.316,P=0.015),沉默NSCLC细胞中LnRNA-ATB的表达可促进miR-141的表达(见图11)。

图10 转染LncRNA-ATB NC和LncRNA-ATB shRNA的A549、NCI-H23细胞中LncRNA-ATB的表达水平比较 (±s)
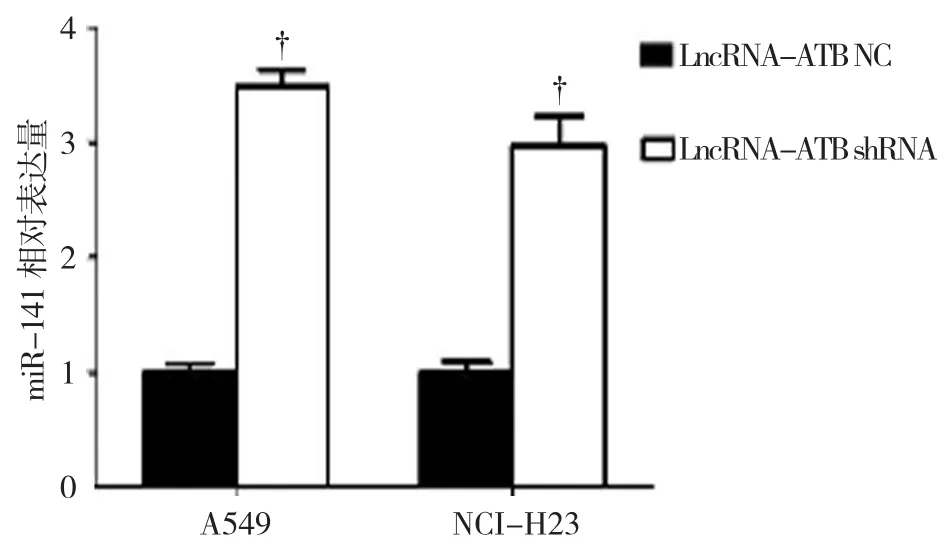
图11 转染LncRNA-ATB NC和LncRNA-ATB shRNA的A549、NCI-H23细胞中miR-141的表达水平比较 (±s)
3 讨论
LncRNA在多种肿瘤中异常表达,并与肿瘤细胞的发生、发展密切相关,是近年来研究的热点之一。LncRNA-ATB位于14号染色体(ENST00000493038),在肝细胞癌中表达上调,与肝细胞癌患者不良预后密切相关[7]。更为重要的是,多项研究表明lncRNAATB在胃癌[8]、结肠癌[9]、乳腺癌[10]及甲状腺乳头状癌[11]等多种肿瘤中异常高表达,并与肿瘤侵袭、转移密切相关。最新研究显示,LncRNA-ATB在NSCLC组织中的表达异常升高,并与NSCLC患者不良预后密切相关[12]。本研究结果显示,LncRNA-ATB在NSCLC细胞中的表达水平高于HBEC细胞。沉默NSCLC细胞中lncRNA-ATB的表达后,NSCLC的侵袭和转移能力受抑制,提示lncRNA-ATB可能在NSCLC细胞中扮演抑癌基因的角色。
值得注意的是,一些IncRNAs可以作为竞争性内源性RNA(competing endogenous RNAs, ceRNA),通过与miRNA特异性地结合而调控其靶基因。研究显示,LncRNA-HOTAIR可通过与miR-331-3p结合而调控HER2的表达,从而促进乳腺癌的进展[13]。LncRNAARSR可作为miR-34和miR-449的ceRNA,促进AXL和c-MET的表达,从而促进肾细胞癌细胞对舒尼替尼耐药[14]。在肝细胞癌中,LncRNA-ATB可作为miR-200家族的ceRNA,调控ZEB1和ZEB2的表达[7]。本研究结果显示,LncRNA-ATB可与miR-141特异性结合并调控其表达,提示LncRNA-ATB在NSCLC细胞中可能作为miR-141的ceRNA,调控NSCLC细胞的侵袭和转移。
miR-141属于miR-200家族。研究显示,miR-200家族与肿瘤干细胞形成、上皮间质转化关系密切[15]。在miR-200家族中,miR-200bc/429和miR-200a/141簇在序列上有高度同源性[16]。多项研究显示,miR-200/141可抑制头颈部鳞状细胞癌、NSCLC、女性生殖系统肿瘤和肾细胞癌等多种肿瘤细胞的侵袭、转移、增殖及耐药[17-19]。更为重要的是研究显示,在胃癌中LncRNA-ATB可与miR-141特异性结合,并降低其表达水平[20]。本研究结果显示,LncRNA-ATB在NSCLC细胞中可特异性结合miR-141,并降低其表达水平,与既往研究结果一致。此外,本研究结果显示,LncRNA-ATB可促进NSCLC细胞的侵袭和转移。结合既往文献,笔者推测LncRNA-ATB可能通过竞争性地与miR-141结合并促进其降解,而解除miR-141对下游靶基因的抑制,从而促进NSCLC细胞的侵袭和转移。值得注意的是LncRNA-ATB在乳腺癌[10]、肾癌[14]、肝癌[7]等多种肿瘤细胞中高表达,并可通过上调ZEB1、c-MET等,促进肿瘤细胞的侵袭和转移,因此LncRNA-ATB吸附miR-141仅为其促进NSCLC细胞侵袭和转移的机制之一,更为复杂的作用机制仍需进一步研究证实。
综上所述,本研究通过qRT-PCR检测NSCLC和HBEC细胞中LncRNA-ATB的表达差异,发现LncRNA-ATB在NSCLC细胞中的表达水平高于HBEC细胞。沉默NSCLC细胞中LncRNA-ATB的表达后,NSCLC细胞的侵袭和转移能力降低。研究结果显示,LncRNA-ATB在NSCLC细胞中可吸附并下调miR-141的表达。本研究进一步明确NSCLC细胞侵袭和转移的分子机制,有助于发现新的NSCLC靶向治疗靶点。
