D-半乳糖致认知障碍整体及离体模型的建立和评估
2019-01-24胡文君王淑娜李志勇缪朝玉
洪 辰,胡文君,王淑娜,李志勇,缪朝玉
(海军军医大学药学院药理学教研室,上海 200433)
认知是机体认识和获取知识的智能加工过程,涉及学习、记忆、语言、思维、精神、情感等行为。认知障碍指与上述学习记忆以及思维判断有关的大脑高级智能加工过程出现异常,从而引起学习、记忆功能障碍,任何引起大脑功能和结构异常的因素均可能导致认知障碍。随着人类寿命的延长,认知功能下降逐渐成为老龄化人群最严重的健康威胁之一,也给社会及家庭带来了沉重的经济负担和精神压力[1]。根据文献报道,2010年我国痴呆的患病人数为919万人,患病率约为9.87‰,其中阿尔兹海默症(Alzheimer′s disease, AD)患者569万人,患病率为6.25 ‰[2]。但是到目前为止,研究者们对于这些伴有认知障碍的疾病,如AD、亨廷顿氏舞蹈病(Huntington′s disease, HD)、血管性痴呆(vascular dementia, VD)以及帕金森病(Parkinson′s disease, PD)等的病因和发病机制仍不十分清楚,对于有效治疗和缓解认知障碍的药物也需要进行深入研究。所以,建立有效的整体动物和细胞水平的模型对于疾病研究和药物研发都有十分重要的意义。
D-半乳糖[D-(+)galactose, D-gal](图 1)致认知障碍模型主要原理是过量的D-gal代谢产物在细胞内蓄积,使细胞产生活性氧,对生物体造成氧化应激损伤,而该损伤则模拟动物的老化过程,造成生物体认知功能下降。海马区是与学习记忆功能联系最为紧密的区域之一,并且是成年个体大脑中少数可以产生新生神经元的区域[3-4],所以,直接在海马区神经元细胞层面进行干预可以得到与认知功能相关的更有意义和说服力的结论。根据目前的文献报道,鲜有将D-gal整体及离体模型联合应用于发病机制及药效学评价过程,特别是针对海马区神经元的D-gal离体模型较少受到关注。所以,确立这两种模型稳定的建立方法并对其功能进行评估,确定其联合应用的可行性,将会在新药研发以及阐明认知功能下降机制等研究领域发挥一定的积极作用。同时,对于用于检测啮齿类动物的学习和记忆功能的经典Morris水迷宫实验,目前仅有实验方法的报道,鲜有文献介绍该动物行为学实验的细节和经验,本实验室根据目前已报道的实验方法进行了多次实验,也总结得出一些实践经验。
1 材料与仪器
1.1 药物与试剂
D-gal购自生工生物工程(上海)股份有限公司(产品编号:A600215-0025);分子指标检测试剂盒包括Caspase-3、丙二醛(MDA)、总超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-px)、CCK8,均购自碧云天生物技术有限公司(产品编号:C1116、S0131、S0101、S0056、C0037);Neurobasal A 培养基、B27+Vitamin A supplement及GlutaMAX均购自Invitrogen公司(货号:10888022、17504044、35050-061);Accutase酶及青霉素-链霉素购自Gibco公司(货号:A11105-01、15140122);高糖DMEM培养基购自HyClone公司(货号:SH30243.01)。
1.2 仪器与设备
Morris水迷宫实验采集分析系统(型号:XR-XM101,上海欣软信息科技有限公司);M200 PRO多功能酶标仪(瑞士Tecan公司);高速冷冻离心机(型号:Neofuge13R,上海力申科学仪器有限公司)。
1.3 实验动物
SPF级7周龄C57BL/6J小鼠及生后1 d幼鼠(海军军医大学实验动物中心)。实验动物饲养在IVC系统动物房,自由饮水、进食,温度(23±2) ℃,相对湿度40%~60%,噪声≤60 dB,采用人工照明,昼夜均为12 h;生后第1 天的幼鼠当天进行实验。实验方案遵守动物福利、动物伦理及动物保护等相关规定。
2 方法
2.1 分组与处理
C57BL/6J小鼠Morris水迷宫实验:7周龄实验动物在动物房适应环境1周后,根据性别分组,进行Morris水迷宫实验。C57BL/6J小鼠制备D-gal模型:7周龄雌性小鼠在动物房适应环境1周后,随机分为模型组和对照组,模型组连续腹腔注射D-gal生理盐水溶液8周,剂量为100 mg/kg;溶剂对照组连续腹腔注射10 ml/kg体积的生理盐水溶液8周[5]。C57BL/6J小鼠海马区神经元细胞制备体外D-gal模型:将体外培养生长第8天的海马区神经元细胞随机分为对照组和实验组,实验组给予不同浓度的D-gal,对照组则采用无药物培养基,两组均处理48 h。
2.2 Morris水迷宫实验
基于Vorhees的实验方法[6],课题组对某些细节做出修改,简述如下:在黑色水盆(直径120 cm、高35 cm)内注水,维持水温在(22±1) ℃;将水染成白色并人为划分成4个象限,在其中一个象限中固定一个直径为10 cm的透明平台,平台高度保持在水平面以下1 cm;水池用帘布遮挡,悬挂方向标志物。实验连续进行,共计6 d,1~5 d是空间采集实验,第6天是探测实验。在1~5 d,动物从盆壁4个固定位置面对盆壁入水,如果60 s内未找到隐藏在水下的平台,则引导动物到平台并停留20 s;第6天,撤去平台,动物从平台所在象限的对侧盆壁最远处入水。由视频跟踪监测系统自动记录相关信息后对参数进行分析。
2.3 小鼠海马区原代神经元培养
将C57BL/6J出生第1天的幼鼠(P0~P1)预先在冰冷的75 %乙醇中处死,随后断头取脑,在显微镜下于冰冷的高糖DMEM培养液中分离海马区,去掉软脑膜,之后将海马组织剪碎,用Accutase酶消化,置于37 ℃摇床中消化10 min后,加入FBS(终浓度为10%即可)终止消化。随后在离心机中以1 000 r/min离心5 min,用接种培养基(含20 %FBS的高糖DMEM溶液)重悬后通过40 μm尼龙滤器去除组织碎片,以获得单个细胞,再用接种培养基重悬细胞,最后以250 μl/孔的细胞悬浮液接种在48孔板中或者以2 000 μl/孔的细胞悬浮液接种在6孔板中[活细胞密度为4×105个/ml,孔板预先用聚-D-赖氨酸(PDL)包被过夜],并在接种4~6 h后更换成生长培养基(Neurobasal A 培养基中添加50×B27+Vitamin A 细胞培养添加剂,0.5 %谷氨酰胺添加剂和1 %的青霉素-链霉素)。接种后隔天换液,并在接种后第3天加入阿糖胞苷(终浓度为2.5 μg/ml)处理48 h抑制胶质细胞生长,接种后第7天进行海马神经元纯度鉴别(神经元特异性标记物Tuj-1),保证神经元比例≥90%,在接种后第8天进行干预[7]。
2.4 分子生物学指标的检测
Caspase3、 丙二醛(MDA)、 总超氧化物歧化酶 (SOD)、 谷胱甘肽过氧化物酶 (GSH-px)的检测严格按照试剂盒提供的方法和步骤进行; CCK8则按照1∶10的比例将试剂加入细胞培养基中, 37 ℃孵育1 h后用酶标仪检测450 nm处的吸光度值。
2.5 统计学分析
实验数据除Morris水迷宫空间采集实验采用(均值±标准误)之外,其余均采用(均值±标准差);两组之间比较时,计量资料数据采用t检验,计数资料采用Mann-Whitney U秩和检验,多组计数资料则采用One-way ANOVA并Dunnett-t检验;以P<0.05时为两组差异有统计学意义。
3 结果
3.1 C57BL/6J小鼠Morris水迷宫实验
从1~5 d的空间采集实验结果可见(图2A),自第2天起,雄性小鼠到达平台的潜伏期始终短于雌性小鼠,但是两组小鼠到达平台期的时间并无统计学差异;在第6天的探测实验中可以发现,雄性小鼠穿越平台的次数以及在平台所在象限停留的时间均高于雌性小鼠(图2B、图2C),但差异无统计学意义。从实验结果可以看出,按照规定的实验方法能够观察到生理状态下C57BL/6J小鼠的学习曲线,两种性别小鼠的学习和记忆能力接近。
3.2 C57BL/6J小鼠制备D-gal模型Morris水迷宫实验
从1~5 d的空间采集实验结果可见,在第4天和第5天两组小鼠到达平台的潜伏期存在统计学差异(P<0.05),给予D-gal的模型组小鼠寻找平台的时间明显长于对照组(图3 A),说明模型组小鼠的学习能力较差;在第6天的探测实验中可以发现,模型组小鼠在平台所在象限停留的时间明显短于对照组(P<0.05,图3B),但两组在穿越平台次数指标中未见明显的统计学差异(图3 C),说明模型组动物的记忆功能也较差。
3.3 C57BL/6J小鼠制备D-gal模型相关分子生物学指标检测
在脑组织蛋白水平上的检测结果显示,模型组小鼠脑组织中的凋亡通路Caspase-3酶的含量(P<0.001,图4A)、MDA的含量(P<0.05,图4B)以及GSH-px的含量(P<0.05,图4C)均明显高于对照组,说明D-gal促进模型组小鼠神经元的凋亡、造成模型组脑组织脂质过氧化损伤,但两组小鼠脑组织中SOD的含量(图4 D)并无明显差异。上述实验结果证明,采用D-gal制备小鼠老化致痴呆模型成功,D-gal可以损害动物的学习和记忆功能。

图3 D-gal模型小鼠的学习记忆功能A.1~5 d到达平台的潜伏期;B.第6天穿越平台所在象限时间;C.第6天穿越平台次数*P<0.05,与对照组比较
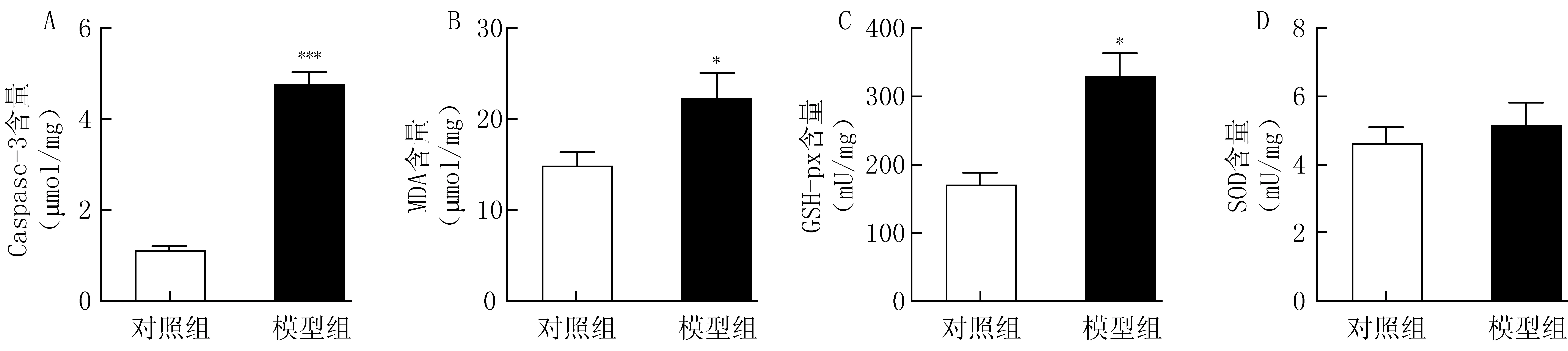
图4 D-gal模型小鼠脑组织的细胞凋亡水平和氧化应激损伤A.Casepase-3含量;B. MDA含量;C.GSH-px含量;D.SOD含量*P<0.05,***P<0.001,与对照组比较
3.4 C57BL/6J小鼠海马区原代神经元制备D-gal模型分子生物学指标检测
实验结果表明,经D-gal处理后的小鼠海马神经元,在药物作用48 h以后(图5)不同剂量的给药组与对照组相比较,从3 mg/ml浓度开始,各组细胞活力均出现显著性差异(P<0.05或P<0.001),与此同时,在30 mg/ml的剂量时可以出现肉眼可见的神经元形态改变,包括神经元数量以及神经突触减少,而在100 mg/ml的剂量时神经元只残存胞体,几乎看不到神经突触的存在,可出现明显的细胞毒性作用(图6)。在神经元细胞氧化应激分子指标上的实验结果显示,与对照组相比,各浓度梯度的D-gal刺激均可以产生对神经元的损伤作用。其中, GSH-px各剂量组和对照组相比均有明显差异(P<0.01或P<0.001,图7 A),但是SOD的含量与对照组相比,没有统计学差异(图7 B),与之前在整体模型中得出的结论一致。上述实验结果证明,采用D-gal制备的小鼠离体神经元损伤模型成功,D-gal可以对神经元造成细胞毒性以及氧化应激损伤。
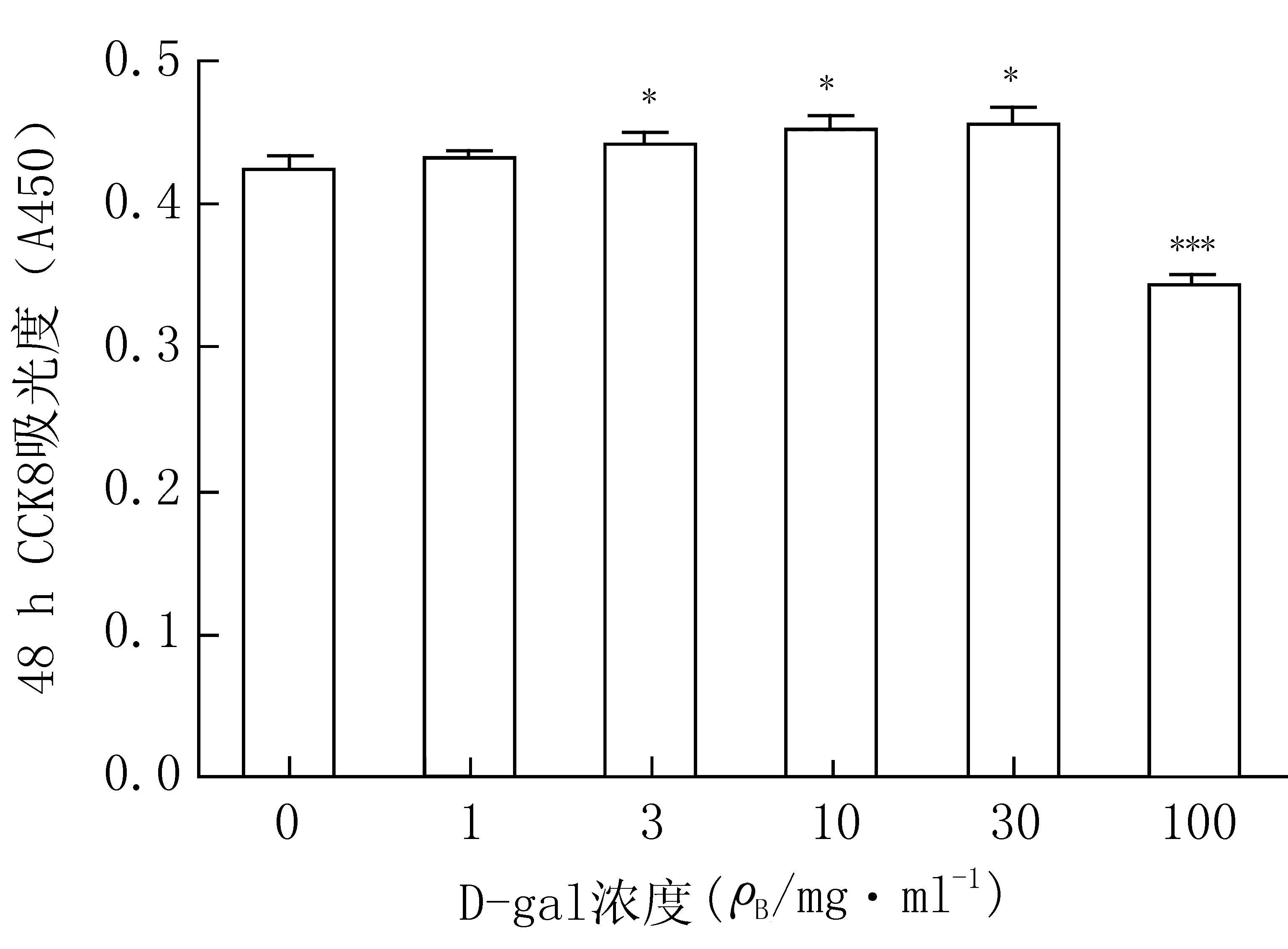
图5 不同D-gal浓度孵育48 h后对小鼠海马神经元的细胞毒性损伤作用*P<0.05,***P<0.001,与0 mg/ml组比较
4 讨论
随着社会人口老龄化的加快,越来越多的老年人出现认知功能下降,给家庭和社会带来了沉重的经济和精神负担。到目前为止,由衰老及其他疾病引发的认知功能下降的机制仍有待阐明[1],同时,尚无一个公认有效的可以改善认知功能的药物问世[8]。所以,建立有效的可以进行机制研究和新药研发的整体及离体模型显得尤为重要。D-gal模型是老年型痴呆的药效学研究模型,属于老化致痴呆模型的一个亚型。该模型的优势在于可以模拟正常个体衰老过程出现的认知障碍,方法简便易行,模型周期相对较短,并可适用于Morris水迷宫、Y迷宫、旷野实验、回避实验、高架十字迷宫等多种动物行为学实验[9],但是,氧化应激致衰老并非认知功能下降的唯一原因,所以该模型的使用也存在一定程度的局限。D-gal离体神经元模型可以弥补D-gal整体动物模型在机制研究和药物评价上的不足,其模型方法简单,相比整体动物模型而言,离体模型直接作用于海马区神经元细胞,且造模时间短,更适用于机制、分子水平和调控通路的研究。

图6 不同D-gal浓度孵育48 h后对小鼠海马神经元细胞形态的影响
而联合应用整体及离体模型的方法,可以互相取长补短,除了可以验证不同的动物表型,还可以进行药效学实验。但由于D-gal本身具有一定的毒性作用,根据文献报道[10]和实验结果,本实验室认为在D-gal整体动物模型中以100 mg/kg为推荐剂量,造模时间为8周,在这个剂量及时间下既可以出现明显的损伤效应,又不会导致不同组之间的实验动物出现明显的认知功能下降从而引起表型差异不明显的情况发生;而D-gal离体细胞模型中以10 mg/ml为推荐剂量,48 h为推荐的造模时间,在此剂量及时间下,细胞可以出现氧化应激损伤但是没有明显的形态学改变,不影响后续结果的检测。
根据目前的文献报道,鲜有将D-gal整体及离体模型联合应用于发病机制及药效学评价过程,所以本研究方法将两者结合应用可能会在新药研发以及阐明认知功能下降机制等研究领域发挥一定的积极作用。
经过多次Morris水迷宫实验发现,在前2天的训练过程中,可适当延长动物在平台上的停留时间至20 s,以便给动物更多的时间对周围环境和空间线索进行学习记忆。与此同时,在实验过程中需要密切监视每只受试动物的行为表现,由于每只动物每天共进行4次实验,对于明显不符合其他3次实验结果的数据可以考虑进行重新检测。对于在不同训练日出现波动甚至相反实验结果的实验个体可以考虑剔除或者增加训练次数。对于个别始终找不到平台的动物,除了考虑其认知功能确实下降之外,还应综合考虑水温、环境等外界因素对动物行为本身的干扰,特别是水温对于受试动物的行为影响较大。由于动物行为学实验数据存在的波动性较大,针对D-gal模型,根据荟萃分析的报道[11],有1%的文献采用不同动物行为学方法联合检测,包括Y迷宫、穿梭箱等,虽然所占比例较低,但是不失为一个优选策略。联合应用动物行为学方法可以考察不同方面的认知功能以互补长短,使结果更具有说服力。
