Fe2+/过氧化物体系氧化活性及其处理生活污水效果比较
2019-01-23刘大会蔡建波朱端卫
吴 桐,黄 雪,刘 伟,刘大会,蔡建波,4,朱端卫,4*
(1.华中农业大学资源与环境学院生态与环境工程研究室,武汉 430070;2.齐鲁工业大学(山东省科学院),山东省分析测试中心,山东省中药质量控制技术重点实验室,济南 250014;3.湖北中医药大学药学院,武汉 430065;4.湖北省生猪健康养殖协同创新中心,武汉 430070)
在我国,超过90%的农村生活污水没有经过任何处理便直接排入附近河流和湖泊[1],严重污染受纳水体。生活污水中含有的大肠杆菌、致病菌以及难降解的有机物等,对人体健康造成严重威胁[2-3]。在世界范围内,加速生活污水的处理以免除其含量较高的化学耗氧物质、氮和磷等营养因子进入水体造成河流、湖泊水体污染是当今环境保护的热点之一[4]。为此,对分散性生活污水即行处理,使之达标排放尤为迫切。
过氧化钙、过氧化镁及过氧化锌等是一类新型固体氧化剂,其兼具氧化性和释氧性,在环保方面有诸多应用,其中过氧化钙多用于有机废水和黑臭河道的治理中[5-7]。CaO2在Fe2+的催化下能与水反应生成羟基自由基(HO·)[8],可以无选择性地氧化大部分有机物甚至用常规方法难降解的有机物[9-12],有效降低水中COD[13]。同时,Fe2+本身具有的絮凝沉淀作用,对生活污水中COD的去除明显[14]。
过氧化物与Fe2+共存是一种类芬顿体系[15],两者的协同作用对有机物有良好的降解效果[16-18]。与甲基橙类似,亚甲基蓝本身是一种有机颜料,在其被氧化过程中,溶液的色度变化可以比较明显地确定类芬顿体系在Fe2+催化下的氧化能力[19]。在工程中,使用的过氧化物种类单一,大部分均为CaO2[8-11,13],且未涉及Fe2+/CaO2体系的氧化作用和絮凝沉淀作用的区分。本文选取3种过氧化物CaO2、MgO2和ZnO2,用亚甲基蓝的变化对其氧化能力进行对比。在此基础上,通过过氧化物与Fe2+的协同作用,研究其对生活污水中COD的去除效果及其工艺条件,为Fe2+/过氧化物处理生活污水提供一定的理论与技术支撑。
1 材料与方法
1.1 实验材料
本实验所用生活污水多批次取自滇池流域内经沟渠收集而未经处理直接排放的生活污水,具体地理位置为102.71°E,25.12°N,该污水的各项基本水质指标范围如表1所示。
本实验所用过氧化物为CaO2(CaO2含量75%)、MgO2(成都艾科达化学试剂有限公司产,含量30%)、ZnO2(成都艾科达化学试剂有限公司产,含量55%),按纯度计算,其有效含氧量分别为5.2、2.7 mol·kg-1和2.8 mol·kg-1。实验用亚甲基蓝、7水硫酸亚铁,均为国产分析纯,实验中亚甲基蓝溶液配制成5、10 mg·L-1浓度。
1.2 实验方法
过氧化物氧化能力的比较实验如下:
取10 mg·L-1的亚甲基蓝溶液100 mL于小白瓶中,亚甲基蓝溶液pH值约为6,通过加入稀硫酸控制小白瓶中亚甲基蓝溶液初始pH为3、4、5和7.5(原样酸度),按预备实验结果,在摩尔比为1∶2(最佳摩尔比)条件下加入Fe2+/过氧化物,每个处理均重复3次。25 ℃恒温振荡,于第0、15、30、45、60、120、180、240 min取样,测定剩余亚甲基蓝,从而求得亚甲基蓝吸光度的变化(ΔA)。
Fe2+/过氧化物处理生活污水实验如下:
(1)取400 mL生活污水于500 mL烧杯中,分别加入 0.025 g CaO2、0.970 g MgO2和 0.920 g ZnO2,再各自加入0.072 g的FeSO4·7H2O,25℃条件下用磁力搅拌器匀速(1000 r·min-1)搅拌污水,于第0、15、30、45、60、120 min取样,用JPB-607便携式溶氧仪测定生活污水Fe2+/过氧化物摩尔比(1∶2)下溶液溶解氧(DO);另取400 mL生活污水于500 mL烧杯中,通过加入稀硫酸控制污水pH为3,其他步骤同上。
(2)按Fe2+/过氧化物摩尔比(1∶2),取不同质量的过氧化物和硫酸亚铁来处理供试生活污水水样,当CaO2的质量分别为 0.025、0.050、0.100 g时,FeSO4·7H2O的质量则分别为0.036、0.072、0.145 g,将不同Fe2+/CaO2的质量从小到大记为C1、C2、C3。为保持CaO2、MgO2和ZnO2处理组间相同的有效含氧量,相同有效含氧量下MgO2的质量依次是0.490、0.970、1.94g,记为M1、M2、M3;同理,ZnO2的质量依次是0.460、0.920、1.84 g,记为 Z1、Z2、Z3;仅加入相应质量的FeSO4·7H2O而不加过氧化物的处理记为CK1、CK2、CK3。取400 mL污水于500 mL烧杯中,按上述处理将Fe2+与过氧化物加入污水中后,保持同一速度匀速(1000 r·min-1)搅拌1 h后,停止搅拌,静置1 h左右,取上清液,测定溶液COD值,并计算其COD去除率(实验温度范围为20~28℃)。

表1 供试生活污水的各项指标范围Table 1 The bound of pilot domestic sewage indicators
(3)在用稀盐酸调节污水初始pH为3和pH为5时,以CK2、C2、M2和Z2处理为代表处理污水,分别测定不同酸性条件下,Fe2+/过氧化物体系对生活污水COD的去除及去除率(实验温度范围为20~28℃)。
1.3 分析方法
本试验各项指标分析均采取国家标准分析方法[20]。
1.4 氧化及释氧过程的动力学方程拟合
氧化过程的动力学方程:
Fe2+/过氧化物体系对亚甲基蓝溶液的氧化,导致亚甲基蓝溶液的吸光度随时间而下降,这一变化过程可用一级反应动力学方程来拟合[21]:

式中:A为t时刻亚甲基蓝吸光度;A0为初始时刻亚甲基蓝吸光度;k为亚甲基蓝消失的一级速率常数,min-1。
在本实验中,亚甲基蓝初始吸光度与即时吸光度的差值ΔA能够反映过氧化物体系对亚甲基蓝溶液的氧化速率,亚甲基蓝溶液吸光度与ΔA的关系见式(2):

式中:ΔA0为亚甲基蓝溶液初始吸光度与过氧化物体系对亚甲基蓝溶液氧化达到平衡时溶液吸光度的差值。
结合式(1)、式(2)可以得到反应时间和亚甲基蓝初始吸光度与即时吸光度差值的关系式见式(3)。

释氧过程的动力学方程:
Fe2+/过氧化物在分散体系中自身还会部分分解成溶解氧,这一释氧过程由于过氧化物溶解度不同而存在一定的滞后期,可用Gompertz方程来模拟[21]:

式中:DO为t时刻分散体系中溶解氧浓度,mg·L-1;DOf为最终溶解氧浓度,mg·L-1;k为溶解氧最大释放速率,1·min-1;tc为过氧化物释放溶解氧的滞后期,min。
式(4)是理想分散系释放溶解氧过程的表达式。由于过氧化物溶解度、样品的颗粒度或比表面积等因素各异,各自过氧化物分散系释氧行为受之影响不同。为更适合描述实际过氧化物溶解释氧过程,对Gompertz方程进行修正:
令 k=Rm×e/DOf;
令tc=k-1+λ;
修正后的Gompertz方程如下:
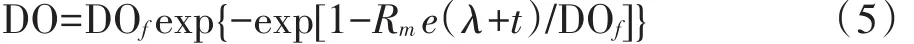
式中:DO和DOf的物理意义同式(4);Rm为修正后的溶解氧最大释放速率,mg·min-1·L-1;λ为溶解氧表观释放滞后期,min。
2 结果与讨论
2.1 pH对Fe2+/过氧化物体系氧化能力的影响
预备实验表明,不同过氧化物在Fe2+/过氧化物摩尔比为1∶2时,亚甲基蓝吸光度的变化ΔA最大,故选定1∶2的Fe2+/过氧化物摩尔比进行深入研究。图1所示,Fe2+/CaO2体系对亚甲基蓝吸光度的变化在pH范围为3~6时比较有效、平稳,在Fe2+/CaO2作用下,亚甲基蓝溶液的吸光度迅速下降,ΔA为0.8,随着pH提高至中性酸度,Fe2+/CaO2仍然保持了对亚甲基蓝强劲的氧化能力。Fe2+/MgO2和Fe2+/ZnO2体系在pH为3条件下对亚甲基蓝的氧化能力也很强,反应进行到240 min时,ΔA的变化可达0.75,与CaO2氧化能力相差无几;然而,在反应体系酸度由pH 4变化到pH 7.5的过程中,这两个体系的氧化能力迅速下降[22],ΔA下降到pH 3时的10%~20%,这很可能是在较高pH下,MgO2、ZnO2在水中的溶解度低,导致其氧化能力迅速降低。这一点与反应体系的状况有显著关系,当湿润状况下的土壤与CaO2及MgO2长时间接触,在土壤pH上升时,两种氧化剂对有机污染物的去除能力基本上没有差别[12]。
用一级反应动力学方程拟合图1中3种过氧化物对亚甲基蓝的氧化过程,相应的动力学模型的拟合结果如表2所示。
由表2中R2可知,一级反应动力学模型比较适合拟合Fe2+/过氧化物体系对亚甲基蓝的氧化反应过程,ΔA0可以代表最终氧化效率。在pH 3时,3种不同Fe2+/过氧化物体系对亚甲基蓝的最终氧化效率相差无几,但Fe2+/CaO2氧化反应速率常数k达到了2.55 min-1,是3种体系中最高的。与Fe2+/CaO2不同,Fe2+/MgO2与Fe2+/ZnO2在中酸性范围,由于氧化能力受到了限制,一级动力学方程对其描述的效果欠佳。
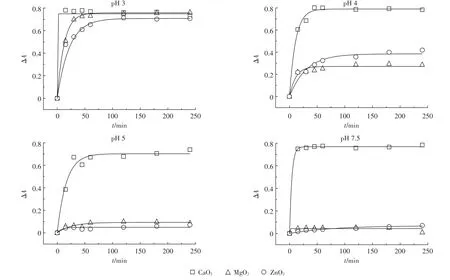
图1 Fe2+/过氧化物摩尔比为1∶2时不同pH条件下的亚甲基蓝溶液吸光度随反应时间的变化Figure 1 The absorbance change of methylene blue solution over time at different pH while the molar ratio of Fe2+/peroxide is 1∶2

表2 Fe2+/过氧化物氧化亚甲基蓝反应一级动力学模型拟合参数Table 2 Fitting parameters of the first order kinetic model in the oxidation of methylene blue by the solid peroxides
2.2 Fe2+/过氧化物体系处理生活污水时的释氧比较
在不同pH值下,对照处理及Fe2+/过氧化物处理在不同时间点测得的溶解氧(DO)如图2所示。当供试生活污水在自然pH值下,在120 min时间内,CaO2氧气释放已达到平衡,DO增加量由大到小依次是CaO2、MgO2、ZnO2(图2A)。当控制初始pH为3时,3个处理组DO在120 min内均未达到释放平衡,处理120 min后,pH值分别为3.47、6.32、3.81,其中,MgO2处理组释放的O2最多(图2B)。结果表明,Fe2+/过氧化物释氧能力也受体系pH影响较大,在控制初始pH为3时能加速过氧化物的分解反应[23]。
在处理生活污水时,不同过氧化物因溶解度不同而存在的释氧滞后期可采用Gompertz模型来描述,拟合参数见表3。
由表3中的R2值可知,修正Gompertz模型在一定程度上可以拟合Fe2+/过氧化物体系的释氧过程。拟合结果表明:在pH 3时,3种过氧化物各参数相对平稳;供试生活污水原始pH值差别较大,尽管CaO2的最大释氧速率Rm大约是MgO2的6倍,但其最大释氧量DOf比后者小34%,这可能和过氧化物中含过氧基团量的真实量有关。在原始pH下,ZnO2的DOf大幅超出水中溶解氧范围,且标准偏差太大,模拟结果没有意义;此条件下ZnO2释氧的滞后期也有类似结果,故在原始pH下ZnO2的释氧特点无法用修正的Gomp⁃ertz模型拟合。在供试生活污水原始pH下CaO2的释氧的滞后期最短,这可能与此条件下CaO2溶解度比其他2种过氧化物溶解度高有关。总之,CaO2加入水体后能更快释氧,而MgO2和ZnO2释氧较慢,这可能导致MgO2和ZnO2在应用上受到限制。

图2 不同pH条件下相同Fe2+/过氧化物摩尔量处理生活污水时DO的变化情况(A:pH 7.5;B:pH 3)Figure 2 The change of DO during the process of treating sewage wastewater with the same molar ratio of peroxide at different pH(A:pH 7.5;B:pH 3)
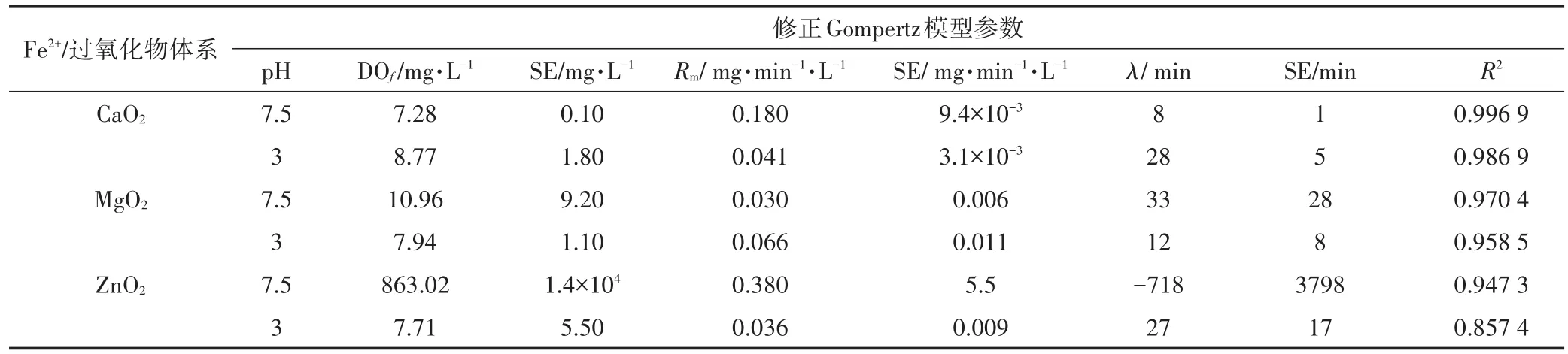
表3 Fe2+/过氧化物释氧过程的修正Gompertz模型拟合参数Table 3 Fitting parameters of Gompertz model in the release of dissolve oxygen by the solid peroxides
过氧化物在水中的反应分为两部分,首先与水反应生成对应的碱与H2O2,第二步生成的H2O2分解产生O2,所以既能分解产生H2O2,也能直接产生O2,产生H2O2的量多,还是产生的O2量多,与水体的pH值有关。pH越低,H2O2产量越高,O2产量越低;pH越高,H2O2产量越低,O2产量越高[24]。在常温下和一个大气压强下,自然水体中的DO浓度一般在7~8 mg·L-1[25]。本实验中,供试生活污水的起始DO在1.5~2 mg·L-1,仅为自然水体DO浓度的1/4上下。随着时间的推移,过氧化物释氧量逐渐增大,达到释氧平衡时,水中DOf增加到近8 mg·L-1。
2.3 不同条件下Fe2+/过氧化物去除生活污水COD的比较
Fe2+/过氧化物对生活污水COD的去除,不仅要考虑到过氧化物的氧化作用,还要考虑Fe2+的絮凝作用[26]。在保持CaO2、MgO2和ZnO2处理对应的有效含氧量相同时,Fe2+/过氧化物处理生活污水的结果如图3所示。在生活污水pH条件下,CaO2、MgO2、ZnO2处理组对COD的去除率平均在50%~60%。CaO2、ZnO2处理组对COD的去除规律一致,都是随着Fe2+/过氧化物质量的增加而去除率增加,其中ZnO2处理组随着用量的增加,COD去除率增加幅度更明显。对照组和MgO2处理组对COD的去除规律一致,都随着Fe2+/过氧化物质量的增加而去除率降低。究其原因,Fe2+本身具有还原性,产生的羟基自由基会有一部分参与到氧化Fe2+的过程中,这部分Fe2+相当于一部分COD,对照组中随着Fe2+的量越大,造成Fe2+过量,使测得的COD表观值增加。因为MgO2在水中可能分解为过氧化氢和氢氧化镁,氢氧化镁对水体的碱化作用使其对溶液pH值产生影响,继而影响Fe2+的絮凝沉淀,间接影响了COD值的变化[12]。截止目前,有关CaO2、MgO2、ZnO2等溶解度及其对溶液性质的影响尚缺乏深入研究[27]。
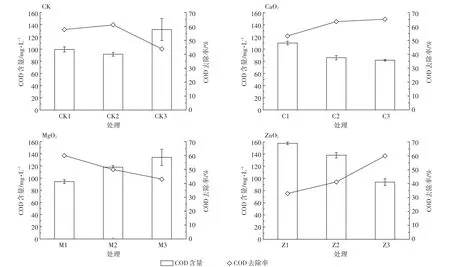
图3 不同Fe2+/过氧化物质量处理污水时COD及其去除率的变化Figure 3 The change of COD and its removal rate during the process of treating sewage wastewater with different quality of Fe2+/peroxide
对于COD浓度为235 mg·L-1的生活污水,在初始pH为3和5的条件下,当Fe2+/过氧化物摩尔比为1∶2时,不同过氧化物对生活污水的处理效果如图4所示。对照处理对污水COD的去除率明显较低,说明与生活污水本身相比,在pH 3到pH 5条件下,仅有Fe2+,体系的絮凝作用不强。研究表明,Fe2+发生絮凝的适宜pH为6左右[28],而在初始pH为5条件下,CaO2、MgO2、ZnO2处理对COD的去除率比对照显著增加,尤其是在pH 3条件下MgO2处理的去除率增加到70%左右。研究结果表明,MgO2处理组需要在pH 3的强酸性条件下才能发挥较明显的作用。即使如此,在pH 3的起始条件下,MgO2对COD的去除效果仍低于CaO2[29]。
图4结果还表明,Fe2+/过氧化物在较强酸度下处理生活污水,与其氧化亚甲基蓝的结果一致,如当污水初始pH为3,4 L污水中加入0.25 g CaO2时COD的去除率能达到74.9%,说明pH对Fe2+/过氧化物去除COD有显著影响,pH越低时效果越好。
在实际生活污水中,过氧化物在Fe2+存在时的氧化作用对污水中COD去除增加量只占COD去除总量的小部分,以Fe2+/CaO2为例,当CaO2的质量分别为0.025、0.050、0.100 g时,Fe2+/CaO2处理对COD的氧化量仅比对照处理分别高-7.5%、3.1%和33%(图3),而原有的Fe2+和反应产生的Fe3+导致的絮凝沉淀却占主导作用[30];比较图3和图4,C2处理在pH 7.5下,对COD的去除率仅比对照高3%,在pH 5下,对COD的去除率比对照高60%,即pH 5条件下比pH 7.5时,Fe2+/CaO2对COD的氧化作用增加近30倍。Fe2+/过氧化物体系氧化处理废水COD时还会去除一些用常规混凝沉淀法所不能去除的其他物质[12,31]。实际上,在可生化性较好的污水中,Fe2+/过氧化物体系可对其中氨氮、硫化物等强还原性物质发生氧化作用[32],这种作用可能消耗部分活性氧,降低过氧化物对COD的氧化作用,导致其氧化难降解有机物的优势并未得到充分发挥[9]。
3 结论
在Fe2+与过氧化物的摩尔比为1∶2的最佳条件下,对Fe2+/过氧化物体系氧化能力及其对生活污水COD的去除效率进行比较:
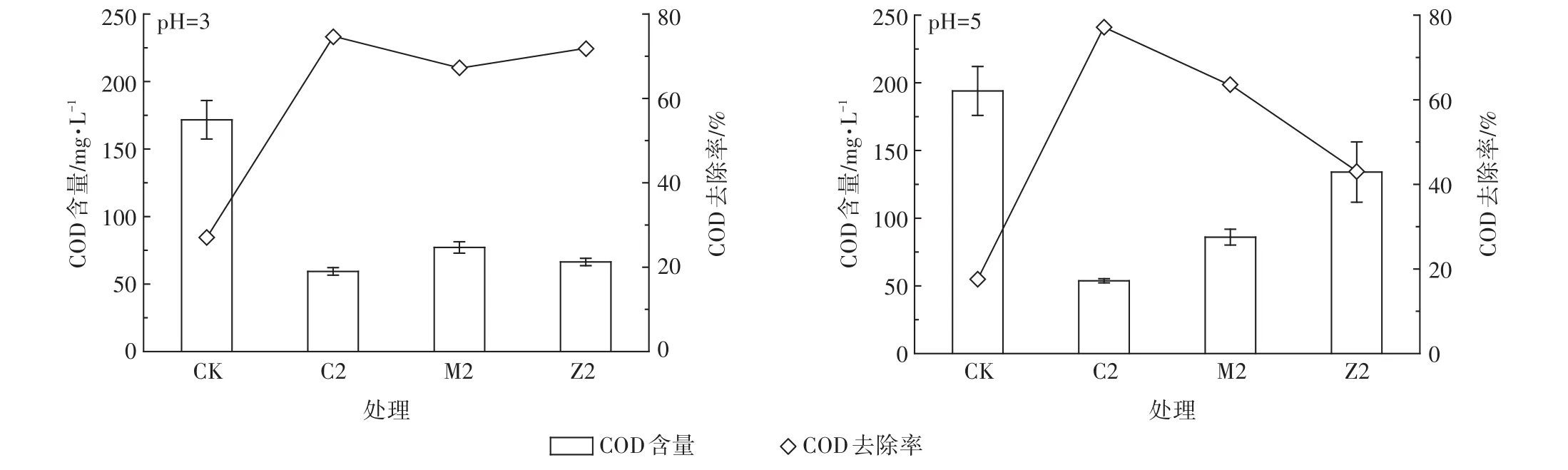
图4 不同酸性下Fe2+/过氧化物处理生活污水时COD及其去除率的变化Figure 4 The change of COD and its removal rate during the process of treating sewage wastewater by using Fe2+/peroxides with same molar ratio
(1)在pH 3~7.5范围内,pH越低,Fe2+/过氧化物产生HO·越多,且CaO2的氧化速率始终高于MgO2、ZnO2。
(2)Fe2+/CaO2的释氧速率比 Fe2+/MgO2、Fe2+/ZnO2更快,在3种供试的Fe2+/过氧化物对生活污水COD去除效果中,Fe2+/CaO2的效果最好。
(3)在自然pH条件下,Fe2+/过氧化物体系对生活污水COD的去除以Fe2+的絮凝沉淀作用为主,当调节生活污水pH为5时,体系对COD的氧化作用明显加强。
