羊乳酪蛋白酶解物对HepG2细胞胰岛素抵抗的改善作用
2019-01-22罗钦文王媛高兢毛学英
罗钦文,王媛,高兢,毛学英
(中国农业大学食品科学与营养工程学院,北京100083)
0 引言
糖尿病是当今社会一个重大的流行性疾病,其在全球的发病率连年升高,目前已成为世界上仅次于心脑血管疾病、肿瘤的第三位对人类健康有严重威胁的慢性疾病。国际糖尿病联盟(IDF)发布的糖尿病地图显示,2017年全球已有4.25亿人患有糖尿病,预计到2045年全球糖尿病患病人数将达到6.29亿。其中,中国的成人糖尿病患者数量高达1.14亿,位居第一位[1]。糖尿病主要分为一型糖尿病、二型糖尿病和妊娠期糖尿病,其中二型糖尿病最为普遍,占发病总人数的90%~95%[2-3]。目前糖尿病的治疗以西药为主,主要包括:磺脲类、双胍类、噻唑烷二酮类、二肽基肽酶-Ⅳ抑制剂等[4]。但是,这些药物都存在一定的副作用,如体重增加、骨质流失、胃肠道不良反应等[5-6]。因此,安全、无副作用的天然活性物质成为目前降糖研究的一大热点。在众多的天然活性物质中,生物活性肽因其安全性高、不良副作用小、生物活性多样化而最受关注[7-8]。羊乳作为一种天然营养食品,富含蛋白质、维生素、脂肪和矿物质,蛋白质的氨基酸组成也与母乳极为接近[9]。在近年的研究中发现,羊乳及其蛋白肽具有多种生物活性,如抑菌、降血压、抗氧化、抗癌[10-13]。但是,关于羊乳蛋白肽改善胰岛素抵抗的研究尚未见诸报道。因此,本研究采用风味蛋白酶水解羊乳酪蛋白制备羊乳酪蛋白酶解物,以葡萄糖利用率和细胞内糖原含量为指标评价其对高浓度葡萄糖诱导HepG2细胞胰岛素抵抗的改善效果,以期为羊乳蛋白及其活性肽的开发提供理论依据。
1 材料与方法
1.1 材料与试剂
Hep G2细胞购自北京协和医院;羊乳粉(内蒙古华颐乐牧业科技有限公司);M EM培养基;胎牛血清;青链霉素双抗溶液(100×);非必需氨基酸(100×);0.25%胰蛋白酶(Gbico);风味蛋白酶(诺维信公司);葡萄糖测定试剂盒(南京建成生物工程研究所);糖原测定试剂盒(南京建成生物工程研究所)。
1.2 仪器设备
DK-8B型电热恒温水浴锅,FE20型pH计,TGL-20 M型低温高速离心机,LGJ-12型真空冷冻干燥机,MCO-17 AC二氧化碳培养箱,DK-98-Ⅱ2KW型超净工作台,SCIENTZ-ⅡD细胞超声破碎仪,iMarkTMMicroplate Reader酶标仪。
1.3 实验方法
1.3.1 羊乳酪蛋白酶解物制备
将羊乳酪蛋白水化,调节温度为55℃,pH为7.0,按照质量分散为5%酶与底物比加入风味蛋白酶水解,于0.25,0.50,0.75,1,2,3,4,5h时取样,85℃ 15 min灭酶,冻干,得到羊乳酪蛋白酶解物。
1.3.2 水解度测定[14]
采用三硝基苯磺酸(TNBS)法测定羊乳酪蛋白酶解物的水解度。吸取0.5 mL的已灭酶的样品,冷却并转移至25 mL容量瓶中,用1%十二烷基硫酸钠(SDS)溶液定容静置。取0.125 mL酶解液的SDS溶液与1 mL磷酸缓冲液(pH 8.2,0.2 mol/L)和1 mL的0.1%的TNBS溶液振荡混合,于50℃水浴避光反应60 min,反应完毕之后,加入2 mL 0.1mol/L的HCl立即终止反应,室温放置30 min后,于420 nm下测定其吸光度值。0~5.0×10-3mol/L L-亮氨酸做标准曲线。按照公式(1)计算水解度。
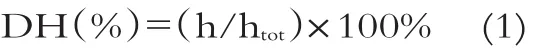
式中:h——水解物中每克被裂解的肽键毫摩尔数(m eq/g protein)
htot——每克原料蛋白质中的总的肽键毫摩尔数,酪蛋白为8.2 m eq/g protein
1.3.3 高浓度葡萄糖刺激H ep G2细胞建立胰岛素抵抗模型[15]
将HepG2细胞以1×105个/μL的密度接入细胞培养板中,贴壁生长24 h后,加入终浓度为30 mmol/L的葡萄糖溶液,孵育24 h。最后加入终浓度为100 nmol/L的胰岛素刺激30 min,即成功建立高浓度葡萄糖诱导的Hep G2细胞胰岛素抵抗模型。
1.3.4 HepG2细胞葡萄糖利用率测定
采用葡萄糖氧化酶-过氧化物酶法测定葡萄糖含量。将HepG2细胞以1×105个/mL的密度接入96孔板中,贴壁24h。实验组细胞添加刺激物和蛋白酶解物(终浓度为1.0 mg/mL),模型对照组添加刺激物,空白对照组添加等体积无菌PBS缓冲液,孵育24h。最后加入终浓度为100 nmol/L的胰岛素刺激细胞30 min,吸取上层培养基,用葡萄糖测定试剂盒测定葡萄糖浓度,按公式二计算细胞葡萄糖利用率。
公式二:葡萄糖利用率(%)=(C1+C 2-C 3)/(C 1+C 2)×100%
式中:C 1—原培养基中葡萄糖含量(5.55 mmol/L);
C 2—葡萄糖添加量;
C 3—上层培养基中的葡萄糖含量(mmol/L)
1.3.5 HepG2细胞内糖原含量测定
将Hep G 2细胞以1×105个/mL的密度接入96孔板中,贴壁24 h。实验组细胞添加刺激物和蛋白酶解物(终浓度为1.0 mg/mL),模型对照组添加刺激物,空白对照组添加等体积无菌PBS缓冲液孵育。最后加入终浓度为100 nmol/L的胰岛素刺激细胞,吸取上层培养基,收集细胞,按照糖原测定试剂盒步骤测定细胞中的糖原含量。
1.3.6 体外模拟胃肠消化[16]
将羊乳酪蛋白酶解物溶于蒸馏水中,用1mol/L HC l调节p H值至2.0。加入胃蛋白酶(酶与底物质量比为1:40),在37℃下振荡孵育1.5 h。孵育结束后,取出一半溶液,80℃加热20 min,冻干后得到胃消化样品。另一半溶液用1 mol/L N aOH调节pH至7.5,加入胰酶(酶与底物质量比为1∶100),在37℃下振荡孵育2.5 h。之后溶液在80℃加热20 min,冻干后得到胃肠消化样品。
1.3.7 数据统计
采用SPSS 20.0统计软件进行one-way ANOVA和Duncan's multiple-comparison test分析组间差异,以P〈0.05为显著性,各组数据以平均值±标准差表示。
2 结果与分析
2.1 羊乳酪蛋白酶解物对高糖刺激Hep G2细胞葡萄糖利用率的影响
利用风味蛋白酶水解羊乳酪蛋白,不同时间酶解产物的水解度及其对HepG2细胞胰岛素抵抗模型葡萄糖利用率的影响如图1所示。随着酶解时间的延长,羊乳酪蛋白酶解物的水解度逐渐增加。当浓度为0.25 mg/mL时,与羊乳酪蛋白处理组细胞相比,羊乳酪蛋白风味蛋白酶酶解物处理组细胞的葡萄糖利用率显著升高,表现出一定的改善胰岛素抵抗的作用。这说明风味蛋白酶的酶解作用促进了羊乳酪蛋白中活性序列的释放。其中3 h酶解产物作用的细胞葡萄糖利用率最高,达到51.9±0.3%,与原蛋白处理组细胞相比提高了29.5%。因此,我们选用风味蛋白酶3 h酶解产物进行后续实验。
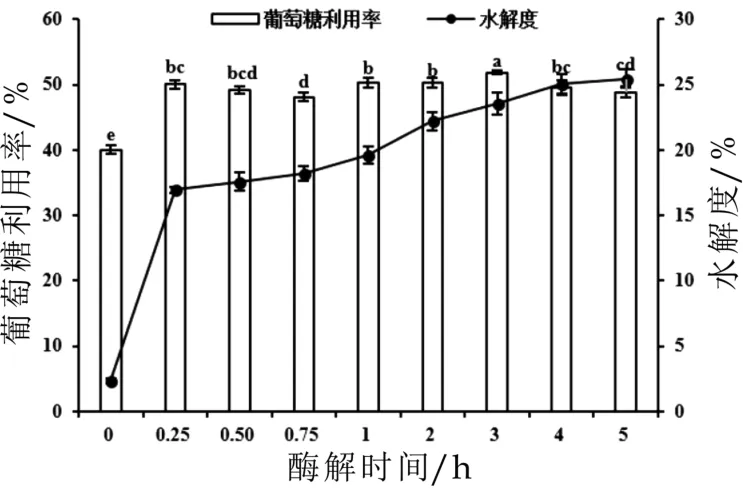
图1 羊乳酪蛋白酶解物(风味蛋白酶,3 h)水解度及对高糖刺激HepG2细胞葡萄糖利用率的影响
2.2 羊乳酪蛋白酶解物对高糖刺激HepG2细胞糖原含量的影响
羊乳酪蛋白酶解物对高糖刺激Hep G2细胞内糖原含量的影响如图2所示。30 mmol/L葡萄糖刺激Hep G2细胞后,细胞内的糖原含量降低至空白对照组的61.9±2.9%。而0.25,0.5,1.0 mg/mL羊乳酪蛋白酶解物处理则显著提高了细胞内的糖原含量且呈现剂量依赖效应(分别为空白对照组的70.3±2.5%,72.7±4.7%,83.3±4.0%)。说明羊乳酪蛋白酶解物能够促进高糖刺激的HepG2细胞糖原合成,进而促使葡萄糖转化为糖原,从而提高葡萄糖利用率。
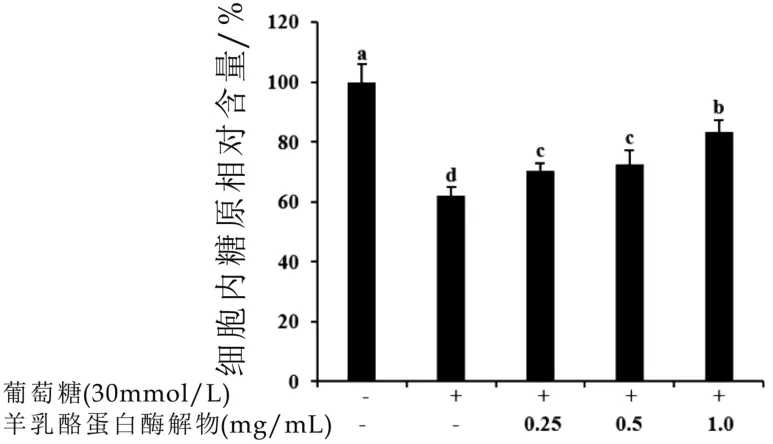
图2 羊乳酪蛋白酶解物(风味蛋白酶,3 h)对高糖刺激HepG2细胞内糖原含量的影响
2.3 模拟胃肠消化作用对羊乳酪蛋白酶解物促进葡萄糖利用活性的影响
胃肠模拟消化作用对羊乳酪蛋白酶解物促进葡萄糖利用活性的影响如图3所示。当采用终浓度为0.25,0.5,1.0 mg/mL羊乳酪蛋白酶解物处理细胞后,胰岛素抵抗模型细胞的葡萄糖利用率显著升高,且呈现一定的剂量依赖效应。羊乳酪蛋白酶解物经模拟胃消化、模拟胃肠消化后,其促进葡萄糖利用的活性并未发生明显改变。

图3 胃肠模拟消化作用对羊乳酪蛋白酶解物促进葡萄糖利用活性的影响
2.4 模拟胃肠消化作用对羊乳酪蛋白酶解物促进糖原合成活性的影响
胃肠模拟消化作用对羊乳酪蛋白酶解物促进糖原合成活性的影响如图4所示。当采用终浓度为0.25,0.5,1.0 mg/mL羊乳酪蛋白酶解物处理细胞后,胰岛素抵抗模型细胞的糖原含量显著升高,且呈现一定的剂量依赖效应。羊乳酪蛋白酶解物经模拟胃消化、模拟胃肠消化后,其促进糖原合成的活性并未发生明显改变。
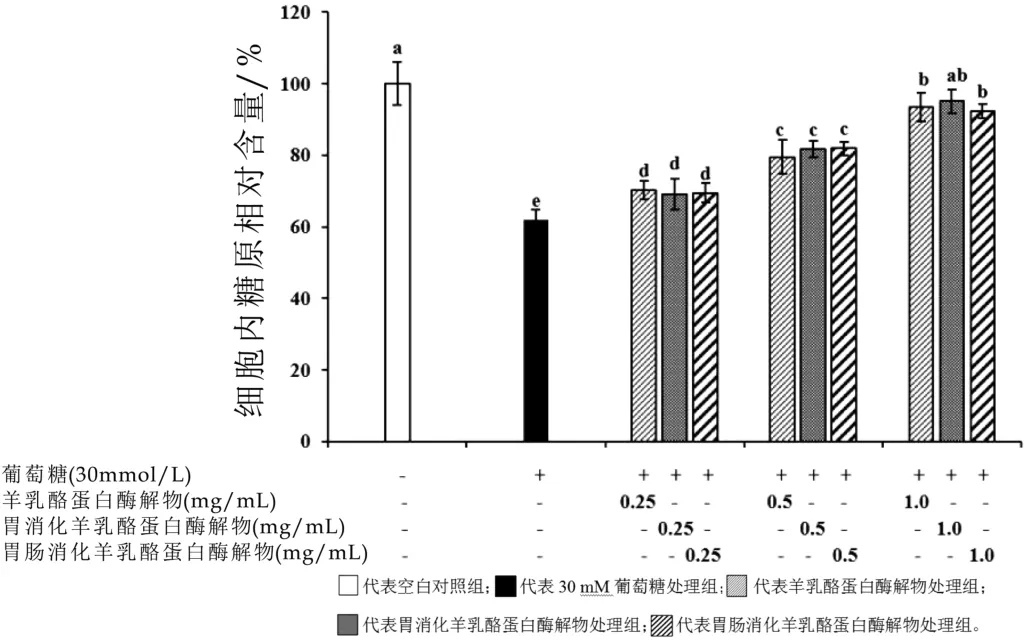
图4 胃肠模拟消化作用对羊乳酪蛋白酶解物促进糖原合成活性的影响
3 讨论
糖尿病是一种严重威胁人类健康的代谢性疾病,可导致神经病变、肾病、视网膜病变以及心血管疾病等一系列的并发症[17]。在机体内,肝脏是摄取、储存、合成和分解葡萄糖的主要场所,在维持血糖稳定过程中起着非常重要的作用[18]。在糖尿病患者体内,肝脏代谢发生改变,胰岛素对糖原合成的促进作用和对糖异生的抑制作用降低,出现胰岛素抵抗,进而造成高血糖症[19]。已有多项研究表明,生物活性肽具有肝脏胰岛素抵抗的功能。Boonloh等人研究了米糠蛋白水解物(RBP)对Hep G2细胞胰岛素抵抗和炎症反应的影响。结果发现,RBP缓解了胰岛素抵抗状态下Hep G2细胞的葡萄糖利用损伤,抑制了炎症反应,并促进了AM PK信号通路的激活[20]。Song等人通过体外实验研究表明,来源于酪蛋白糖巨肽的肽段IPPKKNQKTE能通过激活AM PK信号通路提高Hep G2肝细胞葡萄糖摄取和糖原合成水平,降低糖异生水平,进而改善肝细胞胰岛素抵抗[15]。与以往的研究结果类似,在本实验中,羊乳酪蛋白酶解物有效促进了高浓度葡萄糖诱导的Hep G2细胞的葡萄糖利用和糖原合成(图1-图2),说明其具有良好的体外改善胰岛素抵抗活性。
生物活性肽由氨基酸组成,对存在于胃肠道中的蛋白酶具有非常强的敏感性,经胃肠道消化后,其活性会减弱或增强[21]。因此,在生物活性肽开发利用过程中,胃肠消化稳定性研究至关重要。体外模拟胃肠消化模型(SGM)是目前公认的一种初步确定肽的生物利用度的方法[22]。因此,在本研究中,我们测定了体外模拟胃肠消化后羊乳酪蛋白酶解物促进Hep G2细胞葡萄糖利用和糖原合成活性的变化。结果发现,经过胃消化、胃肠消化的羊乳酪蛋白酶解物处理组细胞与未经消化的羊乳酪蛋白酶解物处理组细胞相比,其葡萄糖利用率和细胞内糖原含量并无显著变化(图3-图4)。说明在胃肠消化过程中,羊乳酪蛋白酶解物改善胰岛素抵抗的活性并没有破坏。
4 结论
本研究证明羊乳酪蛋白酶酶解物对高浓度葡萄糖诱导的HepG2细胞胰岛素抵抗具有良好的改善效果。当浓度为0.25 m g/m L时,羊乳酪蛋白风味蛋白酶酶解物处理组细胞葡萄糖利用率显著高于羊乳酪蛋白原蛋白处理组细胞;羊乳酪蛋白酶解物还能显著提高HepG2细胞胰岛抵抗模型细胞内的糖原含量。体外模拟胃肠消化作用对羊乳酪蛋白酶解物促进葡萄糖利用和糖原合成的活性并无显著影响。本研究结果可为羊乳酪蛋白源生物活性肽的开发提高一定的理论依据。在后续研究中,本课题组将对羊乳酪蛋白酶解物进行分离纯化,鉴定活性氨基酸序列,并对其改善胰岛素抵抗的作用机制进行进一步研究。
