基于UHPLC-LTQ-Orbitrap的发酵玫瑰茄化学成分筛查和研究
2019-01-22王喻淇梅晓丹张加余
王喻淇,梅晓丹,李 洁,宋 帅,马 涛,林 峰,,张加余
(1.北京中医药大学中药学院,北京 102400;2.江苏朸健生命科技发展有限公司,北京 100176;3.北京中医药大学北京中医药研究院,北京 100029)
玫瑰茄(HibiscussabdariffaL.)又名洛神花、红果梅以及红角葵等,为锦葵科(Malvaceae)木槿属一年生草本植物,原产于西非至南亚,现广泛分布于全球热带和亚热带地区,我国台湾、福建、广东和云南南部等地大规模引入栽培[1]。作为一种药食两用植物,玫瑰茄含丰富的有机酸,例如木槿酸、柠檬酸和原儿茶酸等[2-3]。木槿酸是玫瑰茄花萼中的一种特殊物质,对心脏病、高血压、动脉硬化等有较好的疗效。此外,玫瑰茄含有的黄酮类、花色素类、木脂素类、还原糖类成分对肠道具有抑菌作用,并能促进胆汁分泌,预防心血管疾病[4-8]。因此,玫瑰茄素有“植物红宝石”的美誉。
玫瑰茄特有的营养价值、保健价值及药用价值决定了其具有广阔的应用开发前景。然而,玫瑰茄富含酚酸类成分,口感酸涩,直接食用或饮用对胃肠道具有一定的刺激性,导致相关产品的商品形式较为单一,资源利用不充分[9-11]。玫瑰茄发酵后口感醇厚、酸甜适宜,已被广泛用于制作发酵饮料和发酵果酒等[12-13]。鉴于玫瑰茄发酵后的化学物质基础尚不明确,本研究将基于UHPLC-LTQ-Orbitrap MS技术阐明玫瑰茄发酵过程中主要化学成分的变化,以期促进玫瑰茄资源的开发和利用,并为其发酵研究提供相关数据。
1 实验部分
1.1 仪器与装置
DIONEX Ultimate 3000高效液相色谱仪,LTQ-Orbitrap XL质谱:美国Thermo Scientific公司产品,配有电喷雾离子源(ESI)和Xcalibur 2.1工作站;R200D型电子分析天平(十万分之一):德国Sartorius公司产品;Millipore Synergy UV型超纯水机:美国Millipore公司产品;KQ-250 DE型数控超声波清洗器:昆山市超声仪器有限公司产品。
1.2 试剂与材料
没食子酸、儿茶素、槲皮素、原儿茶酸和矢车菊-3-O-葡萄糖苷等5种对照品:纯度均不低于98%,成都曼思特生物科技有限公司产品;甲醇、甲酸:均为质谱级,美国Fisher公司产品;超纯水:由Millipore超纯水机制备。
玫瑰茄药材:购自亳州市华云中药饮片有限公司,经北京中医药大学张媛副教授鉴定为锦葵科木槿属草本植物玫瑰茄(HibiscussabdariffaL.)的干燥花萼。
1.3 溶液配制
混合对照品溶液的制备:分别取适量上述5种对照品,精密称定,加入甲醇制成浓度约为100 mg/L的储备液,使用时稀释成适宜浓度的混合对照品溶液。
玫瑰茄供试品溶液的制备:取30 g玫瑰茄药材粉末,精密称定,加入300 mL水混合搅拌均匀后,加入一定量的K2HPO4、NaHCO3等,调至pH 5.8~6.0;然后加入20 g蛋白胨、80 g白砂糖,定容至1 000 mL;在90 ℃水浴条件下灭菌30 min后,以0.22 μm微孔滤膜过滤,即得供试品溶液。
发酵玫瑰茄供试品溶液的制备:取30 g玫瑰茄药材粉末,精密称定,加入300 mL水混合搅拌均匀后,加入K2HPO4调至pH 4.5~5.0;然后在混合液中添加1 g纤维素酶、1 g果胶酶,于50 ℃下酶解90 min;加入K2HPO4、NaHCO3等,调至pH 5.8~6.0,再加入20 g蛋白胨、80 g白砂糖,定容至1 000 mL;溶液在90 ℃水浴条件下灭菌30 min,待温度降至室温,接种肠膜明串株菌肠膜亚种发酵(培养温度25 ℃,发酵20天);取发酵后溶液过滤,滤液过0.22 μm微孔滤膜,即得供试品溶液。
1.4 实验条件
1.4.1色谱条件 Agilent Zorbax SB C18色谱柱(250 mm×4.6 mm×5 μm);流动相:0.1%
甲酸水溶液(A)-甲醇(B);梯度洗脱条件:0~10 min(5%B),10~16 min(5%~11%B),16~66 min(11%~51%B),66~70 min(51%~55%B);流速1 mL/min;柱温25 ℃;进样量10 μL。
1.4.2质谱条件 ESI离子源,负离子检测模式;流动相经柱后分流进入质谱检测器的流速为0.3 mL/min;毛细管温度350 ℃;鞘气流速9 L/min;辅助气流速3 L/min;喷雾电压3.0 kV;毛细管电压—35 V;管透镜电压—110 V;源内碰撞诱导裂解池碰撞能量(CID)35%。样品采用高分辨FT进行全扫描(full scan, FS),一级扫描分辨率30 000,质量扫描范围m/z50~1 000。
1.5 数据处理
利用Xcalibur2.1工作站进行数据处理,采用分子式预测模块预测所有母离子的分子式,相关参数设定为C[0-35]、H[0-50]、O[0-30]、环不饱和双键数(RDB equivalent value)[0-15],质量精度误差在5×10-6以内。
2 结果与讨论
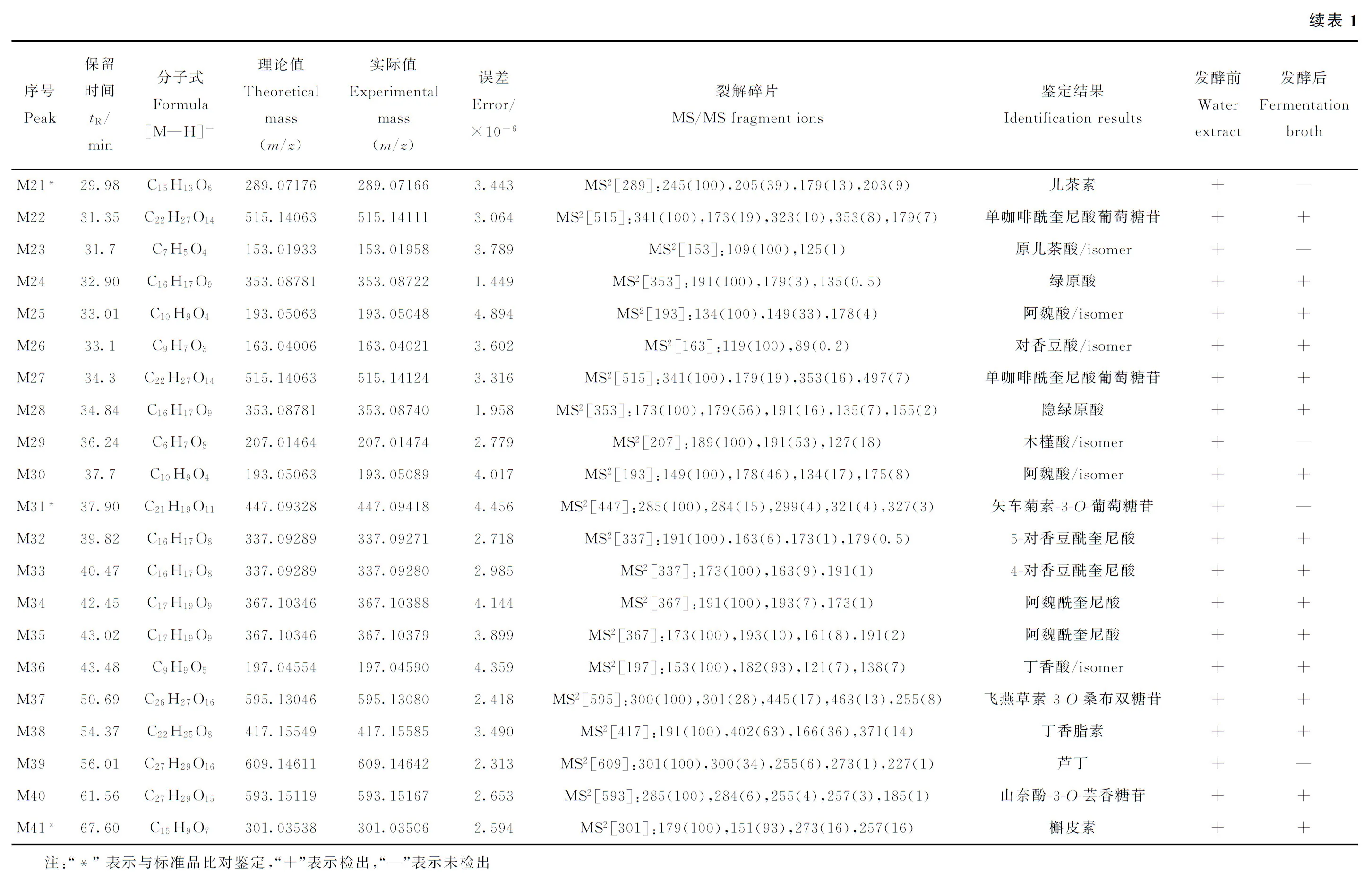
采用HPLC-LTQ-Orbitrap MS法分析鉴定玫瑰茄发酵前后的化学成分。根据所获得的精确分子质量,结合相应的色谱保留行为、质谱裂解规律、特征碎片离子以及与对照品比对,最终鉴定出41种化学成分,其中有5种化学成分被准确鉴定,结果示于图1和表1。

图1 玫瑰茄发酵前后的总离子流图Fig.1 TIC of water extract and fermentation broth of Hibiscus sabdariffa L.

2.1 有机酸类成分的鉴定
有机酸是玫瑰茄中含量最高的一类成分,具有抗氧化、抗癌、抗炎症等作用。本实验从玫瑰茄提取液中鉴定出34种有机酸类成分,包括16种绿原酸类和18种小分子酚酸类;从玫瑰茄发酵液中鉴定出29种有机酸类成分,包括15种绿原酸类和14种小分子酚酸类。
2.1.1绿原酸类成分的鉴定 绿原酸类成分是由反式肉桂酸,如咖啡酸(caffiec acid)、阿魏酸(ferulic acid)、对香豆酸(p-coumaric acid)和奎尼酸(quinic acid)及其衍生物缩合而成的酯类化合物。根据奎尼酸单元羟基成酯的数目,绿原酸类成分可大致分为单酯类、二酯类、三酯类等。
M19、M32和M33的准分子离子峰[M—H]-分别为m/z337.092 44、337.092 71、337.092 80,推断它们可能的分子式为C16H17O8,误差在±5×10-6范围内。在ESI-MS2质谱图中主要的特征碎片离子为m/z191[quinic acid—H]-、m/z173[quinic acid—H—H2O]-和m/z163[p-
coumaric acid—H]-。研究表明[14-15],当对香豆酰基的酯化位置在3、4或5位时,所产生的ESI-MS2基峰离子分别为m/z163、173、191。结合该类成分的反相色谱保留行为,分别将M19、M32和M33鉴定为3-对香豆酰奎尼酸、5-对香豆酰奎尼酸和4-对香豆酰奎尼酸。
M10、M24和M28的准分子离子峰[M—H]-均为m/z353.087 81,其可能的分子式为C16H17O9,误差在±5×10-6范围内。分析三者的ESI-MS2碎片离子的种类,可知它们均属于单咖啡酰奎尼酸类成分。单咖啡酰奎尼酸类化合物在质谱裂解过程中产生m/z191[quinic acid—H]-、m/z179[caffiec acid—H]-、m/z173[quinic acid—H—H2O]-和m/z135[caffiec acid—H—CO2]-等特征碎片离子,可能的裂解途径示于图2。当咖啡酰基在奎尼酸母核上的取代位置为4位时,ESI-MS2基峰离子为m/z173,由此将M28鉴定为隐绿原酸;当咖啡酰基在奎尼酸母核上的取代位置为3位和5位时,它们的基峰离子均为m/z191,二者的最明显区别在于m/z179的相对丰度:M10的m/z179相对丰度>40%,为新绿原酸;M24的m/z179相对丰度<5%,为绿原酸[16]。
M34和M35的准分子离子峰[M—H]-分别为m/z367.103 88、367.103 79,推断可能的分子式为C17H19O9,误差在±5×10-6范围内。在ESI-MS2谱图的主要特征碎片离子为m/z193[ferulic acid—H]-、m/z191[quinic acid—H]-、m/z173[quinic acid—H—H2O]-,故推断二者均为阿魏酰奎尼酸类成分。根据参考文献[15],将M34和M35分别鉴定为3-阿魏酰奎尼酸和4-阿魏酰奎尼酸。
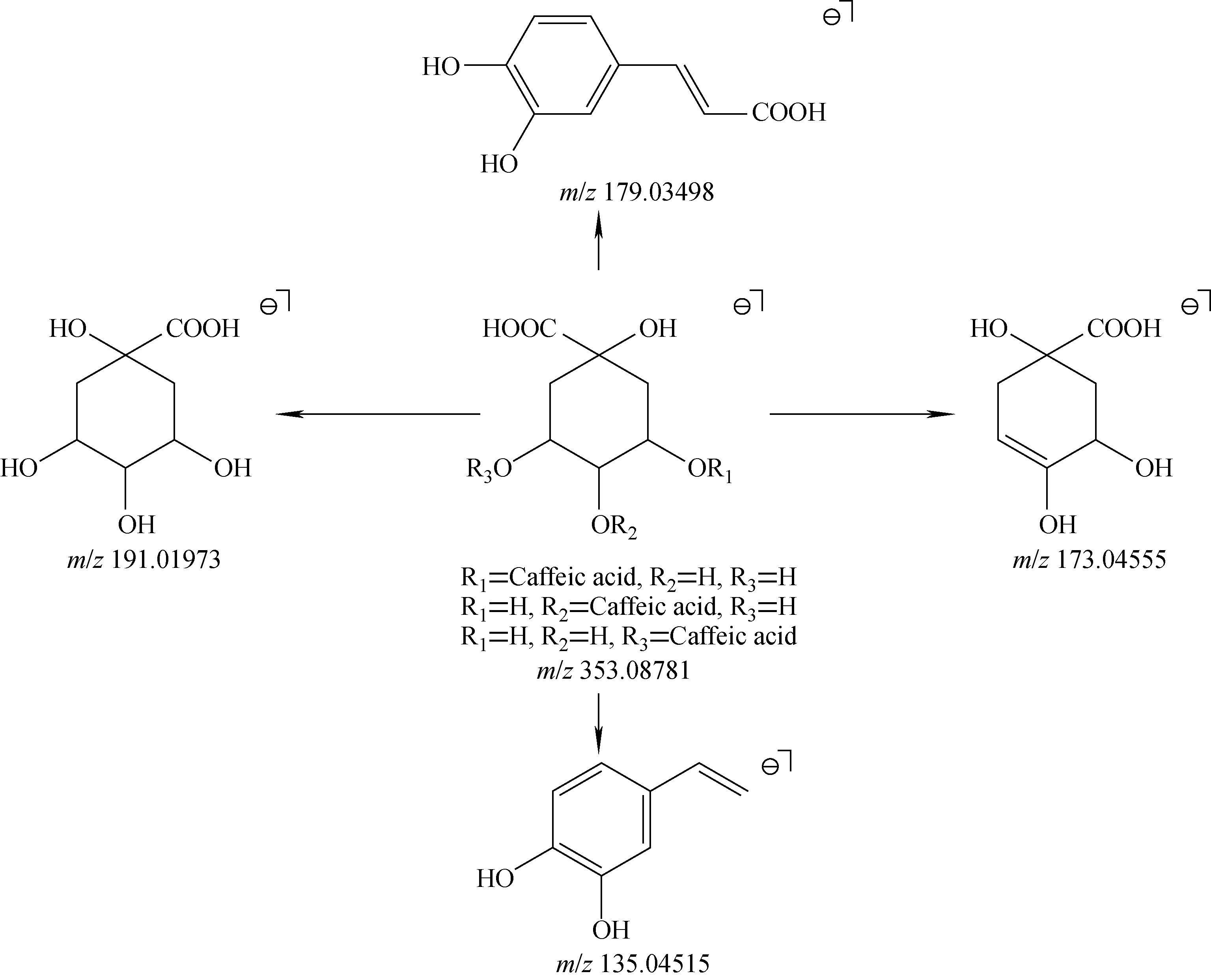
图2 负离子模式下,单咖啡酰奎尼酸类成分的裂解途径 Fig.2 Proposed fragmentation pathway for caffeoylquinic acid in negative ion mode
M7、M9、M13、M14、M16、M20、M22和M28的准分子离子峰[M—H]-分别为m/z515.140 87、515.140 99、515.141 05、515.141 24、515.141 30、515.141 24、515.141 11、515.141 24,推断它们的分子式为C22H27O14,误差均在±5×10-6范围内。结合上述化合物,经CID裂解后均产生m/z353[M—H—caffeoyl/Glu]-、m/z335[M—H—caffeoyl/Glu—H2O]-、m/z191[quinic acid—H]-特征碎片离子,因此,将它们鉴定为单咖啡酰奎尼酸葡萄糖苷类成分。
2.1.2小分子酚酸类成分的鉴定 根据所获得的高分辨质谱数据,M1和M29的准分子离子峰[M—H]-分别为m/z207.014 53、207.014 74,推断它们的分子式为C6H7O8,误差在±5×10-6范围内。在ESI-MS2谱图中均产生m/z189[M—H—H2O]-和m/z127[M—H—H2O—CO2]-特征碎片离子,因此将M1和M29鉴定为木槿酸及其同分异构体。
M2的准分子离子峰[M—H]-为m/z191.019 65,推断其可能的分子式为C6H7O7,误差在±5×10-6范围内。在ESI-MS2谱图中产生m/z173[M—H—H2O]-、m/z129[M—H—H2O—CO2]-和m/z111[M—H—2H2O—CO2]-特征碎片离子,故将其鉴定为柠檬酸。
M3和M6的准分子离子峰[M—H]-分别为m/z169.014 47、169.014 40,推断其可能的分子式为C7H5O5,误差在±5×10-6范围内。它们的基峰离子均为m/z125[M—H—CO2]-,结合对照品比对结果,将M3鉴定为没食子酸,同时将 M6鉴定为没食子酸的同分异构体。
M4、M5和M23的准分子离子峰[M—H]-分别为m/z153.019 67、153.019 29、153.019 58,推断其可能的分子式为C7H5O4,误差在±5×10-6范围内。三者的ESI-MS2谱图均产生m/z125[M—H—CO]-和m/z109[M—H—CO2]-特征碎片离子,结合对照品比对结果,将M5鉴定为原儿茶酸,将M4和M23鉴定为原儿茶酸的同分异构体。
M8、M11和M17的准分子离子峰[M—H]-分别为m/z179.035 20、179.035 11、179.035 19,推断它们可能的分子式为C9H7O4,且误差在±5×10-6范围内。在ESI-MS2谱图中均产生m/z179[M—H]-、m/z135[M—H—CO2]-和m/z107[M—H—CO—CO2]-特征碎片离子,故推断它们为咖啡酸及其同分异构体[17]。
M12、M15和M36的准分子离子峰[M—H]-分别为m/z197.045 68、197.045 79、197.045 90,推断其可能的分子式为C9H9O5,且误差在±5×10-6范围内。三者的ESI-MS2谱图均产生m/z182[M—H—CH3]-、m/z153[M—H—CO2]-和m/z138[M—H—CH3—CO2]-特征碎片离子,由此鉴定为丁香酸及其同分异构体。
M17和M26的准分子离子峰[M-H]-分别为m/z163.040 18、163.040 21,推断其可能的分子式为C9H7O3,且误差在±5×10-6范围内。二者的ESI-MS2谱图均产生m/z119[M—H—CO2]-的基峰离子,由此鉴定为对香豆酸及其同分异构体。
M25和M30的准分子离子峰[M—H]-分别为m/z193.050 48、193.050 89,推断其可能的分子式为C10H9O4,且误差在±5×10-6范围内。二者的ESI-MS2谱图均产生m/z178[M—H—CH3]-、m/z149[M—H—CO2]-和m/z134[M—H—CO2—CH3]-等碎片离子,由此鉴定M25和M30为阿魏酸及其同分异构体[18]。
2.2 黄酮类成分的鉴定
玫瑰茄中的黄酮类化合物主要为黄酮醇和黄烷醇,多以单体或聚合物的形式存在。本研究从玫瑰茄提取液中鉴定出4种黄酮类成分;从玫瑰茄发酵液中鉴定出2种黄酮类成分。
M21的准分子离子峰[M—H]-为m/z289.071 66,推断其可能的分子式为C15H13O6,误差为3.443×10-6。在ESI-MS2谱图中,m/z289首先中性丢失1分子CO2,产生碎片离子m/z245[M—H—CO2]-,同时产生m/z203[M—H—C2H2O—CO2]-和m/z179[M—H—C2H2O—C3O2]-等特征离子,结合对照品对比及相关文献[19],将M21鉴定为儿茶素。
M39的准分子离子峰[M—H]-为m/z609.146 42,推断其可能的分子式为C27H29O16,误差为2.313×10-6。由文献[20]可知,芸香糖为1分子鼠李糖与1分子葡萄糖连接,在CID裂解过程中易直接丢失芸香糖残基,即减少308 u。M39经CID裂解后产生m/z301[M—H—Rha—Glu]-、m/z300[M—2H—Rha—Glu]-、m/z255[M—H—Rha—Glu—H2O—CO]-基峰离子。其中,m/z301丢失C环羰基形成m/z273[M—H—Rha—Glu—CO]-,m/z255经重排并丢失CO形成m/z227[M—H—Rha—Glu—H2O—2CO]-碎片离子。由此将M39鉴定为芦丁。同理,M40的准分子离子峰[M—H]-为m/z593.151 67,推断其可能的分子式为C27H29O15,误差为2.653×10-6。m/z593经CID裂解后产生m/z285[M—H—Rha—Glu]-和m/z284[M—2H—Rha—Glu]-基峰离子。其中,m/z285丢失C环羰基形成m/z257[M—H—Rha—Glu—CO]-碎片离子或开环重排生成m/z185[M—H—Rha—Glu—C4H4O3]-碎片离子,由此推断M40为山奈酚芸香糖苷[21]。
M41的准分子离子峰[M—H]-为m/z301.035 06,推断其可能的分子式为C15H9O7,误差为2.594×10-6。在ESI-MS2谱图中,m/z301通过RDA重排形成m/z151[M—H—C4H4O5—H2O]。同时,m/z301丢失C环羰基形成m/z273[M—H—CO]-,并继续丢失1分子H2O形成m/z257[M—H—CO—H2O]-。结合对照品比对和文献[22],可将M41鉴定为槲皮素。
2.3 花青素类成分的鉴定
玫瑰茄花青素,也叫玫瑰茄花色苷、玫瑰茄红色素,是玫瑰茄花萼中富含的一种生理活性成分,主要包括飞燕草素-3-葡萄糖苷、矢车菊素-3-葡萄糖苷、飞燕草素-3-桑布双糖苷和矢车菊素-3-桑布双糖苷等。本研究从玫瑰茄提取液中鉴定出2种花青素类成分;从玫瑰茄发酵液中鉴定出1种花青素类成分。
M31的准分子离子峰[M—H]-为m/z447.094 18,推断其可能的分子式为C21H19O11,误差为4.456×10-6。在ESI-MS2谱图中,m/z447离子中性丢失1分子葡萄糖残基,产生m/z285[M—H—Glu]-和m/z284[M—2H—Glu]-碎片离子。结合对照品比对,可将M31鉴定为矢车菊素-3-O-葡萄糖苷。
M37的准分子离子峰[M—H]-为m/z595.130 80,推断其可能的分子式为C26H27O16,误差为2.418×10-6。在ESI-MS2谱图中,m/z595易丢失1分子桑布双糖(Sam)形成m/z301[M—H—Sam]-和m/z300[M—2H—Sam]-,并生成m/z255[M—H—Sam—H2O—CO]-等碎片离子,由此可将M37鉴定为飞燕草素-3-O-桑布双糖苷。
2.4 木脂素类成分的鉴定
玫瑰茄作为锦葵科植物,含有一定量的木脂素类成分。本研究从玫瑰茄提取液和玫瑰茄发酵液中均鉴定出1种木脂素类成分。
根据所获得的高分辨质谱数据,M38的准分子离子峰[M—H]-为m/z417.155 85,推断其可能的分子式为C22H25O8,误差为3.490×10-6。在ESI-MS2谱图中,M38离子产生m/z402[M—H—CH3]-碎片离子,表明其结构式中含有甲氧基;m/z191丢失1分子H2O生成m/z166,同时还产生m/z371[M—H—CO2—H2O]-,由此可将M38鉴定为丁香脂素。
3 结论
本研究应用UHPLC-LTQ-Orbitrap 高分辨质谱技术对玫瑰茄发酵前后的有机酸、黄酮、花青素及木脂素类化学成分进行分析检测。根据所获得的精确分子质量,同时结合色谱保留行为、质谱裂解规律、特征碎片离子、对照品比对以及相关文献报道,共鉴定出41种化学成分,包括34种有机酸类、4种黄酮类、2种花青素类及1种木脂素类。其中,从发酵前玫瑰茄提取液中鉴定出41种化学成分,从发酵玫瑰茄提取液中鉴定出33种化学成分。研究结果表明,玫瑰茄发酵前后其中有机酸成分的种类及含量发生不同程度的变化。例如,玫瑰茄发酵液中的绿原酸类成分含量发生明显下降甚至消失,但仍保留了其特有的木槿酸、柠檬酸和花青素等有效成分,这可能就是玫瑰茄经发酵后其酸涩感和胃肠刺激性降低的主要原因。
其次,本研究优选肠膜明串株菌肠膜亚种对玫瑰茄进行发酵,该菌种作为可用于食品的菌种之一,自身有较好的发酵特性,且耐酸性佳,其强大的生物转化能力有益于玫瑰茄中活性成分的转化,提高药效。综上,本研究系统地阐明了玫瑰茄发酵前后的活性物质变化,可为多渠道、多途径开发玫瑰茄相关产品,提高相关产品的质量奠定基础。
