高效液相色谱法测定桑叶γ-氨基丁酸和谷氨酸
2019-01-21谌珍刘青茹张晓伟贺晶孙军燕刘婧
谌珍,刘青茹,张晓伟,贺晶,孙军燕,刘婧,*
(1.中华全国供销合作总社杭州茶叶研究院,浙江杭州310016;2.烟台北方茶叶推广中心,山东烟台264009)
近年来,以 γ-氨基丁酸(γ-aminobutyric acid,GABA)为功效因子的新型功能食品被广泛开发应用,GABA具有降压、治疗癫痫、增强记忆力等功效,而一般植物组织中的GABA含量很低,不能满足人体生理需求,桑叶为药食两用原料,具有明显的降血压和降血糖功效,特别是其中所含的GABA含量平均能达到226 mg/100 g[1],而且我国桑叶种植广泛,是用来开发高γ-氨基丁酸茶的理想原料。桑叶中GABA是谷氨酸(glutamic acid,Glu)在谷氨酸脱羧酶的作用下水解而来,叶片中谷氨酸的含量也可以作为一个参照指标评价桑叶中γ-氨基丁酸提高的潜力。所以准确、高效测定桑叶中γ-氨基丁酸和谷氨酸的含量对于开发高γ-氨基丁酸桑叶茶尤为重要。
目前常用的测定γ-氨基丁酸的的方法主要分为高效液相色谱法[2-3]、Berthelot比色法[4-7]、改良纸层析法[8-9]。若采用纸层析法和比色法,因为桑叶内质成分复杂且含大量色素,会干扰γ-氨基丁酸和谷氨酸的测定,从而降低检测的精确性和灵敏度。而高效液相法测定结果准确,灵敏度高,可同时检测多种氨基酸。常用氨基酸柱前衍生试剂有异硫腈酸苯酯(phenyl isothiocyanate,PITC)、邻苯二甲醛(o-phthalaldehyde,OPA)、2,4-二硝基氟苯(2,4-dinitrofluorobenzene,DNFB),PITC衍生时间短但操作繁杂,需要减压蒸馏去除多余衍生剂;OPA衍生反应迅速,但生成物不稳定,需快速进样,所以本试验选用2,4-二硝基氟苯作为衍生试剂,用高效液相色谱法同时测定γ-氨基丁酸和谷氨酸含量。同时简化样品前处理过程,确立提取的最佳参数,旨在建立准确、高效的γ-氨基丁酸和谷氨酸检测方法,为γ-氨基丁酸桑叶茶开发和利用提供理论与技术支持。
1 材料与方法
1.1 材料与试剂
样品:新鲜桑叶、中华全国供销合作总社杭州茶叶研究院食品技术所自制GABA桑叶茶。
γ-氨基丁酸标准品(99%)、三乙胺、三水乙酸钠(均为分析纯):阿拉丁公司;乙腈(色谱纯):德国默克股份两合公司;乙酸:国药集团化学试剂有限公司;谷氨酸钠(食用级):河南思远生物科技有限公司。
1.2 仪器与设备
高效液相色谱仪(配Waters 1525泵、Waters717 plus自动进样器、Waters 2487紫外检测器):美国Waters公司;DU-S26电热恒温水浴锅:上海精宏实验设备有限公司;XW-80A旋涡混合器:上海精科实业有限公司;SHB-Ⅲ循环水式多用真空泵:郑州长城工贸有限公司。
1.3 方法
1.3.1 溶液配制
1)2,4-二硝基氟苯衍生溶液、pH 9.0硼酸缓冲溶液和pH 7.0磷酸缓冲溶液的配制参照文献[10]。
2)梯度洗脱溶液
A相:50 mmol/L pH 6.8乙酸钠缓冲溶液,(含1%三乙胺)。称取3.402 g三水乙酸钠,用娃哈哈纯净水定容至500 mL,加入0.5 mL三乙胺,0.5 mL冰乙酸,有机滤膜过滤,并超声脱气20 min。
B相:50%乙睛水溶液,体积比为1∶1。有机滤膜过滤,并超声脱气20 min。
1.3.2 衍生、上样
取 200 μL 待测液,加 200 μL 硼酸钠缓冲液,20 μL DNFB,封口膜密封,混匀,60℃暗处水浴1 h。室温冷却,加400 μL磷酸盐缓冲液,摇匀,过 0.22 μm膜。
用pH 9.0硼酸缓冲溶液配制0.01、0.02、0.03mg/mL谷氨酸和γ-氨基丁酸混合标准溶液,其余操作待测液。
1.3.3 色谱条件
流速1 mL/min;检测波长360 nm;柱温23℃;进样量10 μL。梯度洗脱,洗脱程序参照文献[11]。
1.3.4 样品提取试验
分别称取桑叶茶粉 0.05、0.1、0.3、0.6、1.2 g 置于15 mL离心管中,加10 mL沸水,100℃水浴20 min,每5 min摇晃一次。冷却至室温,3 500 r/min离心10 min,上清转移至25 mL容量瓶。重复提取一次,合并提取液定容至25 mL。按照提取所用溶剂体积20 mL计算料液比,考察料液比 2.5∶1、5∶1、15∶1、30∶1、60∶1(mg/mL)对GABA和Glu提取量的影响;在料液比5∶1(mg/mL)的基础上,探究提取温度70、80、90、100℃对 GABA和Glu 提取量的影响;在料液比 5∶1(mg/mL)与提取温度80℃基础上,设定单次提取时间分别为10、15、20、25 min,考察提取时间对GABA和Glu提取量的影响。
1.3.5 线性检验
用pH9.0硼酸缓冲液配制0~0.05 mg/mL质量浓度的混标,分别取200 μL进行衍生和色谱分析,测试结果以质量浓度为x轴,峰面积为y轴作线性方程,并进行线性回归分析。
1.3.6 精确性和准确性验证试验
样品重复性试验:按上述方法处理桑叶茶,重复测定5次,计算测定结果得平均值和相对标准偏差。
样品加标回收率:以桑叶茶为空白,添加已知质量浓度的氨基酸标准溶液,按照上述方法进行色谱测定,计算其加标回收率。
1.3.7 桑叶富集GABA实施方案
每2 m2的桑树地浇10 L的浓度为5%谷氨酸钠(monosodium glutamate,MSG)溶液,桑树栽种株间距0.5 m,行间距1 m。7天后采样,同时重复上述操作,过7天后再采样。采样分上位叶(2叶~4叶)、中位叶(6叶~8叶)、下位叶(倒数三叶)。
2 结果与讨论
2.1 样品提取参数优化
样品中GABA和Glu提取率的高低直接影响检测方法的准确性,本文从提取料液比、时间、温度几个方面对提取过程进行优化。GABA和Glu都极易溶于热水,所以选择以蒸馏水为提取溶剂,加热浸提的方式。
2.1.1 料液比
料液比对Glu和GABA提取量的影响见图1。

图1 料液比对Glu和GABA提取量的影响Fig.1 The effect of solid-liquid ratio on the extraction of Glu and GABA
此处料液比为样品质量与两次提取总溶剂提取之比,通过图 1 可以看出,料液比为 5∶1(mg/mL)时提取的Glu和GABA含量最高,Glu含量为(0.65±0.02)mg/g,GABA 为(1.92±0.02)mg/g,在 2.5 mg/mL 时稍低但差异不显著;从料液比 5∶1(mg/mL)之后,GABA和Glu含量均随料液比的增大而降低,可能原因是样品多溶剂少导致提取不完全;总体上Glu与GABA提取率的变化趋势一致,且料液比5∶1(mg/mL)提取效果最佳。
2.1.2 提取温度
提取温度对Glu和GABA提取量的影响见图2。
提取温度影响提取效率,试验通过以不同温度对桑叶进行提取,结果显示,70℃提取的Glu与GABA含量显著低于其他试验组,80℃到100℃变化不大,同时Glu与GABA提取含量的变化趋势一致,最终选取提取温度80℃。
2.1.3 提取时间
提取时间对Glu和GABA提取量的影响见图3。
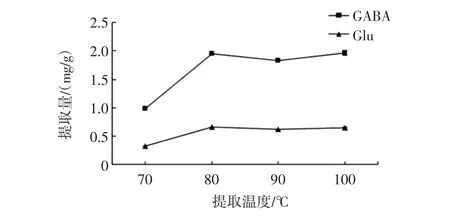
图2 提取温度对Glu和GABA提取量的影响Fig.2 The effect of extraction temperature on the extraction of Glu and GABA
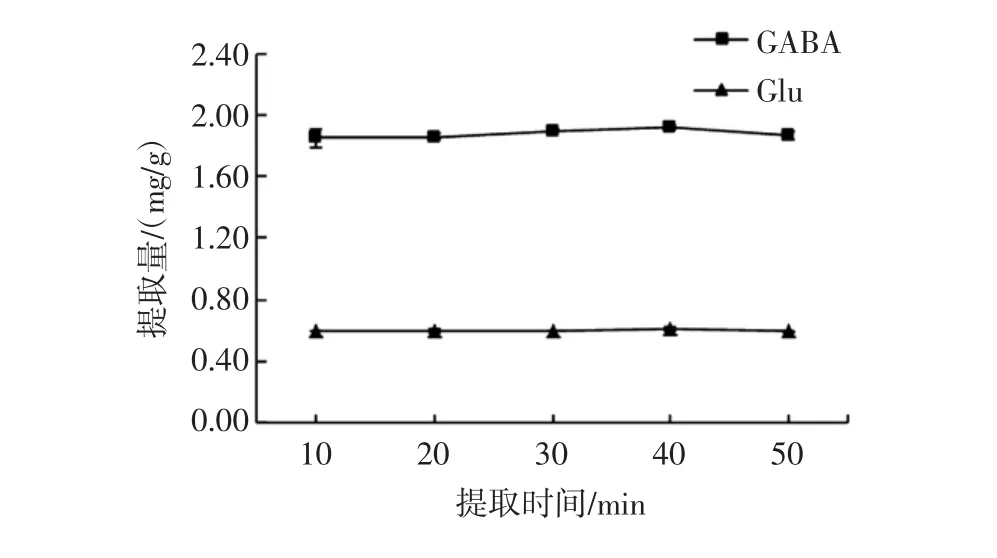
图3 提取时间对Glu和GABA提取量的影响Fig.3 The effect of extraction time on the extraction of Glu and GABA
提取总时间按照两次浸提时间之和,由图3可以看出,Glu和GABA提取量随时间延长变化均不显著,Glu含量在(0.59±0)mg/g到(0.61±0.01)mg/g之间,GABA 含量在(1.85±0.06)mg/g到(1.92±0.02)mg/g之间,所以选取提取时间10 min。
综合上述试验结果,料液比、提取温度对Glu和GABA提取效果有较大影响,通过不同参数比较,确定最佳提取条件为:80℃条件下,料液比5∶1(mg/mL),分两次浸提,每次5 min。
2.2 线性检验
Glu和GABA浓度与峰面积线性回归关系见图4、图5。
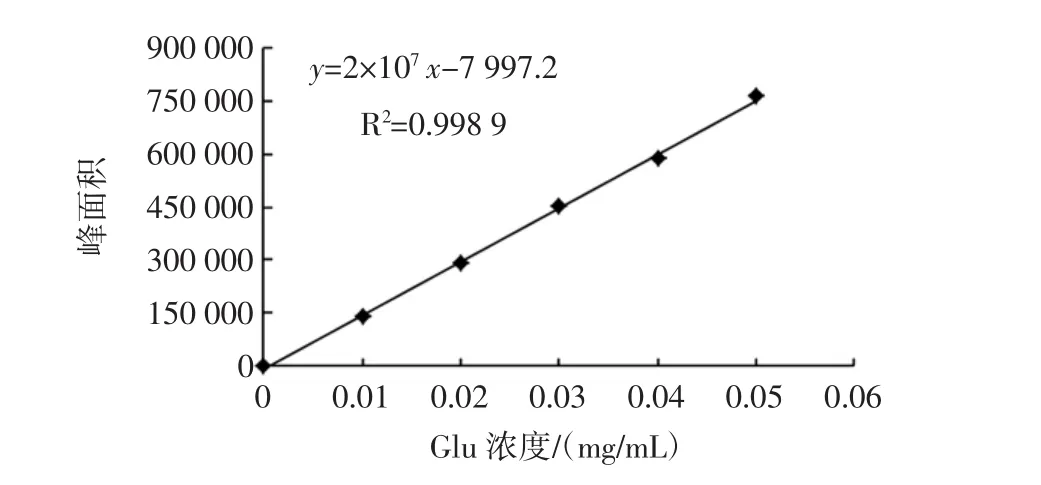
图4 Glu浓度与峰面积线性回归关系Fig.4 The linear regression relationship between Glu concentration and peak area

图5 GABA浓度与峰面积线性回归关系Fig.5 The linear regression relationship between GABA concentration and peak area
试验设置不同质量浓度的Glu和GABA标准溶液,结果显示在0~0.05 mg/mL范围内Glu的线性方程为y=2×107x-7 997.2,GABA的线性方程为y=2×107x+6 418.4,两者的相关系数分别为0.998 9、0.999 5,线性关系良好。
图6为标样中Glu和GABA的液相色谱图。
2.3 稳定性检验
重复性试验是评价分析系统稳定性的重要方法,通常采用样品保留时间和峰面积的相对标准偏差(relative standard deviation,RSD)作为考察对象。选用同一样品连续进样5次,结果如表2。
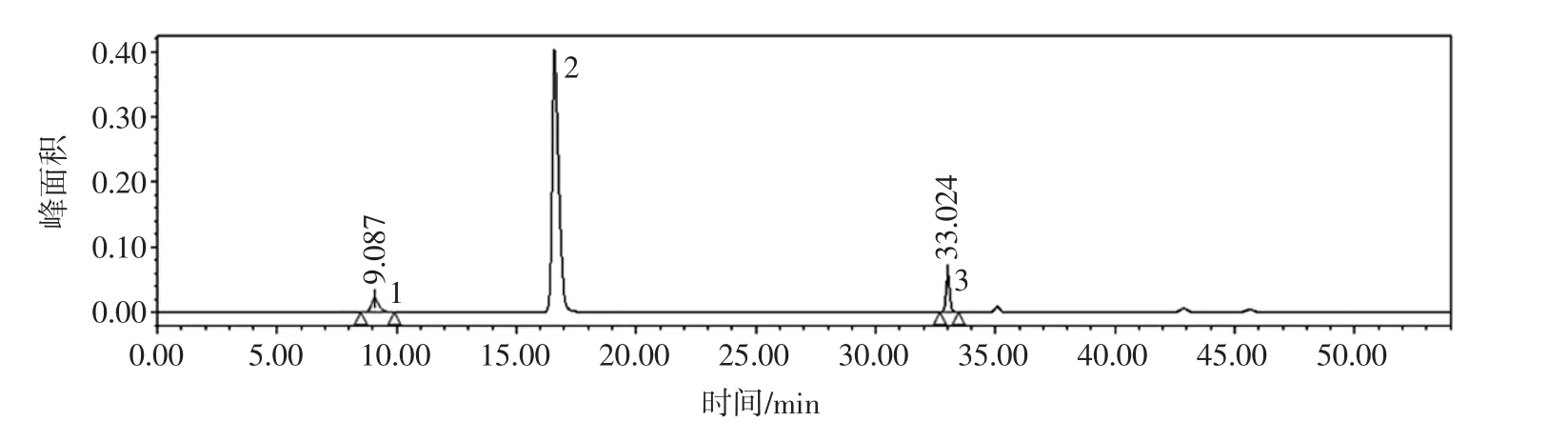
图6 标样中Glu和GABA分离图谱Fig.6 The separation spectrogram of Glu and GABA in standard sample

表2 重复性检验(n=5)Table 2 The repetition test of retention time and peak area
通过表2可以看出,Glu的保留时间在9 min~10 min,相对标准偏差为1.759%,GABA的保留时间在33 min~34 min,相对标准偏差为0.718%;另外Glu和GABA的峰面积的相对标准偏差分别为1.672%、1.246%,均小于5%,说明此检测方法的精密度达到了较高水平。
2.4 加标回收率
在同一份桑叶茶样品中,分别添加0.005、0.01mg/mL的氨基酸标准溶液,按照上述方法进行测定,计算其加标回收率,结果如表3。

表3 加标回收率Table 3 Rate of recovery of Glu and GABA adding to the sample
经计算Glu和GABA的平均加标回收率分别为88.024%、114.64%,回收率在80%~120%之间,说明此方法具有较高的可靠性。
2.5 样品测定
以富集GABA的桑树鲜叶为样品,按照上述方法进行测定,结果见表4。

表4 桑叶样品中Glu和GABA含量Table 4 The content of Glu and GABA in mulberry leaf samples
由表4可以看出,通过给桑树浇灌谷氨酸钠溶液,桑叶谷氨酸含量自第一次浇灌后即有明显增加,不同叶位之间含量相差不大;二次浇灌后桑叶中谷氨酸含量与一次浇灌基本保持一致,说明桑树对谷氨酸钠的吸收可能具有一定限度或者一部分流失或转化成其他形式。而GABA含量在一次浇灌后上升幅度较小,二次浇灌后含量显著提高,说明通过浇灌谷氨酸钠溶液对GABA富集效果好,且转化过程需要一定时间,后续可对其吸收转化机制进行更深入的试验。
3 结论
本研究通过对桑叶前处理的摸索,确定最佳提取条件为:80 ℃条件下,料液比 5∶1(mg/mL),分两次浸提,每次5 min。建立了一种快速、简单、精准的同时测定桑叶源谷氨酸和γ-氨基丁酸的方法,该方法能有效分开目标物质与干扰物质,且Glu和GABA的峰面积的相对标准偏差分别为1.672%、1.246%,平均加标回收率分别为88.024%、114.64%,具有较高的可靠性。另外试验所用的紫外检测器比荧光检测器普及率高,具有更高的通用性。
采用此检测方法测定富集GABA的桑叶中Glu和GABA含量,发现通过浇灌谷氨酸钠可以达到较好的富集效果,为提高GABA含量提供可靠、快速的检测手段,后续还可深入探究桑树对谷氨酸钠的吸收及转化机制。
