PnKTI基因在转基因拟南芥中的抗虫及功能分析
2019-01-21王洁华毛虹禹杨少辉
王洁华,毛虹禹,杨少辉
基因在转基因拟南芥中的抗虫及功能分析
王洁华,毛虹禹,杨少辉
(天津大学环境科学与工程学院,天津 300072)
Kunitz型胰蛋白酶抑制剂(Kunitz-type trypsin inhibitor,KTI)属于蛋白酶抑制剂(protease inhibitor,PI)家族中的丝氨酸蛋白酶抑制剂.本研究选择黑杨()中4个可被机械创伤诱导的基因(、、、),在拟南芥中过表达并以转基因拟南芥叶片饲喂小菜蛾,观察其从幼虫到成蛾的整个生长发育周期生理指标,从而检测4种基因的抗虫效果.结果发现,4种基因的抗虫效果依次为:>:2>:>:,其中,过表达基因的拟南芥叶片饲喂的小菜蛾存活率最低,仅为9.8%,.此外,采用酶化学法测定分析了基因编码产物的功能及效果.结果发现,基因的编码产物对胰凝乳蛋白酶没有抑制作用,但对胰蛋白酶有很强的抑制作用,作用效果依次为:>:2>:>:,与小菜蛾抗性测定结果一致.
;拟南芥;小菜蛾;抗性;功能分析
目前,植物抗虫性研究引起越来越多人的关注.我国农林业每年因为虫害造成的经济损失十分严重,转基因抗虫植物的研究无疑会有效挽救这种损失并会带来巨大的生态效益.微生物源的基因是在转基因抗虫植物中应用最多的的目标基因,然而近年来发现,基因的靶标害虫抗性问题越来越严 重[1-3],所以开发具有抗虫功能的其他种类杀虫基因并培育优势转基因抗虫植株就显得尤为重要.
蛋白酶抑制剂(PI)是主要位于植物种子和贮藏器官中的丰富蛋白质,其分子质量较小,在生物中普遍存在.目前,在自然界中共发现4大类蛋白酶抑制剂,包括丝氨酸蛋白酶抑制剂、半胱氨酸蛋白酶抑制剂、天冬氨酸蛋白酶抑制剂和金属蛋白酶抑制剂,其中丝氨酸蛋白酶抑制剂(serine proteinase inhibitor)研究最为广泛[4].Kunitz型胰蛋白酶抑制剂(Kunitz-type trypsin inhibitor,KTI)属于典型的丝氨酸蛋白酶抑制剂,其相对分子质量在20,ku左右,通常由1个或2个多肽链构成,其中4个半胱氨酸残基形成2个二硫键和1个具有保守精氨酸残基的单个反应性位点[5].其生理功能主要包括:保护储存蛋白,调节内源性蛋白酶活性,保护植物个体免受昆虫和病原体侵害[6-7].Hartl等[8]曾报道过丝氨酸蛋白酶抑制剂可以抑制龙葵中的虫害作用,而对植物的发育和生长没有阻碍作用.江汉民等[9]曾报道过基因对青花菜的转化,并初步证明转青花菜对小菜蛾幼虫具有一定抗性.
黑杨(,Pn),双子叶植物纲,杨柳科,杨属五大派别之一.本课题组2011年首次对黑杨做机械损伤处理来研究处理后的黑杨Kunitz型胰蛋白酶抑制剂基因()表达情况,结果发现、等12个基因在局部机械损伤诱导后,表达量均有上调现象[10-11].本项研究选用12个基因中被高度诱导的4个基因、、、,在拟南芥中过量表达,以转基因拟南芥叶片饲喂小菜蛾,分析其抗虫效果.
有研究[12]表明KTI是通过抑制昆虫中肠消化蛋白酶的活性,导致昆虫消化功能失调,生长发育受阻,最终因发育不正常而死亡.而昆虫消化吸收获取自身营养的过程是在以胰蛋白酶、胰凝乳蛋白酶为主的消化蛋白酶的共同作用下完成的[13],所以,为探究基因的编码产物是通过抑制昆虫体内何种消化蛋白酶来行使其功能的,本研究又使用酶化学法分析了基因编码产物的抑制途径及作用效果.
1 材料与方法
1.1 实验材料
黑杨()和拟南芥()由本实验室保存,栽培于培养室;培养温度(24±1)℃,光照16,h/d,相对湿度60%,~70%,.
根癌农杆菌()菌株、大肠杆菌()菌株、载体pBI121由本实验室保存,基因引物由金唯智公司合成,RNA提取、cDNA合成、质粒提取试剂盒购自Fermentas公司,Clone JET PCR Cloning Kit购自Thermo公司,ClonExpress® II One Step Cloning Kit购自Vazyme公司,细菌和植物培养基原料购自北京鼎国生物技术有限公司,DNA测序由华大生物公司完成,改良型Bradford法蛋白浓度测定试剂盒购自上海榕柏生物技术有限公司,卡那霉素(Kanamycin,Kan)、PnKTI活性测定酶、底物等购自Sigma-Aldrich公司.
供试害虫为小菜蛾(),由河北农林科学院植物保护研究所高占林研究员惠赠,在本实验室进行繁殖培养.
1.2 基因克隆与载体构建
对黑杨叶片进行局部机械损伤处理,将处理后的叶片在24,h后迅速收集起来,置于液氮中速冻[8].使用RNeasy Plant Mini Kit试剂盒提取黑杨叶片的总RNA,分别使用Nanodrop和琼脂糖凝胶电泳检测其浓度和完整性.以Oligo(dT)为引物,使用cDNA合成试剂盒进行反转录合成cDNA,并以此为模板进行PCR扩增,基因引物序列设计见表1.PCR反应体系(20,μL)为:10×TaqDNA聚合酶buffer 2,μL,PfuDNA聚合酶0.5,μL,Primer F和Primer R各0.5,μL,dNTP 0.5,μL,cDNA 1,μL,ddH2O 15,μL.反应程序为:95,℃预变性4,min,95,℃变性30,s, 58,℃退火30,s,72,℃延伸50,s,变性-退火-延伸为一个循环,设置25个循环,然后在72,℃延伸10,min.
PCR产物纯化、回收后,利用Clone JET PCR Cloning Kit获得克隆载体pJet1.2-PnKTIs,测序正确后,利用ClonExpress® II One Step Cloning Kit,将基因片段与pBI121载体片段进行重组连接.连接产物转化大肠杆菌感受态细胞,经抗生素筛选和菌落PCR验证,最终获得由35,S启动子驱动的植物过量表达载体pBI121-PnKTIs.
表1 引物序列

Tab.1 Primersequence
1.3 拟南芥转化与分子鉴定
构建好的表达载体pBI121-PnKTIs,通过热激法转化到农杆菌感受态细胞,菌落PCR鉴定为阳性的农杆菌通过浸花法转化拟南芥.将T1代转基因拟南芥种子放在含有50,μg/mL卡那霉素的1/2,MS固体筛选培养基上进行抗性筛选,提取抗性苗的DNA进行基因组PCR鉴定.收获T1代PCR阳性苗的种子,经T2代繁殖及抗性筛选最终得到转基因的T3代纯合体.
提取T3代纯合体转基因拟南芥叶片RNA,反转录合成cDNA,以作为内参基因,进行Real-time PCR分析,定量检测目的基因的表达水平.基因的定量引物序列同见表1,的定量引物为F:5'-TGGTGACGCTGGTATGGTTA-3',R:5'-TCCTTCTTGTCCACGCTCTT-3'.10,μL反应体系包括:上下游引物各0.3,μL,2×SYBR Green Mix 5,μL,ddH2O 2.4,μL,cDNA 2,μL.在Piko ReaL software软件中设置反应程序为:95,℃,3,min;45个循环(95,℃,20,s;58,℃,20,s;72,℃,30,s);72,℃,30,s.
1.4 转基因拟南芥的抗虫性测定
选择T3代纯合转基因拟南芥作为供试材料,在每种转基因拟南芥中分别选取3个独立的株系作为实验组,野生型拟南芥作为对照组.当T3代转基因拟南芥和野生型拟南芥移至土中生长一个月后,剪取其叶片饲喂小菜蛾幼虫.每日观察并记录小菜蛾幼虫的成活率、食叶量、最终体重、结茧率和化蛾率.
1.5 PnKTI的活性测定
1.5.1 拟南芥叶片中粗蛋白溶液的提取[14]
准确称取单株拟南芥叶片10,g,用70%,乙醇和去离子水对叶片进行清洗后置于研钵中,加200,μL去离子水,立即进行研磨.当叶片彻底被研磨成液体后移至2,mL离心管中.研钵中的残留物用200,μL Tris缓冲液冲洗,再次收集到离心管中,重复数次后对叶片研磨液进行离心:4,℃ 12,000,r/min,10,min,重复数次,使最终上清液的体积为1,mL.此即为拟南芥叶片样品提取液的粗蛋白溶液.
1.5.2 蛋白含量的测定
1976年Bradford提出的考马斯亮蓝比色法是常用的可溶性蛋白测定方法,本实验采用改良型Bradford法蛋白浓度测定试剂盒中分光光度法Ι进行测定[15].测定后以标准组各管595的平均值为横坐标,对应的蛋白浓度为纵坐标绘制BSA蛋白标准曲线.最后根据转基因拟南芥样品粗蛋白溶液595的平均值,在标准曲线上计算出样品的蛋白浓度.
1.5.3 活性测定
取28个10,mL玻璃离心管,其中:标准空白1个,标准溶液1个,样品空白(转基因+野生型)13个,样品溶液13个.具体加入溶液如下:(a)标准空白:5,mL 0.4,mg/mL BAPA溶液,3,mL去离子水,1,mL 5.3,mol/L醋酸溶液;(b)标准溶液:BAPA溶液同上,3,mL去离子水;(c)样品空白:BAPA溶液同上,1,mL 10倍样品稀释液,2,mL去离子水,1,mL 5.3,mol/L醋酸溶液;(d)样品溶液:BAPA溶液同上,1,mL 10倍样品稀释液,2,mL去离子水.将各管溶液充分混匀,置于37,℃恒温水浴锅中温育10,min,在各离心管中均加入1,mL Trpsin工作液,混匀,继续温育10,min后于(b)管和(d)管中分别加入1,mL 5.3,mol/L醋酸溶液终止反应.充分混匀各管溶液,于10,mm比色皿中测定410,nm波长处溶液吸光度.
1.5.4 活性计算

(1)
式中:为样品提取液的抑制百分率,%;1为标准溶液的吸光度;2为样品溶液的吸光度;3为样品空白吸光度.只有此结果在40%~60%范围内时,溶液吸光度才可用于以下活性计算,抑制活性用每克样品抑制的胰蛋白酶毫克数表示[16],结果精确至0.001.

(2)
式中:KTIA表示基因编码产物的活性,mg/g;=1-(2-3)为吸光度变化值;为样品提取液体积,mL;是测试样品的质量,g;0.019为1,μg纯牛胰蛋白酶在410,nm波长处的吸光度;为样品稀释倍数.
1.6 PnKTI与胰凝乳蛋白酶反应的酶活性测定
1.6.1 Chymo的活性测定
首先设置一组适宜范围的浓度梯度TCI溶液,分别与确定浓度的Chymo反应,来确定TCI浓度与Chymo活性的线性关系,并计算出标准TCI与Chymo反应后的酶活性,以此作为对照.实验设置TCI溶液的浓度梯度为:0、0.025、0.050、0.062,5、0.075、0.1,mg/mL,确定Chymo的质量浓度为10,mg/mL.反应体系分为两部分,每部分均为6组,此外另加一组作为空白对照组.A体系(125,μL):Chymo每组均为8,μL,TCI溶液体积分别为0、0.625、1.25、1.562,5、1.875、2.5,μL,剩余部分分别用Buffer Ⅱ补足;B体系(1.5,mL):1.18,mmol/L的BTEE每组均为700,μL,Buffer Ⅰ均为710,μL,2,mol/L的CaCl2溶液均为40,μL.分别从每组A体系中取50,μL加至对应的B体系中,另取50,μL Buffer Ⅱ加至对应的B体系中作为空白对照组,快速混匀后立即使用紫外分光光度计测定330,s内256,nm波长处的吸光度,记录每30,s的观测值,通过公式计算酶活性并绘制标准曲线.
正式进行拟南芥叶片样品提取液的测定,以拟南芥样品提取液取代TCI溶液,每种转基因拟南芥分别取100,μL上清提取液参与到反应体系中,测定结果通过公式计算酶活性,并与标准曲线中的酶活性进行比对,分析该4种基因是否具有抑制胰凝乳蛋白酶的功能.
1.6.2 活性计算
以BTEE代表胰凝乳蛋白酶活性[17].
2 结果与讨论
2.1 转基因拟南芥的分子鉴定
本实验通过浸花法将含有目的基因的表达载体转化到拟南芥中,经抗生素筛选获得阳性转化子叶片,对转基因拟南芥叶片进行基因组PCR检测,以野生型拟南芥叶片为对照,结果如图1.结果显示,在12株转基因拟南芥的基因组内均检测到200,bp左右的目的片段,而在未转化的野生型拟南芥中没有检测到,说明基因已经整合到拟南芥基因组.Real time PCR检测结果如图2,结果表明,外源基因在拟南芥叶片中稳定表达,不同外源基因的表达水平不同,与野生型对照组相比,表达量均很高,可以进行后续的抗虫实验.

M:DNA分子标记;1~3:转PnKTIA6基因拟南芥独立株系;4~6:转PnKTIB1基因拟南芥独立株系;7~9:转PnKTIC1基因拟南芥独立株系;10~12:转PnKTID2基因拟南芥独立株系;W:野生型拟南芥独立株系

**代表极显著差异(P<0.01)
2.2 转基因拟南芥对小菜蛾生长发育指标的影响
本实验使用T3代转基因拟南芥离体叶片饲喂小菜蛾,7,d后,观察并测定小菜蛾的各生理周期指标,做出基因抗性分析.结果表明,、、和4种转基因拟南芥对小菜蛾均表现出了不同程度的抗性.其指标测定结果见表2.
表2 转基因拟南芥抗虫性测定结果
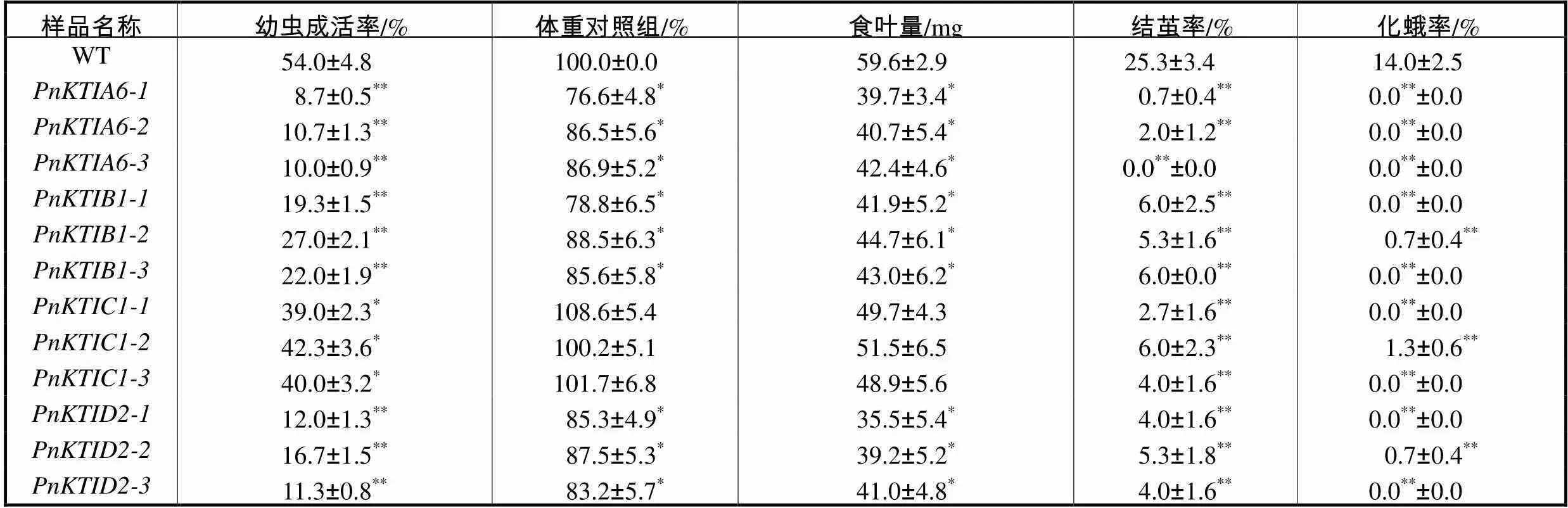
Tab.2 Insect resistance test results of thaliana transgenicArabidopsis
注:*为显著差异(<0.05),**为极显著差异(<0.01)
从小菜蛾幼虫成活率来看,4种转基因植株饲喂的小菜蛾幼虫同对照组相比均显著降低.其中:、和转基因植株饲喂的小菜蛾幼虫在成活率上与对照组相比均存在极显著差异,其中转基因植株的3个株系饲喂的小菜蛾幼虫成活率平均低9.8%;和转基因植株饲喂的小菜蛾幼虫成活率分别平均为13.3%,和22.8%,.这些数据说明转基因植株对小菜蛾的生长发育具有最为明显的抑制作用.相对而言,转基因植株对小菜蛾表现的抗性稍差一些,3个株系饲喂的小菜蛾幼虫成活率平均为40.4%,,但与对照组相比仍存在显著差异,可缓慢降低其种群数量,控制繁殖速度,而且以往有研究认为,这样可延缓对害虫的筛选压力,使之不易产生耐受性[18].
小菜蛾幼虫成活率与其取食活动密不可分,从数据结果可以看出,取食转基因植株的小菜蛾同对照组相比,食叶量均有所降低,其中对、和转基因植株的摄取量与对照组相比均存在显著差异.小菜蛾食叶量降低,可能是由于目的基因的编码产物对小菜蛾的消化蛋白酶产生了抑制作用,使其消化功能失调,抑制了取食行为.取食行为进一步影响体重变化,、和转基因植株饲喂的小菜蛾体重均有所降低,且差异显著,这与小菜蛾的食叶量是正相关的;而转基因植株饲喂的小菜蛾体重有所增加,但并无显著性差异,一种可能的解释是消化酶对摄入的蛋白酶抑制剂的相对比例发生了变化,这种昆虫的适应机制已经在以前的研究中得到证实,并且对于转基因植物的基因调控和生理可塑性具有重要意义[19].
从结茧率和化蛾率来看,对照组约有25.3%小菜蛾结茧,14.0%,化蛾.转基因植株饲喂的小菜蛾与对照组小菜蛾在同一时间进入到结茧阶段,在体型、体态上和对照组也无明显差异,但是最终结茧率和化蛾率与对照组相比均存在极显著差异.其中转基因植株的3个株系结茧率和化蛾率最低,结茧率平均低至0.9%,,化蛾率全部为0,说明转基因植株对小菜蛾整个发育过程都具有最强抑制作用.对于转基因植株,虽然其对小菜蛾幼虫的抑制作用比、和弱,但其对小菜蛾的结茧和化蛾均表现出极显著抑制作用,说明基因对小菜蛾明显有害的累积效应主要体现在其生长发育后期,而非幼虫阶段.
总体来说,数据表明4种基因对小菜蛾均具有良好的抗性.综合考虑小菜蛾的生长周期指标可认为,4种基因分别编码的基因产物作用效果依次为:>>>.虽然在短期试验中基因抗虫效果不如其他3种明显,但综合以上分析讨论,并从农林业抗虫工程的长远角度思考,可考虑将作为一种具有潜力的目标基因.
2.3 PnKTIs基因编码产物的活性分析
本实验使用酶化学法,将4种基因的编码产物分别与胰蛋白酶和胰凝乳蛋白酶反应,探究其抑制途径及作用效果,结果如下.
以标准组各管595的平均值为横坐标,对应的蛋白浓度为纵坐标绘制的BSA蛋白标准曲线如图3所示,结果表明两者具有很好的相关性(=0.993).实验组的12组转基因拟南芥样品稀释液分别提取自抗虫实验中的转基因株系,根据所测结果计算样品稀释前的蛋白浓度及活性.其蛋白浓度和基因编码产物的活性测定结果见表3,数据结果表明,从4种转基因拟南芥的12个株系中均成功提取出基因编码产物蛋白,各株系之间蛋白含量无明显差异;测得的基因编码产物的活性与野生型对照组相比均存在显著差异.其中,基因编码产物的抑制活性平均为每克样品抑制0.333,mg的胰蛋白酶,与其他3种基因相比,表现出最高的抑制活性.、、基因编码的产物抑制活性依次降低,分别平均为每克样品抑制0.294,mg、0.242,mg、0.181,mg的胰蛋白酶.这个结果符合小菜蛾饲喂实验的结果,进一步验证了基因的抗虫效果.
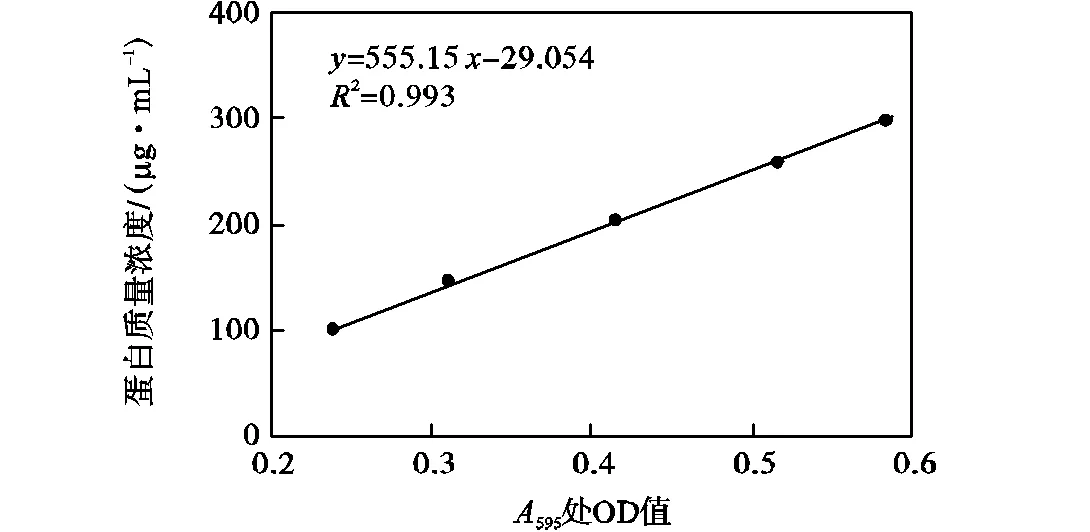
图3 BSA蛋白标准曲线
Chymo和梯度TCI反应后所确定的Chymo活性与TCI浓度的关系如图4所示,当TCI浓度为0时,Chymo的活性最高,为0.155,4,BTEE/mL.随着TCI浓度增大,酶活性逐渐降低.转基因与野生型拟南芥样品提取液与Chymo反应后的测定结果通过Chymo活性公式计算,得出的结果见表3.结果发现,野生型对照组拟南芥样品提取液与Chymo反应后的酶活性为0.155,3,BTEE/mL,和浓度为0的TCI溶液与Chymo反应后的酶活性极为接近;转基因拟南芥样品提取液参与反应后的酶活性与对照组相比无明显差异,说明基因的编码产物对Chymo均没表现出一定的抑制作用.
表3基因编码产物的生化测定
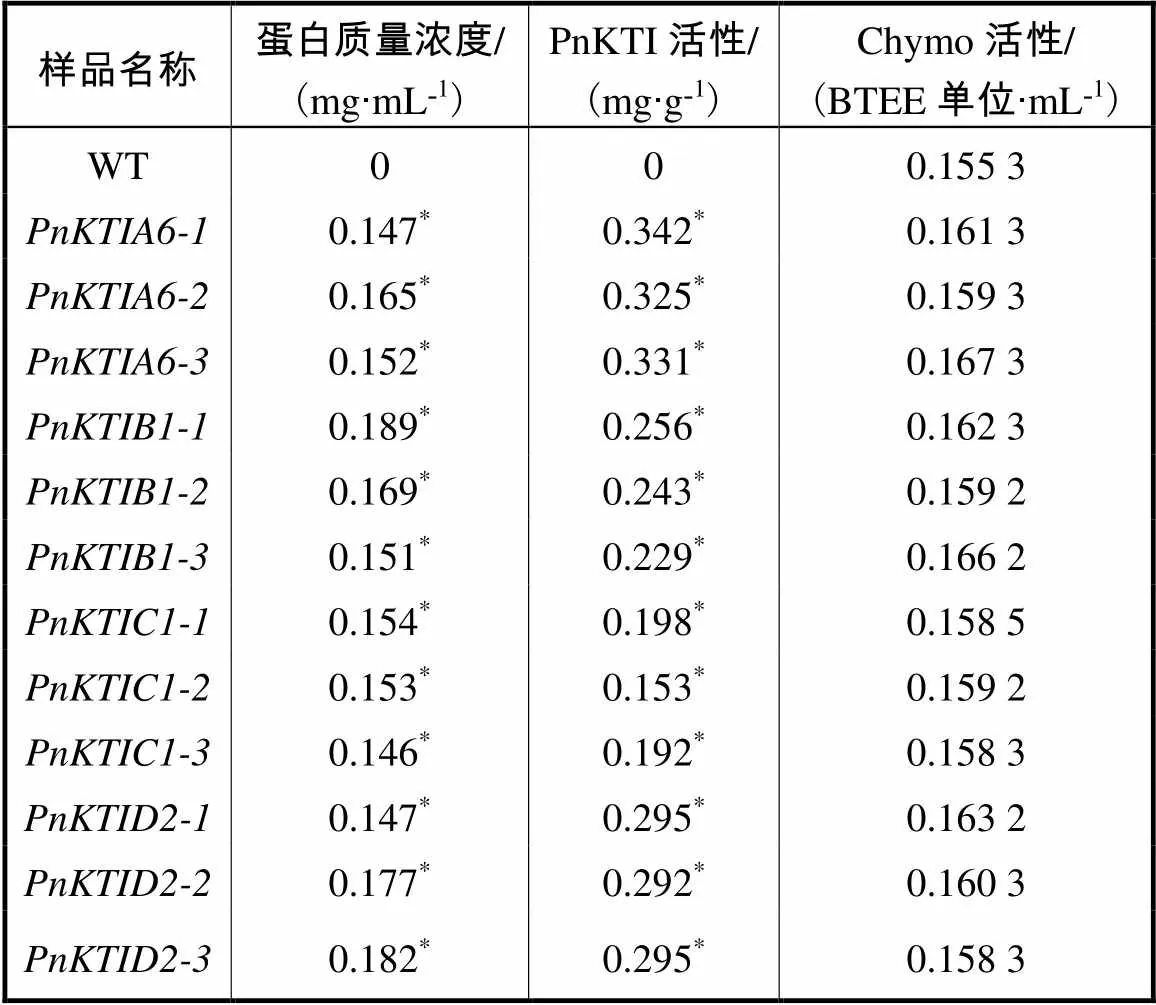
Tab.3 Biochemical assay of PnKTIs encoding product
注:*代表显著性差异(<0.05)
上述结果说明,基因的编码产物是通过抑制小菜蛾肠道内胰蛋白酶的活性导致其消化功能失调,进而影响其生长发育不良甚至死亡.其抑制活性依次为>>>,与小菜蛾饲喂试验结果一致.
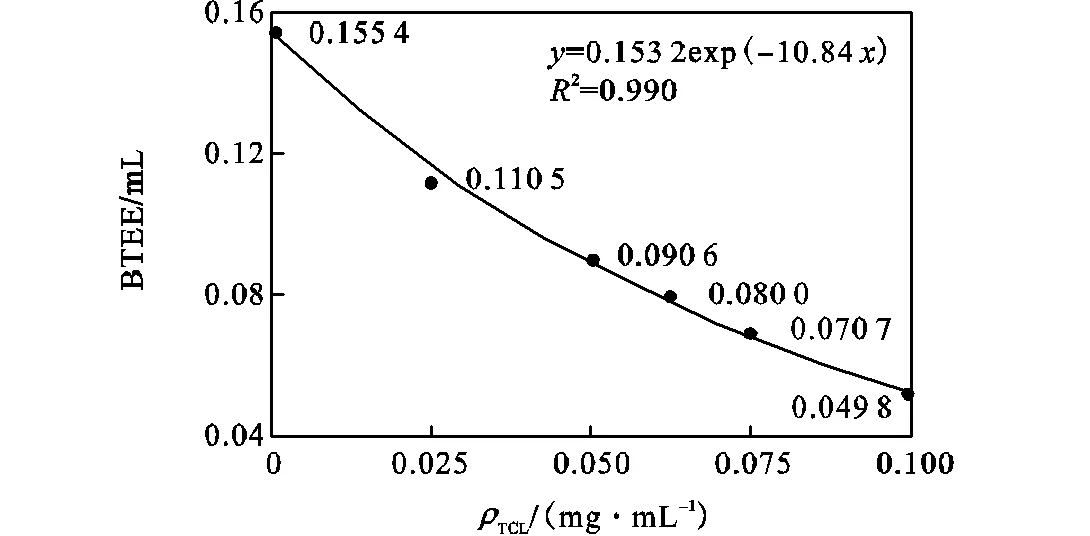
图4 TCI浓度与酶活性的关系
总之,数据表明,这4个基因会通过抑制小菜蛾肠道内胰蛋白酶的活性来干扰小菜蛾的生长.然而,在之前Yang等[20]的研究中,用芥末胰蛋白酶抑制剂2基因()在拟南芥中过量表达并饲喂小菜蛾,并未发现幼虫死亡和发育受阻的显著性差异,其原因是小菜蛾肠道蛋白酶对的特异性降解,而本研究说明小菜蛾肠道蛋白酶不会对产生降解.此外,本研究中值得一提的是,基因编码产物抑制活性最高,对小菜蛾生长的抑制作用最强,而基因虽然抑制活性不高,但可能会延缓小菜蛾对基因的耐受性.所以在未来工作中,将考虑针对这两种基因做田间试验,从长期角度进一步分析比较两种基因抗性.
3 结 语
随着生物转基因技术在农业上的广泛运用,人们对抗虫基因的认识不断深入,但目前对于相关抗虫基因的研究却很少.本研究针对4种基因、、、展开了抗虫分析,结果表明,4种基因对小菜蛾均表现出良好的抗性;使用酶化学法分析了抗虫途径及效果,结果表明其抗虫途径是基因编码产物通过抑制小菜蛾肠道内胰蛋白酶来行使其功能.短期来看,对小菜蛾的幼虫、蛹、成虫都表现出最强的抑制作用,可将其作为一种最具潜力的目标基因;但从害虫对基因产生耐受性这个角度思考,本研究认为可将作为一种最具潜力目标基因.总之,本研究为转基因抗虫植物提供了更多可供选择的目标基因,这将会在很大程度上延缓害虫对基因的耐受性.
[1] Santos-Amaya O F,Clebson S T,Hugo M M,et al. Genetic basis of Cry1F resistance in two Brazilian populations off all armyworm,Spodoptera frugiperda[J]. Crop Protection,2016,81(3):154-162.
[2] Herrero S,Yolanda B,Patriciav H M,et al. Susceptibility,mechanisms of response and resistance to Bacillus thuringiensis toxins in Spodoptera spp[J]. Current Opinion in Insect Science,2016,15(6):89-96.
[3] Xu L N,Wang Z Y,Zhang J,et al. Cross-resistance of Cry1Ab-selected Asian corn borer to other Cry toxins [J]. Journal of Applied Entomoloy,2010,134(5):429-438.
[4] Laskowski K. Protein inhibitors of proteinases[J]. Annu Rev Biochem,1980,49(7):593-626.
[5] Lingaraju M H,Gowda L R. A Kunitz trypsin inhibitor of Entada scandens seeds:Another member with single disulfide bridge[J]. Biochim Biophys Acta,2008,1784(5):850-855.
[6] Mc Manus M T,Laing W A,Watson L M,et al. Expression of the soybean(Kunitz)trypsin inhibitor in leaves of white clover(Trifolium repens L)[J]. Plant Science,2005,168(5):1211-1220.
[7] 罗玉娇,李 滨,舒衡平,等. Kunitz型胰蛋白酶抑制剂的研究进展[J]. 中国生化药物杂志,2012,33(3):316-319.
Luo Yujiao,Li Bing,Shu Hengping,et al. Research progress of Kunitz trypsin inhibitors[J]. Chinese Journal of Biochemical Pharmaceutics,2012,33(3):316-319(in Chinese).
[8] Hartl M,Giri A P,Kaur H,et al. Serine protease inhibitors specifically defend solanum nigrum against generalist herbivores but do not influence plant growth and development[J]. Plant Cell,2010,22(12):4158-4175.
[9] 江汉民,宋文芹,刘莉莉,等. 抗虫相关基因KTI对青花菜的转化及其对小菜蛾抗性的分析[J]. 园艺学报,2013,40(3):498-504.
Jiang Hanmin,Song Wenqin,Liu Lili,et al. Transformation of Brassica oleracea and its resistance to Plutella xylostella with resistance gene KTI[J]. Acta Horticulturae Sinica,2013,40(3):498-504(in Chinese).
[10] Ma Y,Zhao Q,Lu M Z,et al. Kunitz-type trypsin inhibitor gene family in Arabidopsis and Populus trichocarpa and its expression response to wounding and herbivore in Populus nigra[J]. Genetics & Genomes,2011,7(7):431-441.
[11] 畅 欣. KTI基因家族在模式植物中的抗虫机制[D]. 天津:天津大学化工学院,2011.
Chang Xin. Insecticidal Mechanism of KTI Gene Family in Model Plants[D]. Tianjin:School of Chemical Engineering and Technology,Tianjin University,2011(in Chinese).
[12] Giri A P,Harsulkar A M,Ku M S,et al. Identification of potent inhibitors of Helicoverpa armigera gut pro- teinases from winged bean seeds[J]. Phytochemistry,2003,63(7):523-532.
[13] 赵爱平,孙 聪,展恩玲,等. 蛋白酶抑制剂对梨小食心虫幼虫中肠蛋白酶活性的影响[J]. 昆虫学报,2016,59(10):1069-1078.
Zhao Aiping,Sun Cong,Zhan Enling,et al. Effect of protease inhibitor on midgut protease activity in pear borer Larvae[J]. Journal of Entomology,2016,59(10):1069-1078(in Chinese).
[14] 王 震,乔天磊,霍乃蕊,等. 植物叶蛋白提取及应用前景[J]. 山西农业科学,2015,43(12):1727-1731.
Wang Zhen,Qiao Tianlei,Huo Nairui,et al. Extraction and application prospects of plant leaf protein [J]. Shanxi Journal of Agricultural Sciences,2015,43(12):1727-1731(in Chinese).
[15] Goldring J. Spectrophotometric methods to determine protein concentration[C]//Methods in Molecular Biology. New York:Humana Press,2015:41-47.
[16] Wang H L,Swain E W,Wallen L L,et al. Free fatty acids as antitryptic factor in soybeans formulated by Rhizopus oligosporus[J]. Journal of Nutrition,1975,105(10):1351-1355.
[17] Wirnt R. Chymotrypsin measurements with N-benzoyl-L-tyrosin methyl ester as substrate[C]//Methods of Enzymatic Analysis. New York:Academic Press,1974:1009-1012.
[18] Yeh K W,Lin M I,Tuan S J,et al. Sweet potato trypsin inhibitors expressed in transgenic tobacco plants confer resistance against Spodoptera Litura[J]. Plant Cell Reports,1997,16(10):696-699.
[19] Broadway R M. Are insects resistant to plant proteinase inhibitors?[J]. Journal of Insect Physiology,1995,41(2):107-116.
[20] Yang L,Fang Z,Dicke M,et al. The diamondback moth,Plutella xylostella,specifically inactivates mustard trypsin inhibitor 2(MTI2)to overcome host plant defence[J]. Insect Biochem Mol Biol,2009,39(1):55-61.
(责任编辑:王新英)
Insect Resistance and Functional Analysis ofGene in Transgenic
Wang Jiehua,Mao Hongyu,Yang Shaohui
(School of Environmental Science and Engineering,Tianjin University,Tianjin 300072,China)
The Kunitz-type trypsin inhibitor(KTI) is a serine protease inhibitor that belongs to the protease inhibitor(PI)family. In this study,we selected fourgenes(,,,and) induced by mechanical trauma in,which were overexpressed inthat fed onto observe the physiological indicators of the entire growth and development cycle from larvae to adult moths and analyze their anti-insect effects. The results showed that the anti-insect effects of the fourgenes were in the order:>:>:>:. Among them,the survival rate offed withover-expressingwas only 9.8%. We also applied enzymatic chemistry to determine the function and effect of thegene-encoding product,which showed that theencoding product had no inhibitory effect on chymotrypsin,but had a strong inhibitory effect on trypsin. The effects were in the order:>:>:>:,which were consistent with the result ofresistance determination.
;;;resistance;functional analysis
10.11784/tdxbz201803017
Q785
A
0493-2137(2019)03-0242-07
2018-03-07;
2018-05-29.
王洁华(1973— ),女,博士,教授,jiehuawang@tju.edu.cn.
杨少辉,shaohuiyang77@tju.edu.cn.
