强直性脊柱炎髋关节韧带组织培养模型的建立及腺病毒转染的实验研究*
2019-01-21李虎李儒军曹宸喜王白成林剑浩陶可
李虎 李儒军 曹宸喜 王白成,2 林剑浩 陶可,3**
(1.北京大学人民医院骨关节科关节炎诊疗中心,北京100044;2.北京大学医学部,北京100191;3.德国洪堡医学院实验骨科研究所,萨尔D-66424)
强直性脊柱炎(ankylosing spondylitis,AS)是一种与炎症紧密相关的慢性进行性结缔组织疾病,以往研究证实,肌腱附着点异常骨化是其病变基础,成纤维细胞在致炎性因子作用下的成骨转化在AS病理性骨化病程中起重要作用[1-4]。
已有研究显示,成纤维细胞经过连续的二维传代培养后,细胞间由于缺乏有效的信息联络、缺乏细胞外基质的力学刺激和空间支撑及细胞生长的常规培养瓶硬度明显高于细胞外基质等原因而导致细胞出现明显“去分化”现象,细胞形态及细胞功能发生明显变化,可观察到细胞极性显著增多、细胞增殖与分泌等能力降低。因而,传统的二维培养条件不能满足重现细胞在体的真实生存环境[5-11]。为了解决以上问题,本研究拟通过构建和比较AS韧带组织体外原位(in situ)、AS韧带成纤维细胞二维体外(in vitro)及三维水凝胶体外(in vitro)培养模型,并用腺病毒转染修饰以上3种模型,旨在探索更适合的模拟AS韧带组织体内生存状态的体外培养模型,为AS发病机制及基因治疗的深入研究提供最佳的模型选择。
1 材料与方法
1.1 主要材料
DMEM培养液、Opti-MEM™、胎牛血清、0.25%胰蛋白酶+0.02%EDTA、PBS等试剂均购于Gibco公司,人胚胎肾293T细胞、重组5型腺病毒-半乳糖苷酶基因(rAd5-lacZ)等为本实验室保有,Ⅱ型胶原酶、HEPES(Sigma公司),限制性内切酶Xba1、PacⅠ、BamH1和EcoRⅠ等(Rothe公司),X-gal染色试剂盒(Rothe公司),IL-6和TNF-α的ELISA试剂盒(RD公司),Hoechst 33258、兔抗人vimentin抗体和兔抗人CD68多克隆抗体(Abcam公司),小鼠抗人β-gal抗体和Rhodamine标记的羊抗兔荧光二抗(Sigma公司),HE染液(Rothe公司),酶标仪(Bio-Rad公司),激光共聚焦显微镜(Confocal,Olympus公司)。
1.2 髋关节韧带组织的获取
本实验所需AS人髋关节韧带组织取自2014年9月至2016年9月北京大学人民医院骨关节科拟行髋关节置换的4例重度AS(髋关节强直)患者。所有患者均为男性,平均年龄(44.0±4.1)岁,排除骨关节炎(osteoarthritis,OA)、类风湿性关节炎(rheumatoid arthritis,RA)等疾病[1]。本研究经北京大学人民医院伦理委员会批准并获得所有患者的知情同意。
1.3 髋关节韧带成纤维细胞的培养与鉴定
成纤维细胞的分离与培养参照本课题组已建立的方法[12,13]。随后,按照本课题组已报道的方法[13]使用抗vimentin抗体对分离培养的细胞进行鉴定。实验用第2~5代细胞[2,13]。
1.4 髋关节韧带组织块原位、成纤维细胞体外二维贴壁和三维海藻酸盐水凝胶培养模型
首先,髋关节韧带组织原位(in situ)培养:借鉴Riera等[7]已建立的人半月板体外培养模型,结合本课题组前期制作的软骨组织块[14]及Liu等[15]和Evans等[16]构建的肌肉组织块模型进行髋关节韧带组织块取材。具体操作方法:采用直径2 mm特制取材器对新鲜髋关节周围韧带组织进行打孔取材,后将圆柱状标本(长6 mm,直径2 mm)置入24孔板中并加入10%胎牛血清培养基,置于细胞培养箱中。
其次,建立成纤维细胞体外(in vitro)二维培养模型[12,13]:将上述经鉴定的成纤维细胞经锥虫蓝染色、计数后分别接种于96孔板(1×104/孔)、预置有多聚赖氨酸处理的盖玻片的6孔板和75 cm2培养瓶中进行二维平面培养。
最后,按照本课题组已报道的方法,将成纤维细胞按2×106/ml接种于浓度为1.2%的海藻酸盐水凝胶中,制成三维水凝胶微球培养模型。
组织和细胞每3 d更换1次培养基。使用倒置相差显微镜、HE染色和抗vimetin蛋白免疫组织化学染色观察上述模型中成纤维细胞形态、分布以及细胞外基质合成等[12-14]。
1.5 rAd5-lacZ病毒载体的制备、鉴定与滴度检测
PCR法合成lacZ基因后,利用Invitrogen公司的TOPO定向克隆技术创建入门克隆pENTR/lacZ,转化细菌后,挑取阳性克隆,大量扩增并提取质粒;入门克隆再与表达载体pAd/CMV/V5-DEST进行同源重组反应,得到病毒载体pAd/CMV/V5-lacZ,转化细菌后挑选阳性克隆,摇菌提取重组病毒质粒,酶切法对上述腺病毒载体质粒进行鉴定。采用PacⅠ内切酶线性化后,转染293T细胞得到重组腺病毒载体,阴离子柱层析法进行纯化,通过OD260法进行滴度检测[13-18]。
1.6 rAd5-lacZ转染与实验分组
将上述纯化的含rAd5-lacZ病毒液分别加入上述髋关节韧带组织(105个细胞/组织块/30 μl)、二维贴壁(104个细胞/孔/3 μl)和三维水凝胶微球(106个细胞/300 μl)培养模型,静置1 min,加入无血清DMEM培养基,轻轻振荡使病毒与组织或细胞充分接触,1.5 h后加入10%胎牛血清培养基,每3 d更换1次培养基继续培养至14 d。以上3种模型实验中均分为2组:无病毒转染组和rAd5-lacZ转染组[13-18]。
1.7 rAd5-lacZ转染效率的检测
本实验中采用X-gal活组织染色和抗β-gal免疫组织化学染色相结合,对比3种模型中rAd5-lacZ转染效率。首先,X-gal染色定性检测rAd5-lacZ转染结果:将上述模型中经rAd5-lacZ转染的组织或细胞标本使用甲醛溶液固定后,加入新鲜配置的X-gal染液,于30 min、1 h、2 h光镜下观察并拍照[13,14]。其次,抗β-gal免疫组织化学染色定量检测rAd5-lacZ转染效率,即计数阳性细胞数/光镜下的总细胞数×100%,具体实验操作如下:组织和三维水凝胶标本使用甲醛溶液常规固定后经梯度乙醇脱水、二甲苯透明后,石蜡包埋切片,厚度为3 μm,小鼠抗人β-gal一抗液(1∶100)孵育过夜,兔抗小鼠二抗孵育30 min,DAB显色,中性树胶封片;二维细胞标本抗β-gal抗体染色采用与上述1.3中抗vimentin抗体对细胞鉴定相似的方法,将荧光二抗替换成兔抗小鼠二抗孵育30 min,DAB显色,光镜下观察并拍照[13,14]。以上各组实验均重复3次。
1.8 rAd5-lacZ转染后的细胞增殖能力检测
rAd5-lacZ转染14 d后,分别收集组织和细胞标本,进行如下操作:HE染色并计数单位面积下的细胞数和Hoechst 33258 检测细胞 DNA 含量[13,14],来反映rAd5-lacZ转染对成纤维细胞增殖的影响。同样地,分别以无病毒转染的DNA含量为基线经调整后,得到3种模型的DNA含量增加率。
1.9 rAd5-lacZ转染后的致炎性细胞因子分泌
rAd5-lacZ转染第13天时,更换无血清DMEM培养基,24 h后收集培养体系中的上清液,移入无菌Eppendorf管中,置入-80℃,备测。使用IL-6和TNF-α ELISA试剂盒分别检测lacZ过表达对两者分泌的影响。根据样本OD260值确定样本中IL-6和TNF-α在标准曲线上的位置,进而计算得出相应浓度[13,17,18]。以上步骤重复3次,结果取平均值。
1.10 统计学方法
采用SPSS 23.0软件进行统计学分析。3组间比较采用单因素方差分析(LSD法),组间两两比较采用Student t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 AASS髋关节韧带组织与细胞形态学观察及抗VVii--meennttiinn蛋白鉴定
AS髋关节原代细胞贴壁生长,呈长梭形,有突出的两极,胞质丰富,细胞核明显,其间夹杂少量多角突起样细胞。采用多次差别酶消化法和反复贴壁传代法纯化细胞,经2次连续传代后,95%以上细胞为长梭形成纤维细胞样细胞。采用本课题组的方法[13],对上述第2~5代细胞进行免疫荧光染色,检测Vimentin蛋白表达示,2种细胞抗Vimentin蛋白均呈阳性,证实分离的细胞为成纤维细胞[13]。同样地,对AS髋周关节囊韧带组织进行免疫荧光染色及鉴定,显示含有大量的成纤维细胞,计数为(537±25)/mm2。
2.2 重组腺病毒载体鉴定和滴度检测
采用酶切法对已制备的腺病毒载体质粒进行鉴定,结果出现3个不同条带,分别为完整的lacZ基因、除lacZ基因外的腺病毒载体片段及完整(或未酶切)的腺病毒载体质粒,表明成功构建病毒载体质粒pAd/CMV/V5-lacZ。对已包装纯化好的重组腺病毒载体进行滴度检测和感染效力测定,最终得到的rAd5-lacZ滴度为每毫升1×1011病毒颗粒,病毒感染复数(multiplicity of infection,MOI)为10±2[13,14(]图1)。
2.3 rAd5-lacZ对 33种不同培养模型的转染效率检测
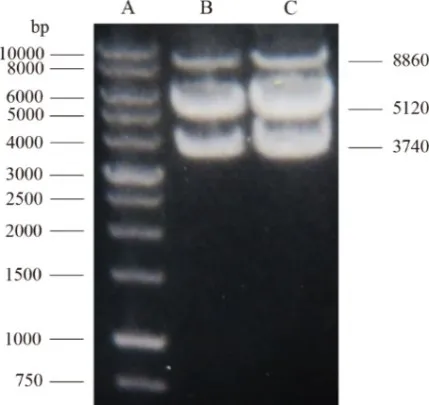
图1 重组腺病毒载体pAd/CMV/V5-lacZ的酶切产物电泳图
采用直径2 mm特制取材器对新鲜髋关节周围韧带组织进行打孔取材(图2),得到圆柱状原位(in situ)培养标本(长6 mm,直径2 mm);后置入24孔板中,分别加入30 μl rAd5-lacZ转染(lacZ组)或等量DMEM培养液(无病毒转染组),14 d后行X-gal染色,大体观察可见lacZ组呈明显深蓝色,无病毒转染组为淡褐色(图3);将上述组织标本行病理组织包埋并切片,光镜下显示lacZ组呈弥漫性蓝色,细胞出现深蓝色染色,为阳性反应,无病毒转染组为淡灰色,未见蓝色着色(图4)。随后,对成纤维细胞2D培养模型在病毒转染14 d时进行X-gal染色,显微镜下显示lacZ组呈明显深蓝色,无病毒转染组为无色(图5)。相似地,rAd5-lacZ转染3D成纤维细胞海藻酸盐水凝胶微球培养模型14 d后也行X-gal染色,lacZ组呈明显深蓝色,无病毒转染组为无色透明(图6)。
上述3种培养模型在rAd5-lacZ转染后培养14 d,常规行病理组织/细胞学固定,抗β-gal免疫组织化学染色(韧带组织和3D水凝胶微球)和免疫细胞化学染色(成纤维细胞,图7),光镜下计数抗β-gal免疫组化染色阳性细胞数/光镜下的总细胞数,得出rAd5-lacZ转染 3种模型效率[13,14],分别为 65.84%、72.26%和75.39%,差异无统计学意义(F=0.87,P>0.05)。
2.4 rAd5-lacZ对 33种不同培养模型细胞增殖的影响
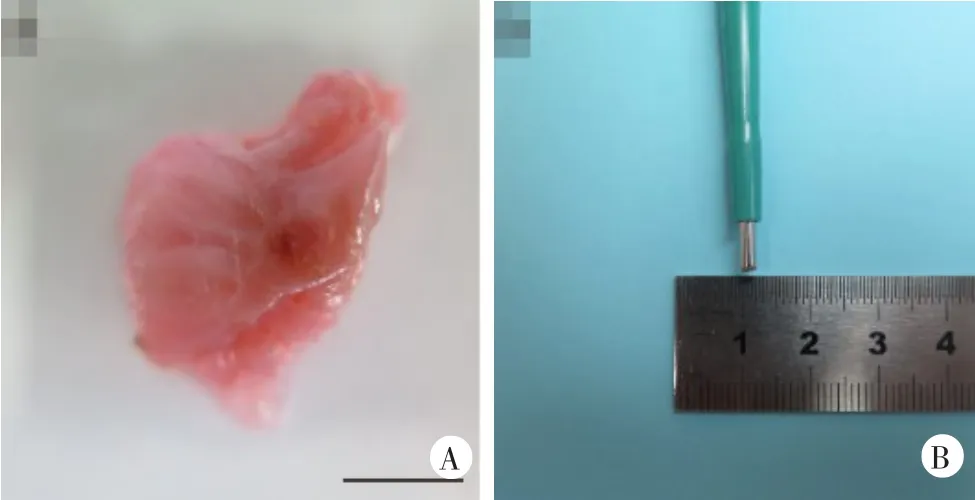
图2 构建AS髋关节韧带组织原位培养模型

图3 AS韧带原位培养组织rAd5-lacZ转染及X-gal染色的大体观察

图4 AS韧带原位培养组织rAd5-lacZ转染及X-gal染色
以相同单位rAd5-lacZ病毒量转染上述3种模型14 d后,发现相同单位rAd5-lacZ病毒量转染后,2D单层细胞培养模型中细胞增殖明显,但细胞“去分化”现象亦最明显,表现为细胞极性显著增多、细胞核及胞质区较前缩小,而原位韧带组织和3D水凝胶微球中细胞形态前后无明显变化。随后,分别以不同模型中无病毒转染的细胞增殖为参照,经调整后定量分析得到AS髋关节原位韧带组织、3D水凝胶微球和2D单层细胞培养等3种模型的细胞增殖率,即(转染第14天时的测量值/转染开始第1天时的测量值)/(非转染第14天时的测量值/非转染开始第1天时的测量值),来反映rAd5-lacZ转染对成纤维细胞增殖的影响,结果分别为ISCH1、ISCH1和1.31倍,差异有统计学意义(F=12.21,P<0.05);而AS韧带组织原位培养和3D水凝胶培养条件下的细胞增殖效率相似,差异无统计学意义(t=0.71,P>0.05)。同样地,分别以各组无病毒转染的DNA含量为基线经调整后,得到3种模型的DNA含量增加率,分别为1.67、1.83和3.61,差异有统计学意义(F=14.91,P<0.05),而韧带组织原位培养和3D水凝胶培养条件下的细胞DNA含量增加率相似,差异无统计学意义(t=1.37,P>0.05)。
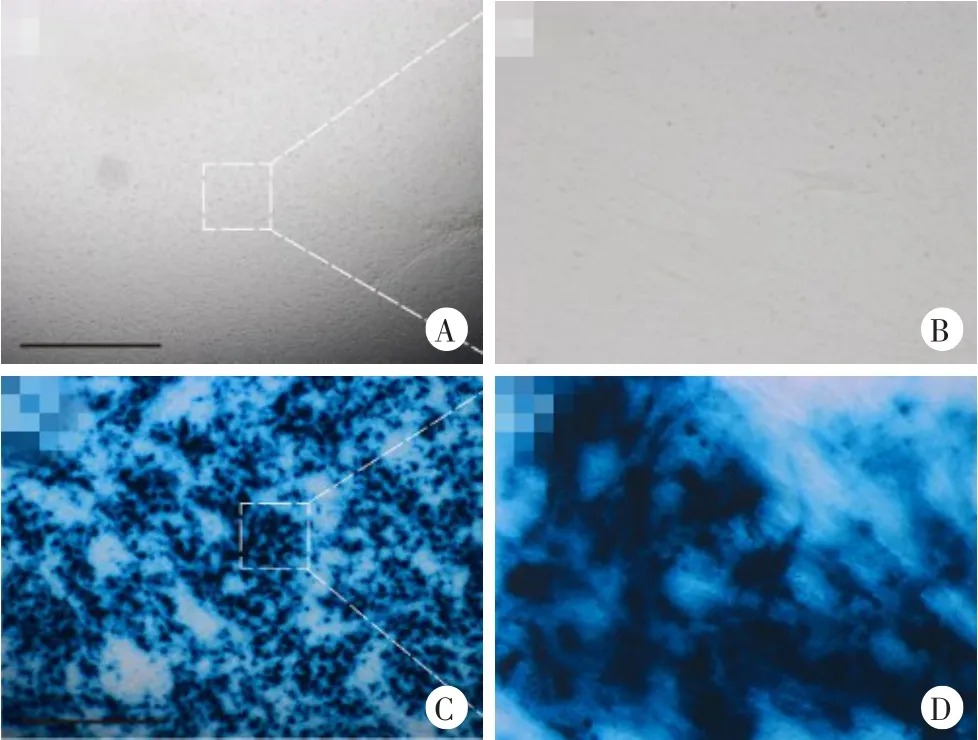
图5 AS韧带成纤维细胞单层培养模型(2D,in vitro)的rAd5-lacZ转染及X-gal染色
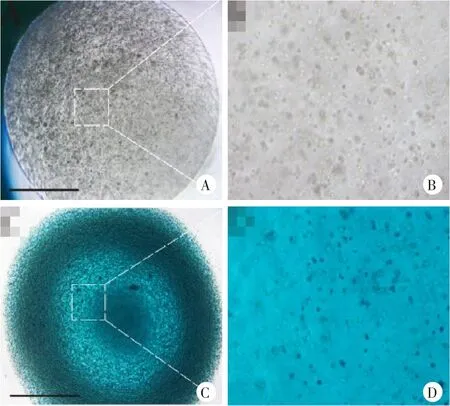
图6 成纤维细胞水凝胶接种培养模型(3D,in vitro)的rAd5-lacZ转染及X-gal染色
2.5 rAd5-lacZ转染对致炎性细胞因子分泌的影响
以相同单位rAd5-lacZ病毒量转染上述3种模型13 d后,采用与细胞增殖率相同的方法[13-16],以不同模型中无病毒转染的IL-6或TNF-α分泌为参照经调整后,定量分析得韧带原位组织块、3D水凝胶微球和2D单层细胞培养3种模型中的IL-6或TNF-α分泌量增加率,即(转染第14天时的测量值/转染开始第1天时的测量值)(/非转染第14天时的测量值/非转染开始第1天时的测量值),结果显示3种模型中IL-6分泌量分别增加了5.04、1.64和ISCH0倍,TNF-α分泌量分别增加了6.88、2.17和2.14倍,差异均有统计学意义(F=282.67、350.18,P均<0.01);而AS韧带组织原位培养和3D水凝胶培养条件下的IL-6及TNF-α分泌量均相似,差异无统计学意义(t=1.44、1.83,P均>0.05)。
3 讨论
AS是累及中轴关节并可波及外周关节、肌腱韧带附着点及其他组织的慢性炎症性进行性全身结缔组织疾病,以骶髂关节炎、肌腱端炎和脊柱炎为特点。国人AS发病率为0.23%,据此估算全国约有300万患者[1-4]。由于AS病因尚未完全明确,缺乏特异性实验室指标及有效的治疗手段,晚期病情加重时常出现脊柱强直、关节畸形,且不能逆转,常导致患者功能丧失,是青壮年致残的主要原因[1-4]。如果在AS发病初期,针对病因进行相应的处理,能显著缓解其骨性强直的疾病进展[19,20]。然而,已有的研究证据表明,体外细胞所处的环境与其在体内的相差甚大,导致体外实验结果往往与体内的相差较远,不能完全作为临床试验的可靠依据[5-8]。所以,构建理想的AS体外培养研究模型,深入探索其病因,明确引起肌腱附着点软组织异常钙化骨化的细胞与致炎性细胞因子成分及相关信号通路转导机制、药物与基因治疗靶点及其作用途径显得尤为重要。为此,本课题组在前期已建立的软骨组织块培养模型基础上[14],结合Riera等[7]的人半月板以及 Liu 等[15]和Evans等[16]构建的肌肉组织块体外培养模型,成功构建髋关节韧带组织原位(in situ)培养模型;随后,对韧带组织用酶消化法得单个细胞,接种于预置玻片的6孔板中,建立成纤维细胞体外(in vitro)2D培养模型;并将成纤维细胞按2×106/ml接种于海藻酸盐水凝胶中,制作3D水凝胶微球培养模型。
在成功建立上述3种不同培养模型的基础上,本课题组探索了引起肌腱附着点软组织异常钙化骨化细胞的研究。Vimentin蛋白主要存在中胚层间叶组织中,是重要的细胞骨架蛋白,常密集环绕在核周,形成波形纤维网,并与核膜下的层粘连蛋白相连,参与细胞的生长分化及迁移游走,常作为成纤维细胞的特异性标记物用于鉴定;而CD68被认为是巨噬细胞特异性标志物[12,13]。本研究采用免疫荧光染色分别检测AS髋关节韧带组织及分离的细胞Vimentin、CD68蛋白表达情况,结果显示分离的第2~5代细胞抗Vimentin蛋白呈明显阳性,CD68蛋白阴性,证实分离的细胞为成纤维细胞;同样地,AS髋关节韧带组织进行抗Vimentin蛋白免疫荧光染色,显示有大量的成纤维细胞,计数为(537±25)/mm2,其间分布有少量CD68阳性的细胞,推测可能是AS韧带组织中固有的巨噬细胞;另外也有可能是炎症时,巨噬细胞游走于韧带组织间隙[1-4,19,20]。以上结果也与 Yang等[2]的研究发现一致,均表明成纤维细胞作为关节周围结缔组织的主要细胞,可能在炎性介质趋化作用下增殖并合成大量胶原基质,这也是导致结缔组织增生及纤维化进而异常钙化骨化的主要病理学基础。
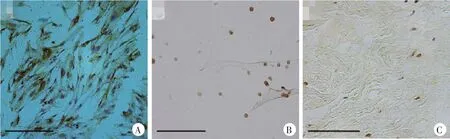
图7 免疫组织化学染色检测rAd5-lacZ转染效率
基因治疗是指将外源正常基因导入靶细胞,以纠正或补偿因基因缺陷和异常引起的疾病,达到治疗目的,被认为是21世纪最伟大的科学工程和最重要的医学革命之一和治疗慢性疾病(如肿瘤、老年神经退行性疾病)最有效的手段之一[21]。由于AS病程迁延、致病机制尚未明晰且缺乏特异性的治疗药物,而基因治疗通过多种病毒或非病毒的载体携带AS病理性骨化关键靶分子的抑制剂等基因导入至韧带、肌腱附着点成纤维细胞内,通过直接的细胞自分泌或周围细胞的旁分泌作用阻断AS异常钙化骨化的过程,达到控制AS疾病进展的目的,为AS发病机制的探索、靶向治疗新药物的开发提供了新的思路。近年来,随着基因治疗的蓬勃发展,尤其是腺病毒临床前临床期安全性、有效性的不断验证[22],其也被较广泛应用于转染骨骼肌肉系统(如软骨、韧带或滑膜组织)的体内外研究中[23]。
在此基础上,本研究尝试着使用已成功构建的rAd5-lacZ病毒载体转染AS韧带原位组织块、3D水凝胶微球和2D单层细胞培养3种模型,检测病毒载体转染效率、转染前后的细胞增殖和致炎性细胞因子(IL-6和TNF-α)分泌等变化情况。
首先,在腺病毒转染效率的研究中,Liu等[15]和Evans等[16]利用腺病毒携载骨形态发生蛋白-2(Ad-BMP-2)能有效转染肌肉组织块培养模型,且随着Ad-BMP-2浓度的增加,转染效率不断提高。本研究以相同单位rAd5-lacZ病毒量转染上述3种模型14 d后,X-gal定性染色检测rAd5-lacZ转染结果,光镜下发现3种模型中的lacZ组均呈明显蓝色着色,为阳性反应,无病毒转染组未见蓝色染色。抗β-gal免疫组化染色的结果显示,rAd5-lacZ转染3种模型效率分别为65.84%、72.26%和75.39%,差异无统计学意义,这也表明本课题组成功构建的rAd5-lacZ病毒载体在体外能有效转染3种模型,“穿透”进入组织深层,为后续实验研究提供可靠依据。
其次,腺病毒转染对成纤维细胞增殖影响方面,Kornberg等[24]在人肺微血管内皮细胞研究中发现,腺病毒自身具有促进血管生成活性,能刺激细胞增殖、迁移、血管化形成和黏着斑激酶磷酸化。随后,有学者利用Ad-绿色荧光蛋白(GFP)转染大鼠间充质干细胞实验中,证实Ad-GFP可高效转染间充质干细胞,但对细胞增殖能力无明显影响[25]。然而,也有学者将Ad-增强绿色荧光蛋白(EGFP)导入鳞状细胞癌细胞系TCa83细胞后,发现细胞存活率随时间延长逐渐下降[26]。近期,翁习生等[27]报道了腺病毒携载增强绿色荧光蛋白在体外能转染关节软骨细胞,对软骨细胞表型影响较明显,表现为Ⅱ型胶原合成能力明显下降。为了探讨对腺病毒转染对成纤维细胞增殖影响,本研究对AS韧带原位组织块、3D水凝胶微球和2D单层细胞培养3种模型转染相同单位rAd5-lacZ病毒量,14 d后发现2D单层细胞培养模型中细胞增殖明显,但细胞“去分化”现象亦最明显,表现为细胞极性显著增多、细胞核及胞质区较前缩小,而原位韧带组织和3D水凝胶微球中细胞形态前后无明显变化。而rAd5-lacZ对细胞增殖效率影响方面,结果发现rAd5-lacZ转染能促进3种模型中的成纤维细胞的增殖,尤其以2D单层细胞培养增加最为明显,是其余两者的ISCH8倍,而AS韧带组织原位培养和3D水凝胶培养条件下的细胞增殖效率相似,差异无统计学意义。
最后,本研究进行了腺病毒转染对成纤维细胞功能影响的研究。Gratacós等[28]研究发现,AS患者致炎性细胞因子(IL-6和TNF-α)水平明显升高,且IL-6与AS疾病活动度密切相关。随后,Bal等[29]通过检测血清中可溶性白细胞介素-2受体(sIL-2R)、IL-6和TNF-α的水平后,认为IL-6和TNF-α在AS的发病机制中发挥重要作用,且其水平可作为疾病活动度和诊断的评估工具。故在本实验中,本课题组采用致炎性细胞因子分泌(IL-6和TNF-α)来反映rAd5-lacZ转染对成纤维细胞功能的影响[13]。定量分析结果显示,3种模型中以2D单层细胞培养的IL-6或TNF-α分泌量增加率最高,分别达到了5.04和6.88倍,显著高于其他2种模型中的增加率,是其余两种模型的3.08、4.59倍和3.17、3.22倍,而AS韧带原位组织块培养和3D水凝胶培养条件下的IL-6或TNF-α分泌量增加相似。
本研究结果表明,韧带组织原位培养和成纤维细胞3D水凝胶培养能更好地模拟AS韧带成纤维细胞在体的生存环境,是较为理想的体外培养模型,且rAd5-lacZ能在一定时间内(至少14 d)有效转染以上模型,但值得注意的是,腺病毒转染对细胞的增殖能力和功能状态可能产生有一定的影响,应在未来实验中予以重视。本研究结果为建立有效的AS韧带体外培养及基因修饰模型提供实验基础。
