1株药用纤孔菌的鉴定及其生物活性
2019-01-19金珊珊侯若琳俞全明王丹亭胡开辉郑明锋傅俊生
金珊珊,刘 鑫,侯若琳,俞全明,王丹亭,胡开辉,,郑明锋,傅俊生,
(1 福建农林大学(古田)菌业研究院,福建古田县食用菌研发中心,福建 古田 352200;2 福建农林大学a食品科学学院,b生命科学学院,福建 福州 350002;3 宁夏回族自治区中卫市沃峰生物有机肥有限公司,宁夏 中卫 755000)
粗毛纤孔菌Inonotushispidus(Bull.:Fr )P.Karst.,属于担子菌门Basidiomycota、伞菌纲Agaricomycetes、锈革孔菌目Hvmenochaetales、锈革孔菌科Hymenochaetaceae、纤孔菌属Inonotus[1]。粗毛纤孔菌是兼性腐生菌,以寄生为主,寄主主要有水曲柳、榆树、杨树、日本槐和桑树,在东北地区以水曲柳上常见,在西北地区以桑树上常见[2],其常常被误认为是桑黄。但桑黄及其相近种类往往对寄主树木具有专一性,且子实体为多年生,而粗毛纤孔菌没有这一特性[3]。粗毛纤孔菌是一种药用真菌,国内外对粗毛纤孔菌的研究主要集中在其子实体的活性等方面,如抗病毒[4]、抗衰老[5]、降血脂[6]、提高免疫力[7]等生物活性。大型真菌的传统分类主要依据子实体的形态和孢子等特征进行,但有时受环境影响,同一物种的形态可能会表现出较大差异,给分类和鉴定带来了一定的困难;而分子生物学鉴定技术受环境影响较小,鉴定过程更容易,结果也更准确[8]。目前,用于真菌分类研究的分子生物学技术主要包括RAPD[9]、ITS[10-11]和AFLP[12]等,其中ITS序列具有进化速率快、稳定性好和测序方便的特点,已经应用于多种真菌种属水平的分类鉴定和遗传多样性等研究中[13-18]。
目前,尚未见关于粗毛纤孔菌遗传多样性及其深层发酵液抗氧化、抗菌活性的研究报道。为此,本试验对1株野生粗毛纤孔菌进行了分类鉴定,并基于ITS序列对其进行了遗传多样性分析,初步探讨了其深层发酵液的抗氧化、抗菌活性,以期为更好地开发利用这一珍稀菌种资源提供依据。
1 材料与方法
1.1 材 料
1.1.1 供试菌株 粗毛纤孔菌菌株C1子实体采于宁夏中卫市的野生枣树树干(菌株ITS序列NCBI登录号:MF183947),分离纯化培养的菌丝保存于福建农林大学生命科学学院微生物工程实验室。
1.1.2 主要仪器与试剂 主要仪器包括高压蒸汽灭菌锅(MJ-54A型,上海施都凯仪器设备有限公司)、超净工作台(SW-CJ-2F型,苏州净化设备有限公司)、高速冷冻离心机(ST16R型,美国Thermo公司)和PCR扩增仪(Mycycler型,美国Bio-Rad公司),主要试剂有真菌DNA提取试剂盒(Solarbio公司)、二苯基苦味酰基苯肼(DPPH)(Sigma公司),另有乙醇、硫酸亚铁、水杨酸等,均为国产分析纯。
马铃薯葡萄糖液体培养基(PDB):马铃薯(去皮)200 g、葡萄糖20 g,沸水煮沸30 min,3层纱布过滤,加水定容至1 L,pH自然;马铃薯葡萄糖固体培养基(PDA):1 L PDB中加18~20 g琼脂,121 ℃高压灭菌30 min后制得。
1.2 方 法
1.2.1 菌株的分离纯化与形态学鉴定 用蘸有体积分数75%酒精的脱脂棉球将供试菌株子实体表面擦净,用灭菌的手术刀将其纵向剖开,在切面的中心部位切取一小块菌组织,用灭菌镊子夹取置于加抗生素的PDA平板培养基上,25 ℃培养,长出菌丝后再转入到PDA试管斜面培养基中保藏。
参照崔宝凯等[19]和中国真菌志第29卷中有关粗毛纤孔菌的鉴定方法对菌株进行形态学鉴定。首先将试管菌株接入平板PDA 培养基活化,待长满后用直径0.6 cm 的打孔器制备菌饼,接种至PDA平板中央,25 ℃培养,每天观察菌落形态、颜色等性状。采用插片法观察菌株C1的菌丝形态,具体方法为:在距离菌饼2 cm处,将灭菌盖玻片倾斜45°插入培养基中,25 ℃培养7 d后用镊子取出盖玻片,有菌丝面朝上置于载玻片上,显微镜下观察菌丝形态特征;收集子实体中的孢子,置显微镜下观察。
1.2.2 菌株的分子鉴定与系统发育分析 (1)rDNA ITS测序。将供试菌株接种到常规PDA 斜面培养基[20]上,25 ℃培养7 d,得到菌丝备用。挑取少量菌丝,利用真菌DNA提取试剂盒提取基因组DNA,以ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)为引物[21],扩增菌株C1的rDNA ITS序列。PCR反应体系为:10×TaqBuffer 2.5 μL,dNTP(10 mmol/L)2 μL,模板DNA约50 ng,ITS1和ITS4各1 μL,TaqDNA聚合酶0.25 μL,ddH2O补足至25 μL。PCR扩增条件为:94 ℃预变性10 min;94 ℃变性1 min,55 ℃退火55 s,72 ℃延伸1 min,共30个循环;72 ℃终延伸10 min,4 ℃终止反应。将PCR产物送至上海生工生物工程技术服务有限公司测序。
(2)分子鉴定与系统发育分析。通过Blastn功能,将测序后的菌株C1 rDNA序列在GenBank(http://www.ncbi.nlm.nih.gov)中进行同源比对;选取同源性较高的序列及其他种属真菌rDNA ITS序列[22],用DNAMAN version 6和Clustal X version 1.8编辑后,采用MEGA 6.0的Neighbor-Joining法构建系统发育进化树[23],用樟芝(Antrodiacamphorata)作为外群进行1 000次自展抽值,以检验分子进化树的可靠性[24],判断菌株C1所处的分类学地位,并以Kimura 2-parameter模型计算菌株间的遗传距离[25]。以Gonzalez等[26]公布的Inonotus属真菌rDNA ITS序列为参照,对菌株C1与NCBI数据库收录的来自全球不同地域的15个粗毛纤孔菌rDNA ITS序列进行界定,除去5′端18S rDNA及3′端28S rDNA序列,保留ITS1-5.8S-ITS2序列。以Clustal X version 1.8进行序列两两比对及多序列比对,对比对结果进行人工修正,对位排列结果中若有空位或缺失数据均作删除处理。
1.2.3 粗毛纤孔菌深层发酵液提取物的抗氧化与抗菌活性 (1)深层发酵液提取物的制备。将试管菌种接到平板培养基上进行活化,活化完后将平板打孔,将菌片接入PDB液体培养基,于25 ℃避光发酵培养45 d。发酵完成后,收集并浓缩发酵液,用乙酸乙酯进行萃取,将萃取液减压蒸馏浓缩成干膏,用于抗氧化及抗菌试验。
(2)羟基自由基清除率的测定。羟基自由基清除能力测定参照白生文等[27]的方法,采用水杨酸-硫酸亚铁法测定。在试管中依次加入9 mmol/L的水杨酸-乙醇溶液、9 mmol/L的FeSO4溶液、不同质量浓度(0.2,0.4,0.8,1.2,1.6,2.0 mg/mL)的样品溶液和8.8 mmol/L的H2O2溶液各1 mL,最后加蒸馏水补至15 mL,摇匀,置于37 ℃水浴中反应15 min,在波长510 nm处测定吸光度AX,以蒸馏水1 mL替代样品溶液测定吸光度A0,以蒸馏水1 mL替代H2O2测定吸光度AX0,根据下式计算清除率。重复3次,取平均值。
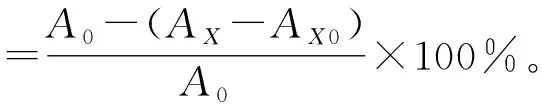
(3)DPPH自由基清除率的测定。DPPH自由基清除能力的测定参照Saiga等[28]的方法。取不同质量浓度(0.2,0.4,0.8,1.2,1.6,2.0 mg/mL)的样品溶液2 mL和2×10-4mol/L的DPPH无水乙醇溶液2 mL,加入试管中摇匀,室温下密闭静置30 min,于波长517 nm处测得吸光度Ai,再于波长517 nm处测2 mL DPPH+2 mL蒸馏水的吸光度Ac和2 mL样品+2 mL无水乙醇的吸光度Aj。根据下式计算DPPH自由基清除率。重复3次,取平均值。
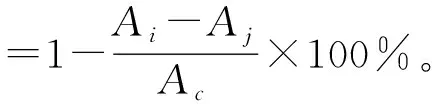
1.2.4 粗毛纤孔菌深层发酵液提取物的抗菌活性[29-32]采用双倍稀释法,将粗毛纤孔菌发酵液提取物浸膏配制成质量浓度分别为20,10,5,2.5,1.25,0.625 mg/mL的抑菌液,备用;在超净工作台上,用一次性无菌注射器吸取100 μL指示菌(分别为肺炎克雷伯菌、铜绿假单胞杆菌、大肠杆菌、金黄色葡萄球菌)悬液(浓度约2.3×106CFU/mL),注入培养基中,并用无菌三角涂布棒将其涂布均匀后备用;使用三点接种法用镊子分别将浸有不同质量浓度粗毛纤孔菌抑菌液、2 mg/mL链霉素水溶液(阳性对照)和二甲基亚砜水溶液(阴性对照)的滤纸片(直径8 mm),放在测试菌平板上,各重复3次。将以上平板倒置于37 ℃恒温培养箱中培养24 h,测量抑菌圈直径,取平均值。
1.2.5 粗毛纤孔菌深层发酵液提取物抗氧化和抗菌活性的稳定性[33]取6份2 mg/mL的粗毛纤孔菌发酵液提取物样品溶液,分别置于0,20,40,60,80,100 ℃下处理30 min,按照1.2.3节的方法,测定DPPH自由基清除率;同理,以金黄色葡萄球菌为指示菌,按照1.2.4节的方法,测抑菌圈直径。取6份2 mg/mL的粗毛纤孔菌样品溶液,分别用紫外光照射0,1,2,3,4,5 h,按照1.2.3节的方法,测定DPPH自由基清除率;取6份20 mg/mL的粗毛纤孔菌发酵液提取物样品溶液,分别用紫外光照射0,1,2,3,4,5 h,以金黄色葡萄球菌为指示菌,按照1.2.4节的方法,测抑菌圈直径。根据试验结果,判断该菌抗氧化和抗菌活性的稳定性。
1.2.6 数据处理及分析 试验数据用“平均值±标准差(x±s)”表示,用SPSS 13.0统计软件分析处理。两组间的均数比较采用t检验法,P<0.05表示有统计学意义。
2 结果与分析
2.1 粗毛纤孔菌的形态学鉴定
菌株C1的菌落为圆形,初期菌丝白色,呈绒毛状沿着接种块向外辐射状生长(图1-a),后期菌丝变成黄色,无明显环纹(图1-b);显微镜下菌丝生长初期无色透明,极少分枝,菌丝有不明显的分隔(图1-d,e);老熟菌丝细胞液变成淡黄色(图1-f);菌丝在Melzer和棉蓝试剂中均无变色反应。子实体表面有大量褐色粗毛(图1-g);担孢子椭圆形,金黄褐色,明显厚壁,在Melzer试剂中无变色反应,大小为(8.5~10) μm×(6.3~8.6) μm,平均长9.25 μm,平均宽7.45 μm(图1-c)。以上特征与中国真菌志第29卷中对粗毛纤孔菌特征的描述相吻合,初步判断菌株C1为粗毛纤孔菌(Inonotushispidus)。
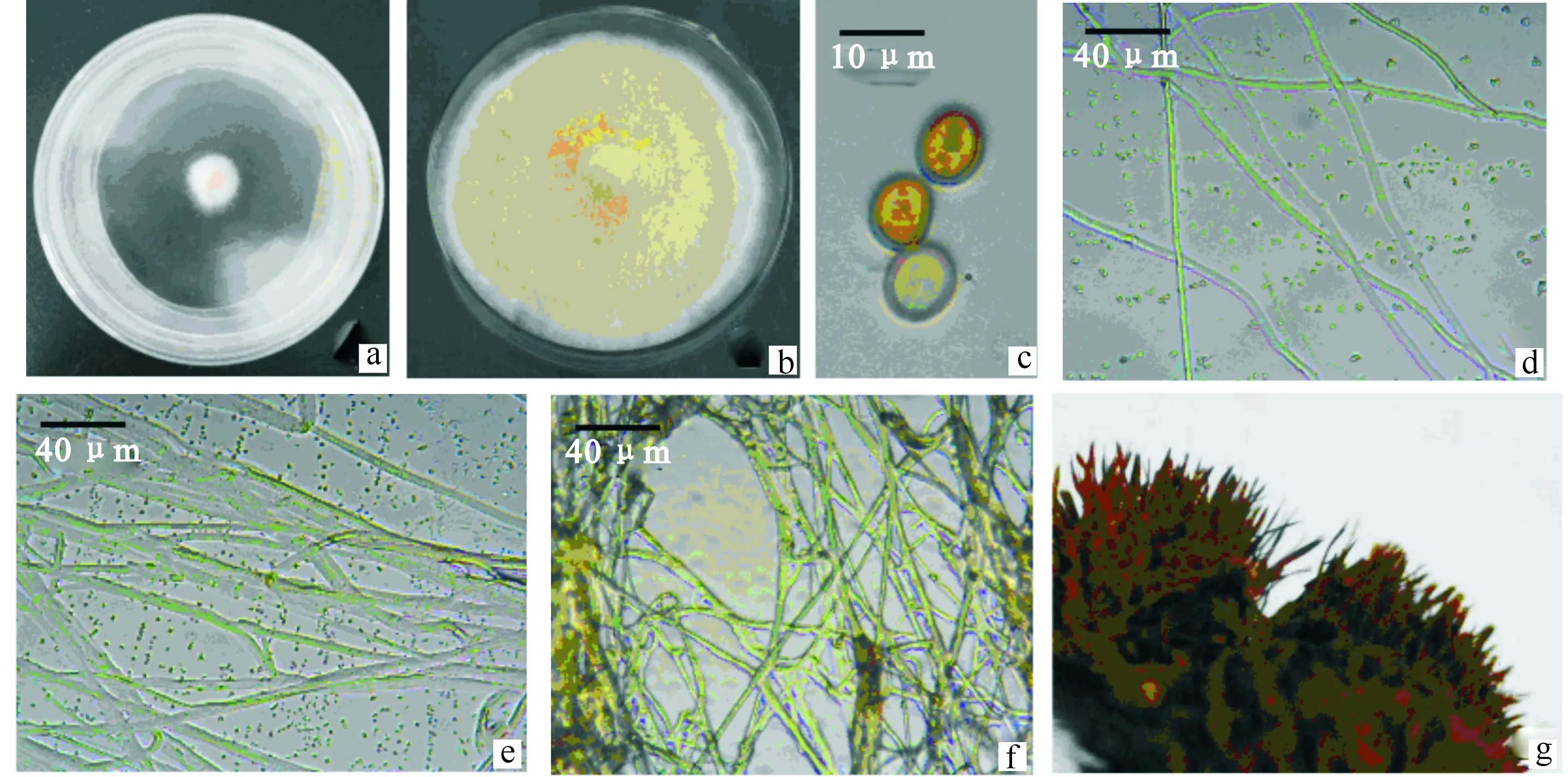
a.生长初期菌落;b.生长后期菌落;c.担孢子;d.初始阶段菌丝;e.旺盛期菌丝;f.老熟菌丝;g.褐色粗毛
a.Colony at early stage of growth;b.Colony at later stage of growth;c.Spore bearing;d.Initial stage hyphae;e.Vigorous hypha;f.Mature mycelium;g.Brown shag
图1 菌株C1的形态学鉴定
Fig.1 Biological identification of strain C1
2.2 粗毛纤孔菌的分子鉴定与系统发育分析
通过PCR扩增和测序发现,菌株C1的rDNA ITS序列与GenBank中粗毛纤孔菌KP446596的rDNA ITS序列最为接近(相似度为98%),结合形态学鉴定结果,可确定该菌株为粗毛纤孔菌(I.hispidus)。选取9株同源性较高的纤孔菌属rDNA ITS序列用Neighbor-Joining法构建系统发育进化树,以樟芝(A.camphorata)为外群,结果见图2,菌株间的遗传距离结果见表1。
由图2和表1可见,粗毛纤孔菌与安德松纤孔菌(I.andersonii)亲缘关系较近,遗传距离为0.061;剖氏纤孔菌(I.patouillardii)与里克纤孔菌(I.rickii)聚为一族,遗传距离为0.004,两者亲缘关系非常近;拟栎核纤孔(I.subdryophila)与柽柳核纤孔菌(I.tamaricis)聚为一族,遗传距离为0.072;薄壳纤孔菌(I.cuticularis)与桦纤孔菌(I.obliquus)未聚为一族,其遗传距离为0.123,亲缘关系较远。

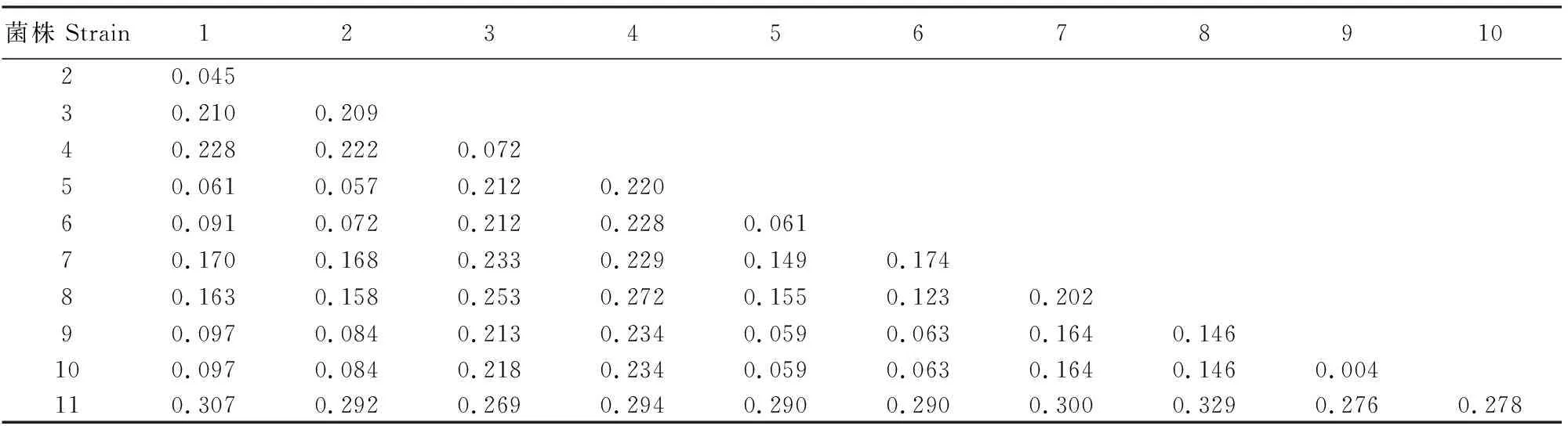
图2 10株纤孔菌rDNA ITS序列的系统发育树Fig.2 Phylogenetic tree of 10 Inonotus strains based on rDNA ITS sequence
注:1.菌株C1;2.粗毛纤孔菌;3.拟栎核纤孔;4.柽柳核纤孔菌;5.安德松纤孔菌;6.薄壳纤孔菌;7.纤孔菌;8.桦纤孔菌;9.剖氏纤孔菌;10.里克纤孔菌;11.樟芝。
Note:1.Strain C1;2.Inonotushispidus;3.Inocutissubdryophila;4.Inocutistamaricis;5.Inonotusandersonii;6.Inonotuscuticularis;7.Inonotussp.;8.Inonotusobliquus;9.Inonotuspatouillardii;10.Inonotusrickii;11.Antrodiacamphorata.
基于ITS1-5.8S-ITS2序列对菌株C1与NCBI数据库中收录的来自全球不同地域的15株粗毛纤孔菌进行遗传多样性分析,结果见表2。
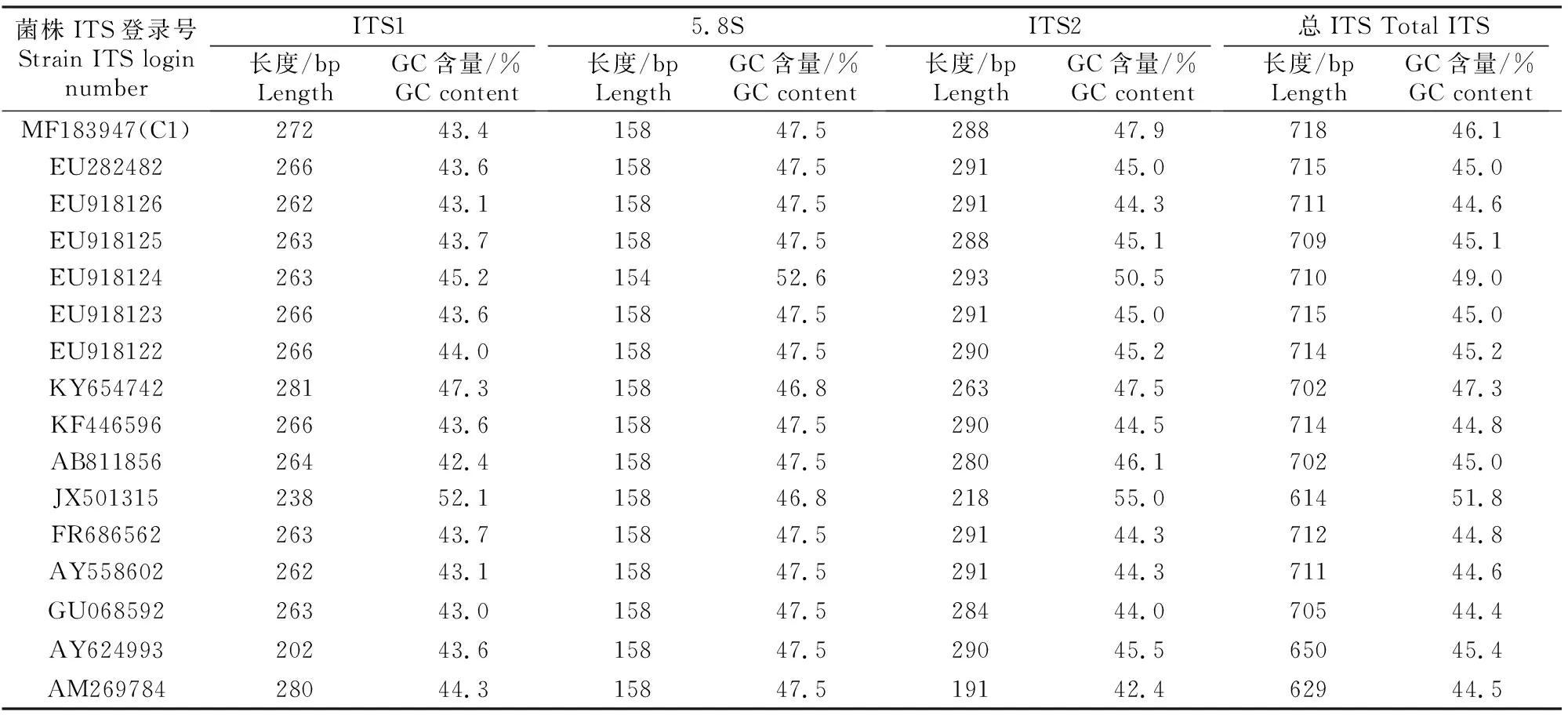
表2 粗毛纤孔菌rDNA ITS 序列长度及GC含量变异分析Table 2 rDNA ITS sequences and GC content of Inonotus hispidus
表2显示,不同地域的粗毛纤孔菌ITS总序列长度变异较大,为614~718 bp,相差104 bp;ITS1序列长度为202~281 bp,5.8S序列长度多为158 bp,ITS2序列长度为191~293 bp。对ITS1-5.8S-ITS2序列的碱基构成进行分析发现,ITS1与ITS2区域GC含量明显相异,ITS1-5.8S-ITS2的GC含量为44.4%~51.8%,ITS2比ITS1的GC含量变化稍大,分别为42.4%~55.0%和42.4%~52.1%,5.8S区的GC含量为46.8%~52.6%,这与序列长度变异结果相一致。
为进一步探究粗毛纤孔菌ITS1-5.8S-ITS2的序列变异程度,使用MEGA 6.0将表2中16株粗毛纤孔菌的ITS1-5.8S-ITS2序列对位排列,共测得788个碱基位点,其可变位点、信息位点和序列变异率见表3。从表3可知,ITS1-5.8S-ITS2总变异率为52.70%,其中ITS2较ITS1变异率高,达到了60.53%,5.8S序列比较保守,其变异率为35.80%,这与基于序列的长度变异和碱基构成分析的结果一致。综上可知,粗毛纤孔菌在自然界中具有丰富的遗传多样性。
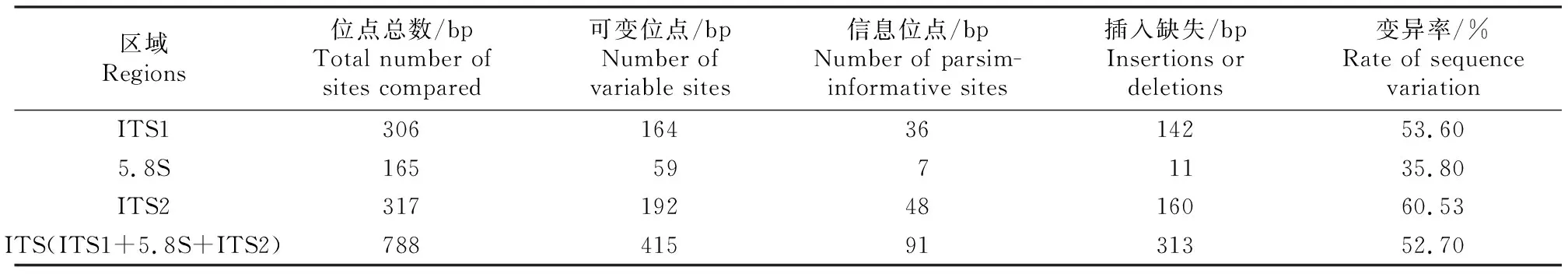
表3 粗毛纤孔菌菌株ITS序列的变异情况Table 3 ITS sequences variation of Inonotus hispidus
在上述分析的基础上,进一步探究粗毛纤孔菌遗传差异与地域的相关性,将上述16株粗毛纤孔菌序列进行聚类分析,结果见图3和表4。图3和表4数据表明,不同地域的粗毛纤孔菌之间存在一定的遗传分化,遗传距离在0~0.778;在遗传距离0.2处可将其划分为A和B两个类群,类群A在遗传距离0.1 处又可划分为2个亚群,亚群1包含菌株C1、EU282482、EU918126、EU918125、EU918124、EU918123、EU918122、KF446596、AB811856、FR686562、AY558602、GU068592、AY624993和AM269784菌株,亚群2仅有KY654742菌株,类群B仅有JX501315菌株。
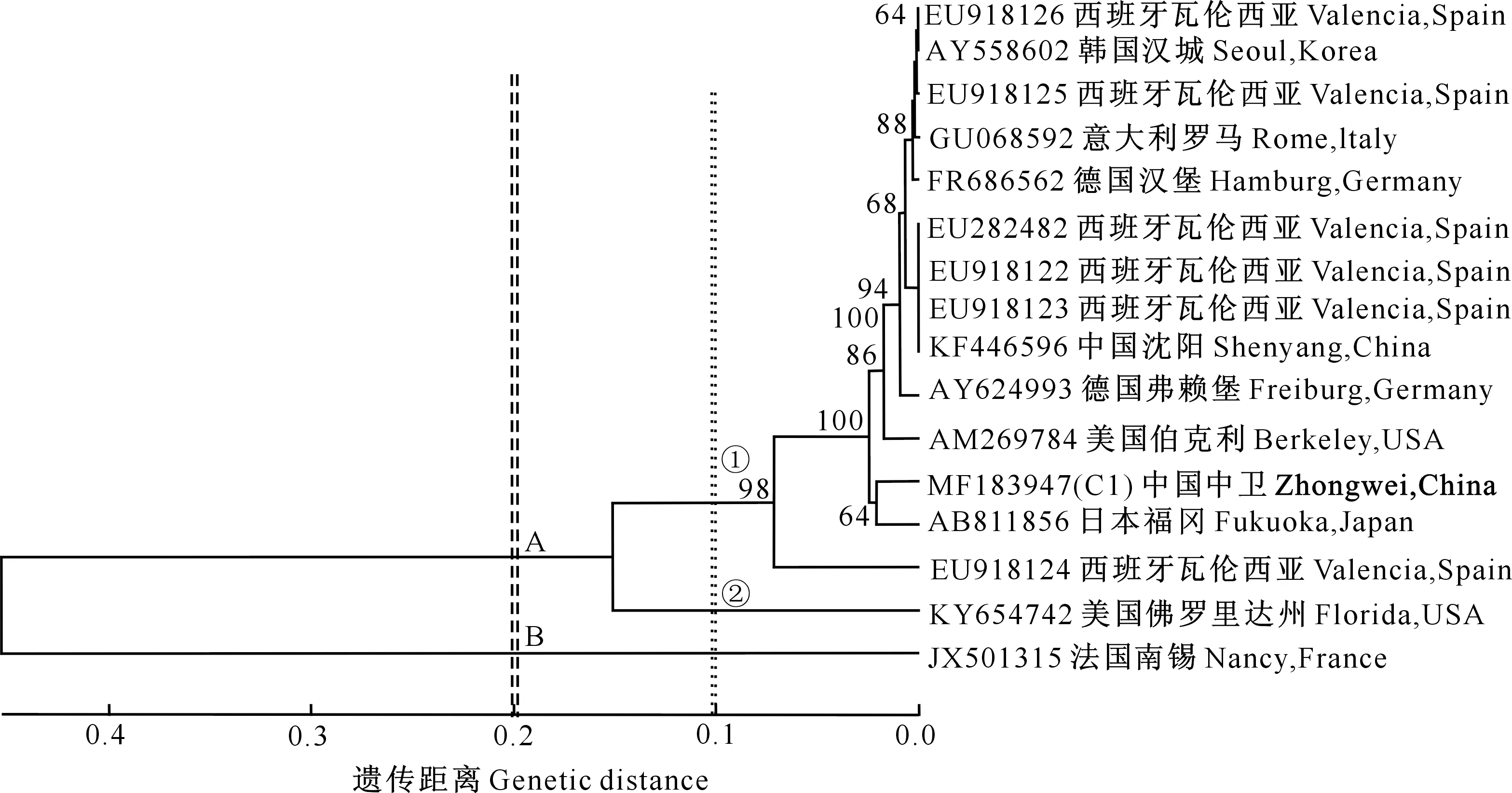
图3 基于16株粗毛纤孔菌rDNA ITS序列的聚类分析结果
Fig.3 Cluster analysis of 16InonotushispidusrDNA ITS sequences
由图3和表4可知,来自韩国的AY558602粗毛纤孔菌和来自西班牙的EU918126粗毛纤孔菌遗传距离为0.000;来自美国的2个粗毛纤孔菌菌株AM269784和KY654742分别属于类群A的2个亚群,遗传距离为0.221;来自西班牙的6株粗毛纤孔菌属于类群A的亚群1,聚类较集中,遗传距离为0.000~0.126,但来自德国和中国的2个菌株也都属于亚群1。由此可见,全球不同地区粗毛纤孔菌的遗传差异与地域性无明显的相关性,区域性特征不明显。
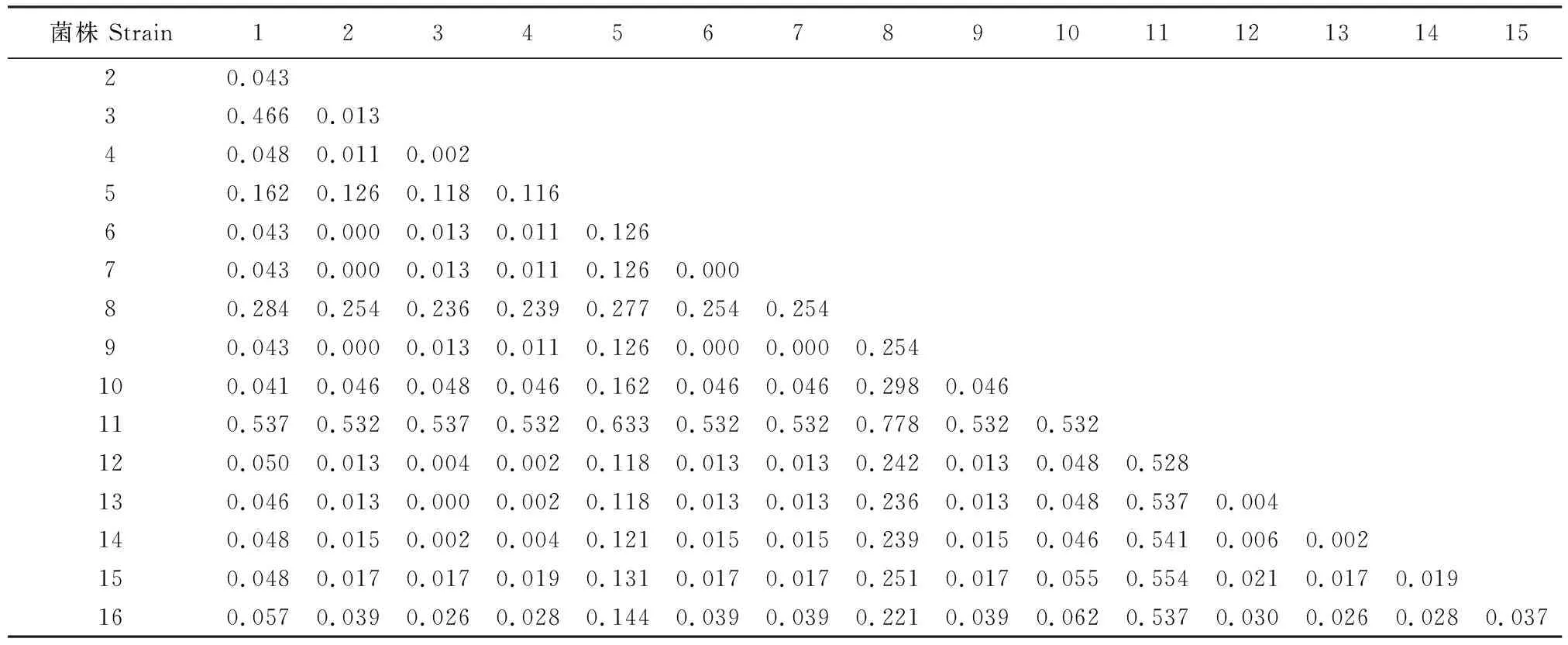
表4 16株粗毛纤孔菌菌株间的遗传距离Table 4 Genetic distances between 16 Inonotus hispidus strains
注(Note):1.MF183947(C1);2.EU282482;3.EU918126;4.EU918125;5.EU918124;6.EU918123;7.EU918122;8.KY654742;9.KF446596;10.AB811856;11.JX501315;12.FR686562;13.AY558602;14.GU068592;15.AY624993;16.AM269784。
2.3 粗毛纤孔菌深层发酵液提取物的抗氧化与抗菌活性
粗毛纤孔菌深层发酵液提取物的抗氧化活性测定结果如图4所示,在所选质量浓度范围内,粗毛纤孔菌深层发酵液提取物对羟基自由基和DPPH自由基均有一定的清除能力,且清除自由基的能力与质量浓度呈正相关。当深层发酵液提取物质量浓度为2 mg/mL时,羟基自由基清除率达65.96%,DPPH自由基清除率达到91.91%。
从表5可知,粗毛纤孔菌深层发酵液提取物对铜绿假单胞杆菌和金黄色葡萄球菌具有一定的抑制作用,且抑菌圈直径大小与质量浓度呈正相关性,但对肺炎克雷伯菌和大肠杆菌未表现出抑制作用。
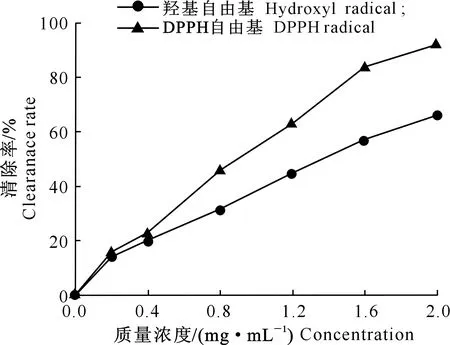

图4 粗毛纤孔菌深层发酵液提取物对2种自由基的清除活性Fig.4 Scavenging activities of extracts from Inonotus hispidus submerged fermentation broth on two free radicals
注:“-”表示无抑菌作用。
Note:“-” means no bacteriostatic action.
粗毛纤孔菌深层发酵液提取物的抗氧化与抗菌活性稳定性试验结果(图5和图6)显示,经过不同温度和一定时长紫外光照处理后,粗毛纤孔菌发酵液提取物的抗氧化和抗菌活性未呈现出较大变化,与原有的活性基本相当,表明粗毛纤孔菌发酵液提取物的抗氧化与抗菌活性具有一定的稳定性。
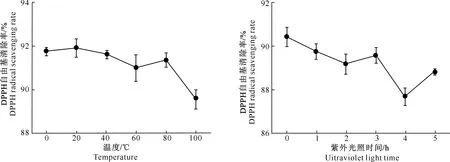
图5 温度和紫外光照时间对粗毛纤孔菌发酵液提取物抗氧化活性的影响
Fig. 5 Effect of temperature and UV irradiation time on antioxidant activity of extracts from fermentation broth ofInonotushispidus
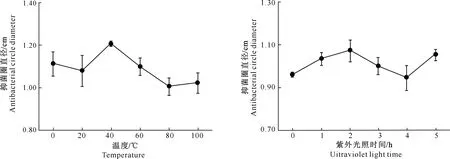
图6 温度和紫外光照时间对粗毛纤孔菌发酵液提取物抗菌活性的影响Fig.6 Effect of temperature and UV irradiation time on antibacterial activity of extracts from fermentation broth of Inonotus hispidus
3 讨 论
长期以来,主要依据子实体形态特征对真菌进行鉴定,但大型真菌子实体形态易受生长环境和生长时期等客观因素的影响,且形态性状的判断也易受主观因素的影响,具有一定的局限性。近年来,AFLP、RAPD、ITS序列分析等分子手段在真菌及植物的鉴定中得到了广泛应用,但是,AFLP对技术要求较高,且在一些物种的鉴定中灵敏性不够,RAPD的重复性和可靠性都较差,而ITS rDNA区域进化速率较快,表现出广泛的序列多态性,对大型真菌的鉴定有更高的准确度和灵敏度,适用于不同分类水平的物种鉴定及系统发育研究,因此在遗传多样性研究、遗传分化、物种鉴定等方面得到了广泛应用[34-35]。本试验结果表明,ITS序列是可用来鉴定粗毛纤孔菌及研究其遗传变异的有效方法。菌株C1与KP446596粗毛纤孔菌(Inonotushispidus)的rDNA ITS序列最为接近(相似度为98%),结合形态学鉴定结果,确定菌株C1为粗毛纤孔菌(Inonotushispidus);基于ITS序列构建的系统发育进化树表明,粗毛纤孔菌与安德松纤孔菌(Inonotusandersonii)亲缘关系较近,遗传距离为0.061。
遗传多样性是生物多样性的核心,可反映物种的遗传背景和潜在利用价值。遗传多样性降低会导致物种适应能力降低,最终导致物种退化;丰富的遗传多样性意味着较高的适应生存能力和进化潜能,所以针对遗传多样性的研究对物种保护具有重要的理论意义和实际价值[36-38],本试验基于ITS1-5.8S-ITS2序列对菌株C1与NCBI数据库收录的来自全球不同地域的15株粗毛纤孔菌进行遗传多样性分析,研究结果表明,不同地域的粗毛纤孔菌ITS1-5.8S-ITS2序列长度、碱基构成和变异程度差异较大,序列长度在614~718 bp,GC碱基含量在44.4%~51.8%,序列可变位点415 bp,信息位点91 bp,插入缺失313 bp,变异率达52.70%,可知粗毛纤孔菌在自然界中具有丰富的遗传多样性;不同地域的粗毛纤孔菌之间存在一定的遗传分化,但菌株间的遗传多样性与地域分布关系并不明显。本试验结果还表明,粗毛纤孔菌深层发酵液具有一定的抗氧化和抗菌活性,且活性比较稳定,这为充分开发利用粗毛纤孔菌提供了新的思路。
