抗炎中药与阿尔茨海默病防治*
2019-01-18杨贵珍柯尊记
杨贵珍,柯尊记
(1. 上海中医药大学基础医学院免疫学与病原生物学教研室 上海 201203;2. 上海中医药大学基础医学院神经科学研究中心 上海 201203)
阿尔茨海默病(Alzheimer's disease,AD)是一种年龄相关的神经系统退行性疾病,临床表现为进行性的学习记忆能力减退,其病理特征是大脑中β 淀粉样蛋白(Beta amyloid protein,Aβ)聚集形成的老年斑、tau蛋白过度磷酸化聚集形成的神经纤维缠结(Neurofibrous tangles,NFT)、长期慢性炎症反应与胶质细胞增生、神经元死亡等。国际阿尔茨海默病组织(The Alzheimer's Disease International,ADI)估计到2030年,全世界痴呆患者人数将达到7500 万人,2050 可能突破1.3 亿人[1]。随着人口老龄化步伐的加快,AD 已成为与心血管疾病、恶性肿瘤和中风并列的危害人类健康的“杀手”[2]。
1 神经系统炎症对AD发生和发展的影响
对复杂的AD 的病理演变,研究者们提出了众多假说来阐明。除了衰老这一自然因素之外,神经递质紊乱、氧化应激、Aβ蛋白聚集、tau蛋白过度磷酸化、线粒体结构和功能异常、慢性炎症等被认为是AD 的主要发病机制[3]。在慢性炎症方面,研究者们就提出淋巴细胞、补体、激肽样物质、氧自由基、细胞因子和趋化因子等多种参与因素(表1)。炎症反应是当机体免疫系统面对病原体、衰老死亡细胞等异常信号产生的正向免疫应答,参与炎症反应的免疫细胞、分子众多,主要病理表现为血管通透性增加,炎症细胞浸润。研究表明,AD 患者神经系统炎症反应明显,是全身免疫调节紊乱的局部具体表现;脑内参与炎症反应的细胞主要是神经胶质细胞[4]。神经系统炎症在清除脑内衰老死亡细胞、突变细胞、抵抗病原体感染等方面发挥重要作用,但这些异常信号若长期存在,脑中胶质细胞将被过度激活,由此产生的免疫细胞因子、补体、激肽样物质、氧自由基等在清除异物的同时,也会对脑神经元产生损害。这也是AD 脑内的主要病理学变化之一。本文综述就神经系统炎症的参与成分在AD 发生发展中的作用做简要阐述。
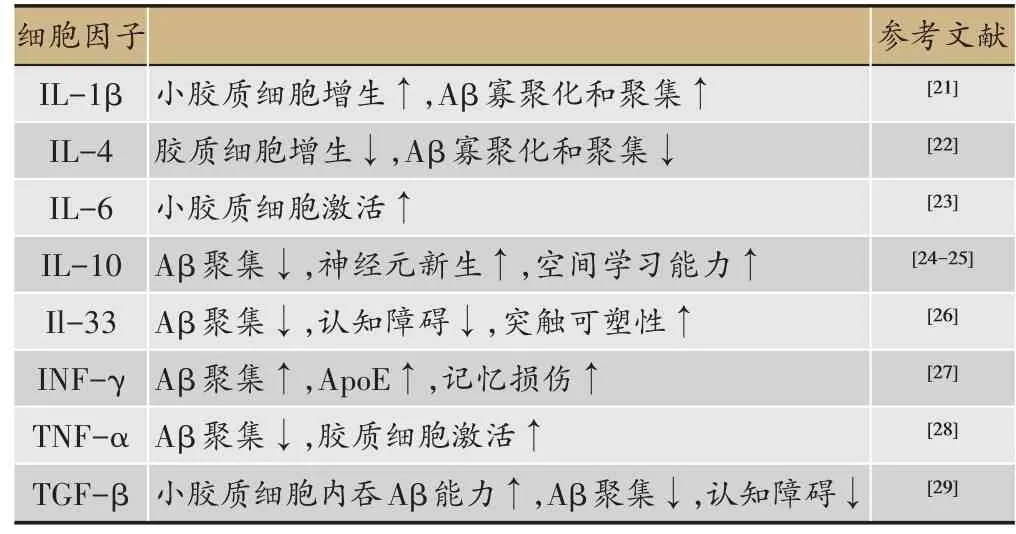
表1 与AD 发病机制相关的炎症因子
1.1 小胶质细胞
小胶质细胞是脑内的巨噬细胞,能清除脑内衰老死亡的神经元和入侵的病原体。静息状态的小胶质细胞呈分枝状,具有较强的吞噬能力和抗原提呈功能,也能分泌细胞因子、补体、神经营养因子来保护神经元。小胶质细胞低表达分化簇分子45(Cluster of differentiation 45,CD45)、主要组织相容性复合物Ⅱ(Major histocompatibility complex Ⅱ,MHCⅡ)等表面分子,吞噬能力较低[5]。活化状态的小胶质细胞成阿米巴样形状,细胞表面模式识别受体如Toll样受体、清道夫受体表达上调,合成和释放大量的炎症因子和氧自由基[6]。活化的小胶质细胞分泌的炎症因子主要包括:肿瘤坏死因子-α(Tumor necrosis factor,TNF-α)、转移生长因子-β(Transfer growth factor-β,TGF-β)、白细胞介素-1β(Interleukin-1β,IL-1β)、IL-6 及活性氧自由基(Reactive oxygen species,ROS)等。IL-1β 和IL-6 可激活神经元细胞内的淀粉样前体蛋白(Amyloid Precursorprotein,APP)的分泌酶,促进APP的剪切,加速Aβ 蛋白的产生、沉积[7];IL-1β 能进一步活化胶质细胞并促进IL-6、TNF-α 及载脂蛋白-E4(Apolipoprotein-E4,Apo-E4)的分泌[8]。研究表明IL-1β 还可诱导tau 蛋白磷酸化,促进NFTs 的形成][9];TNF-α 浓度在AD 患者的血清、脑脊液以及Aβ 激活的胶质细胞中都可升高[10]。TNF-α浓度过高对神经元具有不利的影响,TNF-α 过表达的转基因小鼠神经退行性病变更明显,其机制可能是神经元上的TNF 受体(Tumor necrosis factor receptor,TNFR)与TNF-α 结合,介导caspase 级联反应诱导神经元凋亡[11]。神经系统中存在TNFR-1 和TNFR-2 两种TNFR,以不同的信号传导通路保持脑内神经-免疫调节的平衡,AD 患者脑内出现神经网络功能异常可能是这种平衡被打破了[12]。TGF-β 在AD 的脑损伤反应中也起着与上述炎症因子类似的关键作用。AD 患者的大脑微血管高表达TGF-β通过促进血管内皮细胞释放炎症因子IL-1β和TNF-α,参与到AD炎症的进程中[13]。ROS是机体内可以形成自由基的过氧化物以及参与氧代谢的含氧自由基,通过损坏神经元膜蛋白,造成细胞内外Ca2+稳态失衡,导致神经元凋亡。ROS 亦可导致自由脂酸大量释放、前列腺素E2(Prostaglandin E2,PGE2)分泌增加以及Tau 蛋白的过度磷酸化,造成神经元的凋亡。NO 也是影响神经炎症的重要介质,它通过产生对神经元膜蛋白毒性更强的过氧亚硝酸盐起作用;一方面NO 能够抑制线粒体呼吸链功能,干扰线粒体合成ATP ,最终导致神经元细胞能量耗竭而死亡;另一方面NO还能活化前列腺素合成酶,促进PGE2分泌。
在AD 病人脑内,激活的小胶质细胞与Aβ 斑块共定位,小胶质细胞是脑内清除Aβ的主要细胞[14]。APP/PS1 转基因小鼠脑内小胶质细胞降解吞噬的Aβ 的能力下降[15]。小胶质细胞激活在AD 发生发展过程的不同时期发挥不同的作用[16]。
1.2 星形胶质细胞
星形胶质细胞的主要作用是参与能量物质和神经递质代谢,增强突触可塑性等。AD 病程初期,星形胶质细胞通过分泌血管内皮生长因子,诱导血管形成,在Aβ 清除和分解中有重要作用[17]。当Aβ 聚集增加,激活的星形胶质细胞产生的NO 量增加,血管通透性增加,破坏血脑屏障(Blood brain barrier,BBB)的完整性[18]。AD 病程晚期,星形胶质细胞激活更加明显,激活的星形胶质细胞表达钙依赖磷酸酶(Calcineurin,CN)水平增加,CN 通过活化T 细胞核因子(Nuclear factors activating T cells,NFAT),引发包括突触损失和/或可塑性改变,神经元凋亡等一系列病理学效应。在APP/PS1 小鼠,CN-NFAT 信号通路异常激活[19]。有AD 患者血浆和脑内的CD40 和CD40L 的水平升高,CD40-CD40L 相互作用可增加Aβ 生成,tau 蛋白过度磷酸化,而激活的星形胶质细胞是脑内CD40L 的主要来源[20]。
1.3 其它免疫细胞
B 细胞是体内的抗体产生细胞,B 淋巴细胞表面的CD40与T淋巴细胞表面的CD40L相互作用,对B淋巴细胞的增殖分化和激活起着关键性的作用。AD 患者血清中存在脑反应性抗体,包括天然抗体和自身抗体,这些抗体的病理生理意义还不清楚[30]。肥大细胞是组胺、花生四烯酸等增加血管通透性物质的主要来源。AD 患者脑内的肥大细胞明显被激活,脑内约50%的组胺由肥大细胞分泌[31],聚集在BBB 周围的肥大细胞还能分泌TNF-α、IL-1β、IL-8、IL33、CCL2、VEGF、ROS、PGE2等介质,参与BBB的通透性调节[32]。
1.4 补体系统
补体系统是固有免疫的重要组成部分,由补体(Complement C)C1 至C9 固有组分、调节组分及其受体组成。补体成分分泌增加及异常激活亦能加剧炎症反应,诱导细胞死亡。补体系统也参与AD 发生和发展,纤维状Aβ 可直接与C1q 的球部、C3 结合,通过经典通路和旁路通路激活补体系统,形成的复合物参与对衰老死亡的神经元清除作用[33]。同时生成的补体降解片段C3a、C5a起到激肽样物质、过敏毒素的作用,能增加BBB 和血管的通透性,趋化免疫细胞进入脑组织中,加重神经炎症反应对神经元的损伤。神经元因其低水平表达补体调节物(Complement regulator,CRegs),对补体介导的死亡特别敏感,AD 患者中神经元CRegs 表达上调[34]。C3 是体内含量最高的补体成分,其降解片段C3a 可以通过与C3aR 结合,增强吞噬细胞的吞噬能力,清除脑内沉积的的Aβ 斑块与过度磷酸化的tau 蛋白纤维缠结,促进神经元再生;同时也能激活胶质细胞产生炎症因子导致组织损伤。补体正常功能的发挥依赖于各组分之间相互作用的平衡,而这种平衡被打破在AD 发病发展中可能起重要作用[35]。小胶质细胞内NF-κB 信号通路激活后,可促进C3生成,与神经元上的C3aR 结合,导致神经元形态和功能损伤,而抑制C3a R 可改善AD 模型小鼠的学习认知障碍[36]。
2 基于炎症假说的AD治疗
目前,临床上可用的治疗AD 的药物只有基于神经递质假说的药物,包括,利凡斯的明(rivastignine)、多奈哌齐(donepezil)、加兰他敏(galantamine)和美金刚(memantine)。基于炎症反应在AD 发生发展中的作用,人们试图通过抑制炎症过程来防治AD。目前正在进行的基于炎症假说AD临床试验有近10 项。
2.1 非甾体类抗炎药
在研究抗炎药物防治AD 的过程中,非甾体类抗炎药(Nonsteroidal antiinflammatory drugs,NSAIDs)表现出延缓和治疗AD的潜力,其中有5项非甾体类抗炎药,分别是氟比洛芬、布洛芬、罗非昔布、萘普生和塞来昔布正在进行临床试验。NSAIDs 被认为可抑制环加氧酶2(Cyclo-oxygenase-2,COX-2)的活性,减少PGE2 的生成,进而减轻炎症反应。NSAIDs 虽能缓解炎症症状、延缓病情恶化,长期服用也存在着消化系统、血液系统以及泌尿系统的严重副作用,影响了其临床使用。
2.2 中药防治AD
中国传统医学对AD 没有统一的归类,古代医书中有“文痴”、“善忘”、“癫疾”等各种称谓。在《左传》中记载有“不慧,盖世所谓白痴”、《华佗神医秘传》和《景岳全书》中开始称为“痴呆”。中医各个学派对AD病因病机归纳总结为肾亏髓虚、五脏不足为本,血瘀痰阻为标[37]。五脏六腑理论认为肝[38]、胆[39]、心、脾[40]均与AD 进展密切相关。经络腧穴理论从经络角度辨证论治,也取得了一定的临床疗效[41]。辨证论治是中医治疗的精髓,中药对AD 的治疗,主要从病因病机入手,采取中药提取物、经典复方等多种方法,取长补短,融会贯通,长期进行临床实践及实验研究。中药复方因多靶点作用特点,具有整体治疗的优势。中药提取物和中药单体,因化学结构稳定、作用靶点明确、便于推广等优势,也受到研究者的青睐(表3)。
目前,运用中药对神经炎症性疾病进行治疗已逐渐成为研究的热点。近年来发现一些传统中药如人参、远志、菖蒲、含笑、淫羊藿、雷公藤、厚朴、肉桂、穿心莲、假马齿苋、茱萸、银杏等能改善AD 模型小鼠的认知障碍,这些药物潜在的有效成分是开发治疗AD新药的新方向(表2)[42]。人们通过分离技术对这些药用植物进行了提取,纯化,有效成分分析检测,发现多萜类、糖类、黄酮类、生物碱类化合物具有良好的抗神经炎症的活性。中药复方由于具有多靶点作用的特点,对于发病机制复杂的AD 治疗具有其独特优势。当归芍药散、聪明汤和定志丸等中药复方已体现出其防治AD的可能。
2.2.1 中药防治AD的机制
人们对于这些中药提取物和中药单体抗神经炎症的机制进行了广泛的研究,发现其主要通过调节以下几个方面起作用。首先,免疫调节作用。中药有效成分对于外周组织和血液中淋巴细胞活性进行广泛的调节,抑制血管活性物质和炎症细胞趋化因子的释放。白藜芦醇、没食子酸、雷公藤甲素等均能抑制肥大细胞的活化,减少组胺、白三烯等的分泌。黄芪皂苷Ⅳ体内、体外均可促进T、B 淋巴细胞的增殖,抑制小鼠腹腔巨噬细胞的活化[72]。脑内免疫调节作用对象主要是体现在抑制小胶质细胞过度激活上,假马齿苋皂苷、穿心莲内酯等中药单均能抑制小胶质细胞的活性而减少小鼠脑内Aβ 斑块的生成。部分中药还能通过调节补体系统来抑制神经炎症[73]。β-甘草次酸能调节C2、C3 的分泌,甘草酸苷能调控C3 分解成C3a,而C3a 是体内重要的过敏毒素[74]。羽扇豆三萜醇能抑制C3 转化酶活性产生抗炎效果[75]。其次,抑制炎症信号通路发挥作用。第一,通过阻断NF-κB 信号通路起效。NF-κB 信号通路是机体内最重要的参与炎症反应的通路,在衰老因素的诱导沉积在脑内的Aβ 斑块可激活NF-κB 信号通路,导致核转录因子磷酸化激活后能够进入细胞核内增强炎症因子基因的表达。中药提取物通过抑制NF-κB 的活化则能够有效抑制胶质细胞激活,从而发挥抗神经炎症作用。第二,通过阻断MAPK 信号通路起效。沉积在脑内的Aβ 斑块亦可激活丝裂原活化蛋白激酶,导致核转录因子磷酸化激活后能够进入细胞核内增强炎症因子基因及炎性蛋白iNOS 及COX-2 的表达[76]。中药提取物和中药单体通过抑制NF-κB 和MAPK 信号通路而对AD 的防治产生很好的效果。第三,通过阻断PI3K/AKT 信号通路起效。PI3K/AKT信号通路在体内作用广泛,此信号通路激活也参与了神经炎症的发生发展。最后,通过清除活性氧自由基[77]起作用。
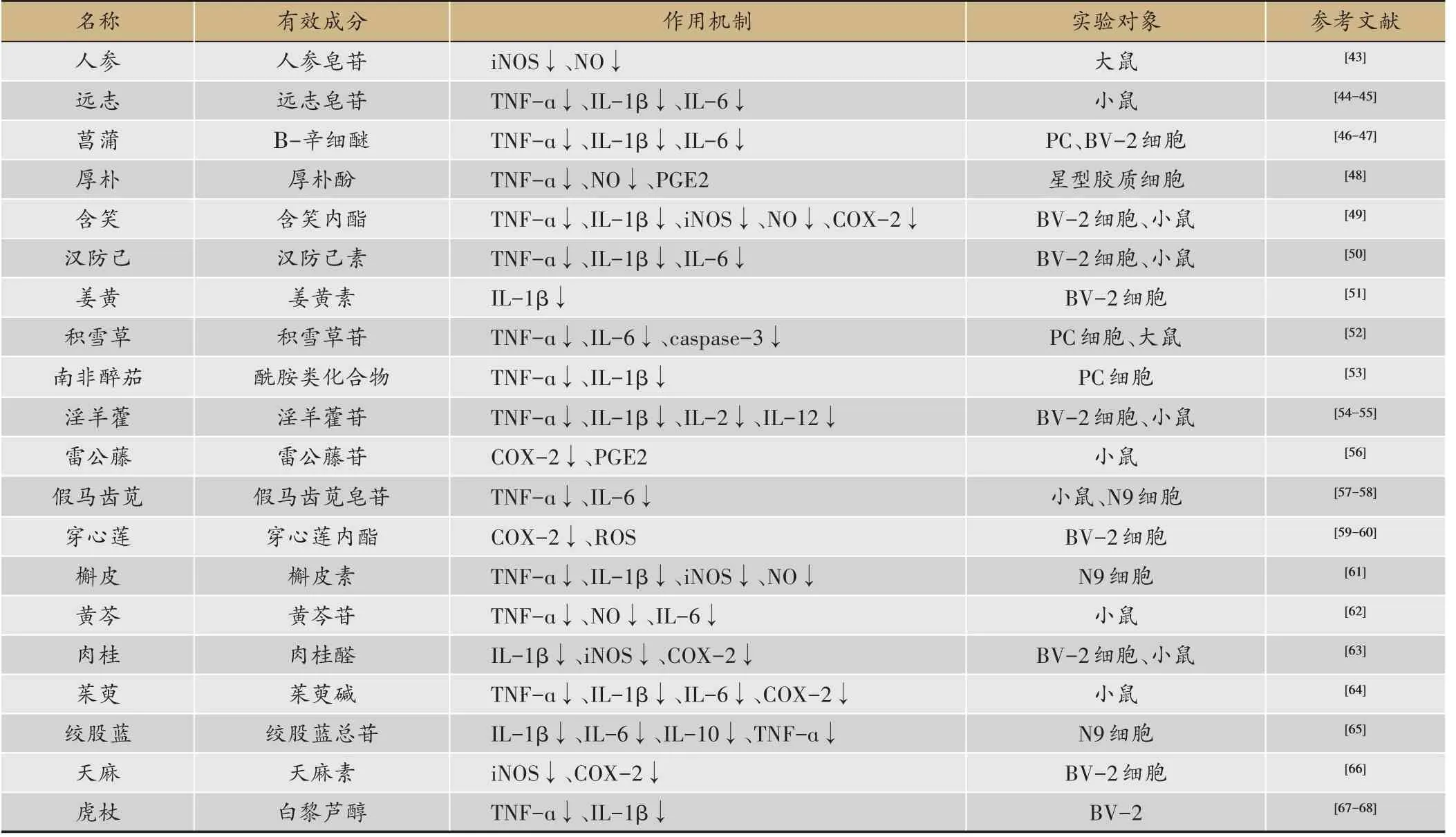
表2 靶向炎症因子治疗AD相关中药研究
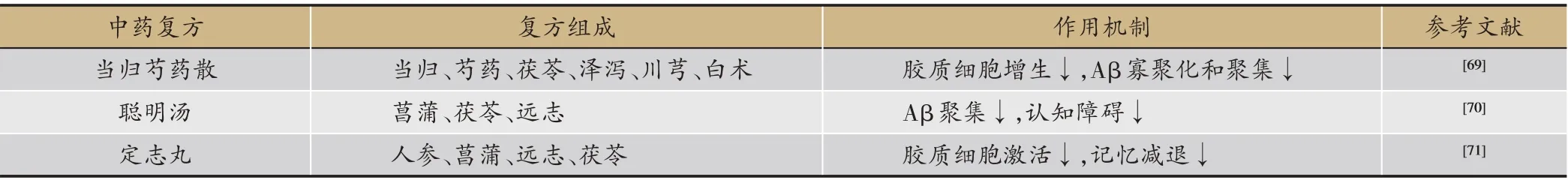
表3 用于AD防治的中药复方
3 小结
综上所述,神经炎症在AD 的发生发展过程中发挥重要作用。外周的淋巴细胞、补体系统、激活的小胶质细胞及炎症因子等在AD 炎症反应过程中扮演着重要的角色。NSAIDs可以减缓AD的发展,NSAIDs的副作用影响了其在临床上使用。虽然基于炎症假说的AD 治疗药物已有诸多失败案例,但现在仍在进行中的临床试验还存在一线希望。寻找安全有效的AD治疗方案可能需要综合Aβ假说、tau假说、神经元保护假说以及炎症假说。AD 的病因不是单一机制造成的,从多靶点作用特点的中药中有望找到防治AD 的潜在药物。
