黑菊芋多酚提取及抗氧化活性分析
2019-01-17姬妍茹许博超杨庆丽魏连会刘宇峰
姬妍茹, 许博超, 杨庆丽, 魏连会, 石 杰, 董 艳, 刘宇峰
(1.黑龙江省科学院 大庆分院, 黑龙江 大庆 163319;2.黑龙江八一农垦大学 生命科学技术学院, 黑龙江 大庆 163319)
菊芋(Jerusalem artichoke)又名洋姜、鬼子姜,块茎含有碳水化合物、氨基酸、维生素等[1],碳水化合物主要包括菊糖、淀粉、多聚戊糖等,其中菊糖含量最高,占块茎干重的50%~75%[2],具有降血脂,双向调控血糖,改善肠道,防治便秘等功能[3]。
随着菊芋产量逐年增大,如何深度加工增加其经济附加值,成为制约菊芋产业发展的关键因素。菊芋的传统加工方式主要是腌制酱菜,近年来新增了菊芋茶包[4]、菊芋饮料[5]、菊芋酒[6]和菊粉等多种加工方式,最常见的是生产菊粉、果糖和低聚果糖[7]。黑菊芋是以鲜菊芋为原料,利用独特的工艺加工而成,因其色泽黝黑,口感酸甜软弹,类似果脯,也称为“黑菊芋脯”[8]。黑菊芋的研制成功为菊芋提供了新的加工方式,填补了国际空白,对菊芋产业的发展将产生良好的推动作用,现已明确其主要营养成分和风味物质构成[9-10],但对活性成分还未开展研究。
多酚是一类广泛存在于植物体内的多元酚类化合物,被称作“第七类营养素”[11],具有很强的生物活性,例如抗氧化[12]、抗菌[13]、抗炎[14]、抗癌[15]等。鲜菊芋中的多酚含量较少,加工成黑菊芋后含量显著提高[9],实验拟利用超声辅助法提取黑菊芋中多酚类物质,采用正交试验设计进行提取工艺的优化,并以多酚提取液进行DPPH自由基、羟自由基清除能力和铁离子还原力实验,验证其抗氧化功效,以期为成果推广提供理论依据,同时为黑菊芋中多酚类物质的深度开发应用奠定理论基础。
1 材料与方法
1.1 材料与试剂
黑菊芋以江苏省沛县晨玉特种蔬菜有限公司的红果菊芋为原料,利用大庆分院机电研究所自制设备生产;福林酚、乙醇、碳酸钠、没食子酸等试剂均为国产分析纯,实验用水均为超纯水。
1.2 仪器与设备
Master-D UF型实验室超纯水机,上海和泰仪器有限公司;HPX-9082MBE型恒温培养箱,上海博迅实业有限公司医疗设备厂;R201型旋转蒸发仪,上海申胜生物技术有限公司;HH-1型数显恒温水浴锅,金坛市盛蓝仪器制造有限公司;LDZX-40SCI型立式自动电热压力蒸汽灭菌器,上海申安医疗仪器厂;DHG-9070A型鼓风干燥箱,上海飞越实验仪器有限公司;ML204型电子分析天平,梅特勒托利多(上海)有限公司;BCD-215T BDZ型冰箱,青岛海尔股份有限公司;GT10-1型高速离心机,北京时代北利离心机有限公司;KQ3200型超声波清洗仪,昆山市超声仪器有限公司;Epoch酶标仪,美国BioTek公司。
1.3 实验方法
1.3.1黑菊芋的制作
将鲜菊芋块茎洗净吹干后,装入密封耐高温塑料袋,放入加工设备中,采用变温加热方式进行加工(在5 h内由室温逐渐升至93 ℃,历经83、78、60 ℃三次降温,每个温度保持一定时间,最后再降至室温),总加工时间为15 d,颜色变为黑褐色,再经烘干降低水分至30%左右,得到成品黑菊芋,4 ℃左右保存备用。
1.3.2菊芋多酚提取
将黑菊芋切成薄片,用研钵磨成泥状。然后称取0.5 g左右(精确到0.000 1 g),以乙醇水溶液为溶剂进行超声提取。
1.3.3实验设计
以乙醇体积分数(0、35%、55%、75%、95%),提取温度(25、40、55、70、85 ℃),料液比(g/mL)(1∶5、1∶15、1∶25、1∶35、1∶45)、提取时间(15、30、45、60、75 min)为单因素进行实验,并以此为基础进行正交试验,确定黑菊芋多酚的最佳提取工艺。
1.3.4总多酚含量检测
采用福林酚法,参照国标检测方法,略有改动[16]。以没食子酸为标准品,准确称取(0.055±0.001) g,用水溶解并用容量瓶定容至50 mL,得1.0 mg/mL标准没食子酸溶液。分别移取0.5、1.0、1.5、2.0、2.5、3.0 mL,于50 mL容量瓶中制成没食子酸工作液。用移液器分别移取没食子酸工作液、水及测试液各1.0 mL于刻度试管内,加入5.0 mL的10% Folin-Ciocalteu试剂,摇匀后加入7.5%碳酸钠溶液4.0 mL,加水定容至14.0 mL,摇匀,室温下放置1.0 h后分别测定765 nm处溶液的吸光度。然后以吸光度为纵坐标,对应标准品的含量为横坐标绘制标准曲线。回归方程及标准曲线见图1,总多酚提取率(mg/g)见式(1)。
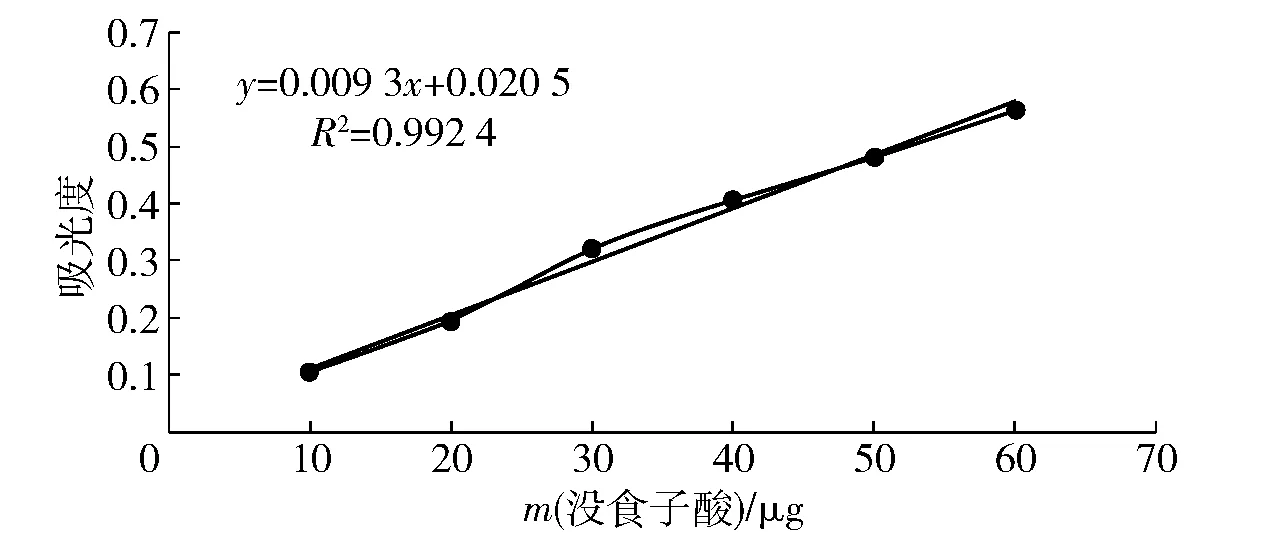
图1 没食子酸标准曲线Fig.1 Standard curve of gallic acid
(1)
实验中吸取样品液1.0 mL,3次重复,按实验步骤测定其吸光度,以标准曲线计算总多酚含量。
1.3.5DPPH自由基清除率测定
根据文献[17],称取一定量的DPPH,用无水乙醇配制成0.2 mmol/L 的DPPH 溶液。吸取1.0 mL菊芋或黑菊芋多酚提取液,用无水乙醇补至2.0 mL,加入0.2 mmol/L DPPH溶液2.0 mL充分混匀,避光放置30 min,以等体积无水乙醇做空白对照,测定517 nm处的吸光度。清除率计算见式(2):

(2)
式(2)中:A0为对照组吸光度,A1为样品组吸光度。
1.3.6羟自由基清除率测定
参照文献[18],吸取1.0 mL的菊芋和黑菊芋多酚提取液于刻度试管中,用超纯水补至2.0 mL,加入10 mmol/L FeSO4·7H2O溶液1.0 mL,再加入10 mmol/L水杨酸乙醇溶液1.0 mL,最后加入8.8 mmol/L H2O2溶液1.0 mL启动反应,37 ℃反应30 min,对照组用超纯水替代菊芋多酚提取液。测定510 nm处的吸光度。清除率计算见式(3):

(3)
式(3)中:A0为不加色素的吸光度,A1为测定液的吸光度,A2为色素本底的吸光度。
1.3.7铁离子还原力测定
吸取1.0 mL的菊芋和黑菊芋多酚提取液于具塞刻度试管中,用超纯水补至2.0 mL,加入0.2 mol/L pH值6.6的磷酸盐缓冲溶液和1%铁氰化钾溶液各2.5 mL,混匀后50 ℃恒温20 min,立即冷却,加入三氯乙酸溶液2.5 mL,混合后3 000 r/min离心10 min(如无沉淀可不离心),取上清2.5 mL,加入2.5 mL去离子水及0.5 mL 三氯化铁溶液,迅速混匀,测定700 nm处的吸光度,以超纯水作为零参比。
1.3.8数据处理
采用SPSS统计学软件处理分析,组间比较采用t检验方法,P<0.05表示差异显著,P<0.01表示差异极显著,有统计学意义。
2 结果与分析
2.1 不同提取条件对黑菊芋总多酚提取效果的影响
2.1.1提取温度与黑菊芋总多酚提取效果的关系
当其他条件一定时,随着超声温度的升高,黑菊芋中总多酚的提取率逐渐上升,当温度为70 ℃时,总多酚的提取率达到最大值6.25 mg/g,之后开始缓慢下降,见图2。因此温度因素选择 55、70、85 ℃ 3个水平进行正交试验。

图2 提取温度对黑菊芋总多酚提取效果的影响Fig.2 Effects of temperature on extraction yield of polyphenols from black Jerusalem artichoke
2.1.2乙醇体积分数与黑菊芋总多酚提取效果的关系
当其他条件一定时,随着乙醇体积分数的提高,黑菊芋中总多酚的提取率呈先上升后下降的趋势,乙醇体积分数为55% 时,提取率最高为4.98 mg/g,之后逐渐下降,见图3。因此乙醇体积分数因素选择 35%、55%、75% 3个水平进行正交试验。
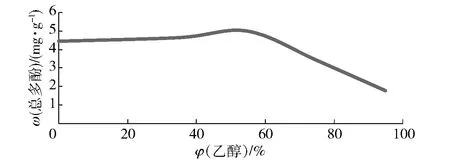
图3 乙醇体积分数对黑菊芋总多酚提取效果的影响Fig.3 Effect of ethanol concentrations on extraction yield of polyphenols from black Jerusalem artichoke
2.1.3料液比与黑菊芋总多酚提取效果的关系
当其他条件一定时,在乙醇溶液体积达到25 mL以前,多酚物质的提取率明显升高,之后随着乙醇体积的增加,提取率变化趋缓,并且有下降的趋势,见图4。因此料液比因素选择 1∶25、1∶35、1∶45这3个水平进行正交试验。
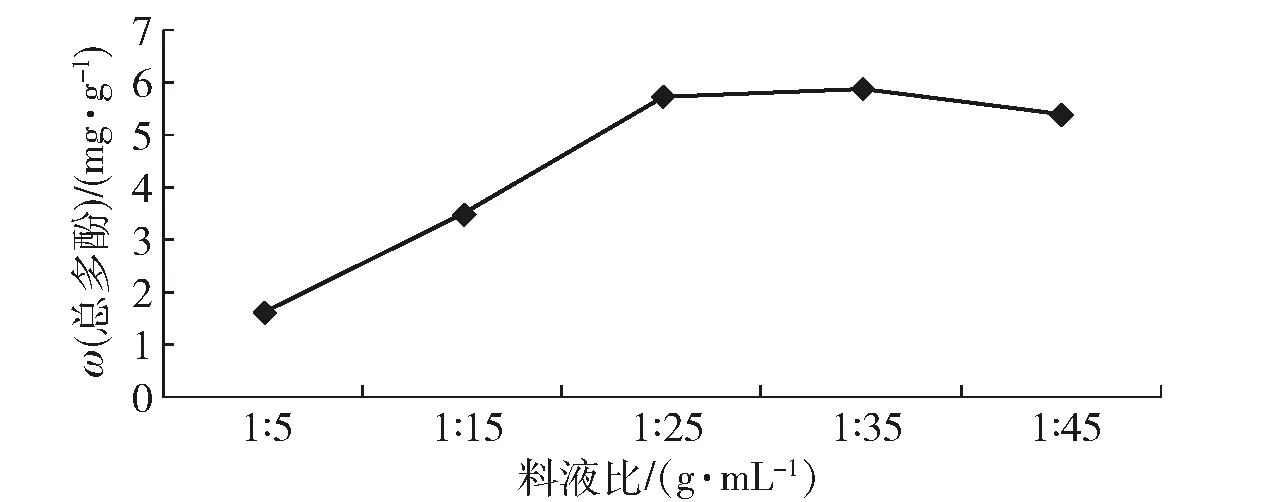
图4 料液比对黑菊芋总多酚提取效果的影响Fig.4 Effect of solid-to-liquid ratios on extraction yield of polyphenols from black Jerusalem artichoke
2.1.4提取时间与黑菊芋总多酚提取效果的关系
当其他条件一定时,随着超声时间的延长,黑菊芋中总多酚的提取率逐渐上升,当时间为60 min时,总多酚的提取率达到最大值5.35 mg/g,之后开始急剧下降,见图5。因此时间因素选择 45、60、75 min这3个水平进行正交试验。

图5 提取时间对黑菊芋总多酚提取效果的影响Fig.5 Effects of ultrasonic time on extraction yield of polyphenols from black Jerusalem artichoke
2.2 正交试验结果
在单因素实验结果的基础上,进行四因素三水平正交试验,对超声辅助黑菊芋多酚提取工艺进行正交试验优化,结果见表1。
从表1极差分析结果可以看出,4个因素对黑菊芋多酚提取率的影响由大到小依次为提取温度(C)、乙醇体积分数(A)、提取时间(B)、料液比(D)。在正交试验设计范围内,得到超声提取黑菊芋多酚的优化条件为A2B2C3D1,即乙醇体积分数为55%,料液比(g/mL)为1∶35,提取温度为85 ℃,提取时间为45 min。

表1 正交试验设计及结果分析
2.3 黑菊芋体外抗氧化活性分析
2.3.1菊芋总多酚提取及含量测定结果
采用超声辅助的方法提取鲜菊芋和黑菊芋多酚,工艺参数依据正交试验的优化水平组合,超声提取2次,合并滤液,先用旋转蒸发仪挥发出乙醇,然后用电磁炉80 ℃浓缩,最后定容至100 mL,所得溶液称为原液。鲜菊芋原液质量浓度为0.114 9 g/mL,黑菊芋为0.123 2 g/mL。鲜菊芋样品含水量为71.00%,黑菊芋含水量为36.24%。按照1.3.4节中的方法测定,以干基计算,鲜菊芋的多酚质量比为1.13 mg/g,黑菊芋的多酚质量比为6.41 mg/g,是鲜菊芋的5.67倍。由于本研究未对菊芋和黑菊芋多酚进行分离纯化,因此以下实验中采用多酚粗提液进行抗氧化分析,为方便加工前后样品之间的比较,实验以样品质量作为横坐标进行对比分析。
2.3.2DPPH自由基清除能力测定结果
DPPH是一种有机自由基,被广泛应用于定量检测食品的抗氧化能力[19]。本实验利用DPPH体系对菊芋总多酚粗提液清除自由基进行研究,结果如图6。当质量均为1.0 mg时,黑菊芋与鲜菊芋对DPPH自由基清除率差异显著(P<0.05),随着质量增加黑菊芋对DPPH自由基的清除能力明显增强(P<0.01),清除率分别为同质量鲜菊芋的1.08~1.54倍。菊芋对DPPH自由基的清除能力与其多酚含量具有一定相关性,黑菊芋和鲜菊芋的相关系数分别为0.858 2和0.953 6。
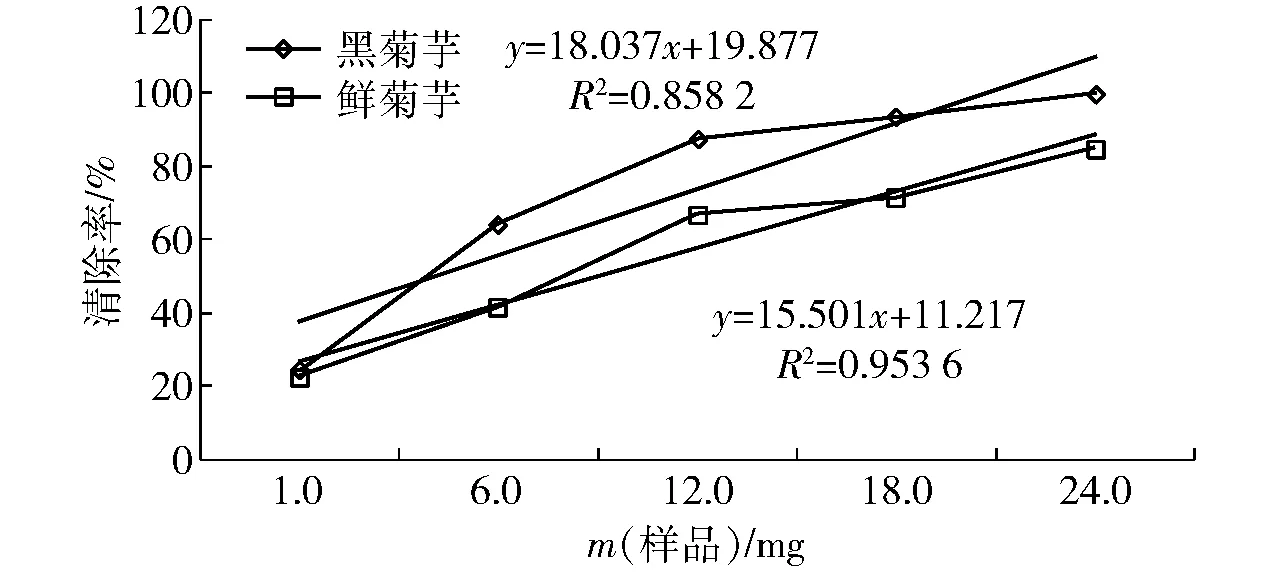
图6 菊芋和黑菊芋对DPPH自由基的清除效果Fig.6 DPPH· scavenging activity of fresh and black Jerusalem artichoke
2.3.3羟自由基清除能力测定结果
羟自由基是一种活性氧,能杀死红细胞,降解DNA、细胞膜和多糖化合物,也是引起衰老和某些疾病的重要原因之一,从食物提取物中寻找羟自由基清除剂,对于缓解上述损伤,延缓衰老具有重要意义[20]。鲜菊芋和黑菊芋总多酚粗提液对羟自由基的清除率随含量增加而增强(见图7)。当质量为10.0 mg时,黑菊芋与鲜菊芋对羟自由基的清除率差异显著(P<0.05),随着质量增加黑菊芋对羟自由基的清除能力明显增强(P<0.01),黑菊芋对羟自由基的清除率分别为同质量鲜菊芋的1.02~1.28倍。清除能力与多酚含量具有较好的相关性,黑菊芋和鲜菊芋的相关系数分别为0.929 3和0.965 8。

图7 菊芋和黑菊芋对羟自由基的清除效果Fig.7 Hydroxyl free radicals scavenging activity of fresh and black Jerusalem artichoke
2.3.4铁离子还原力测定结果
一般而言,样品的还原力与抗氧化活性有着明显的相关性,吸光度越大说明对应样品的还原力越强。黑菊芋和鲜菊芋总多酚粗提液对铁离子的还原能力随质量的增加而增强,见图8。在测试的样品质量范围内,与同质量鲜菊芋相比,黑菊芋对铁离子还原力分别为同质量鲜菊芋的2.56~3.98倍,差异极显著(P<0.01)。而且其还原力大小与多酚含量具有良好的相关性,黑菊芋和鲜菊芋的相关系数分别为0.994 6和0.985 1。
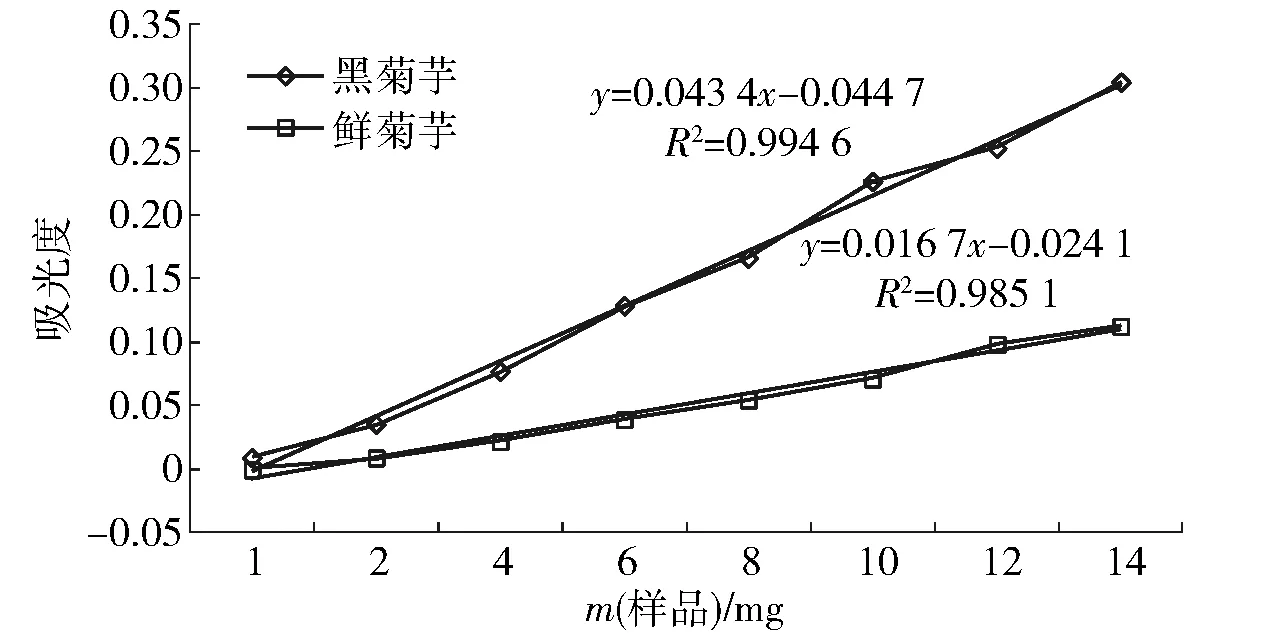
图8 菊芋和黑菊芋对铁离子的还原力Fig.8 Ferric reducing antioxidant power of fresh and black Jerusalem artichoke
3 结 论
目前,还没有关于菊芋中多酚组成的相关报道,多酚提取和含量测定也没有标准的方法。巩慧玲等[21]借鉴了牡丹花中多酚的测定方法,以邻苯二酚为标准品,测得几种菊芋的多酚质量比在0.66~1.55 mg/g。本研究参考GB/T 8313—2018《茶叶中茶多酚和儿茶素类含量的检测方法》中Folin-Ciocalteu法对菊芋提取液进行多酚含量检测,以没食子酸为标准品,测得红果菊芋的多酚质量比为1.13 mg/g。同时开展了超声辅助提取黑菊芋多酚的研究,并在单因素实验的基础上通过正交试验对黑菊芋的多酚提取工艺进行优化,确定优化提取工艺条件为乙醇体积分数55%,料液比(g/mL)1∶35,提取温度85 ℃,提取时间45 min,此时的提取率为6.26 mg/g。
经变温加热工艺处理后,黑菊芋中的多酚含量显著高于鲜菊芋,对DPPH自由基、羟自由基的清除能力和铁离子还原力均显著高于鲜菊芋,各抗氧化指标均与多酚含量具有较好的相关性,相关系数分别为0.853 2、0.929 3和0.994 6。本研究为黑菊芋新产品的推广提供了基础数据。
