SCO2基因沉默对乳腺癌MCF-7细胞增殖和凋亡的影响①
2019-01-17陈汝诗许译方谭启杏莫钦国覃庆洪
陈汝诗 许译方 谭启杏 莫钦国 覃庆洪
(广西医科大学附属肿瘤医院乳腺外科,南宁530021)
乳腺癌发病率位居女性肿瘤第一位,其死亡人数在全球范围内占恶性肿瘤死亡人数的15%[1]。目前,中国的乳腺癌发病率日渐增加,远高于世界年均0.5%的增长率,严重威胁着女性健康[2]。探索影响乳腺癌发生发展的因素并对其进行干预,是乳腺癌研究的重要领域之一。
研究表明,代谢异常是肿瘤发生过程中的一个核心问题,能量代谢的改变是肿瘤细胞的特点之一[3-5]。P53是调控肿瘤细胞能量代谢的关键因子,而细胞色素C氧化合成酶2(Synthesis of cytochrome C oxidase 2,SCO2)是第一个被确定的 p53 转录调控能量代谢的靶基因,其功能是将铜原子转运至COX,促进氧化磷酸化的作用[6]。p53在调控乳腺癌及其他肿瘤的能量代谢及凋亡过程中发挥着重要的作用,在乳腺癌细胞中,p53可以通过调节SCO2的表达诱导糖酵解和调节凋亡调节因子的合成来实现氧化磷酸化向糖酵解的转变,从而参与能量代谢[7]。但SCO2对乳腺癌发生发展的影响及其机制有待进一步阐明,本文利用慢病毒干扰 SCO2基因,观察人乳腺癌细胞MCF-7生长的变化,研究SCO2基因对乳腺癌细胞增殖、凋亡的影响,并进一步探索其潜在的机制。为进一步研究SCO2基因在乳腺癌中的作用奠定理论基础。
1 材料与方法
1.1材料
1.1.1细胞株 人正常乳腺上皮细胞株MCF-10A、人乳腺癌细胞株MCF-7及人乳腺癌细胞株MDA-MB-231均购于中科院上海细胞库。
1.1.2主要试剂 DMEM培养基、胎牛血清购于以色列Bioind公司;Trizol Reagent 购于Ambition公司;各引物设计、合成及RNA逆转录试剂盒、PCR试剂盒均购于TaKaRa公司;鼠抗人SCO2多克隆抗体β-Actin抗体均购于美国 Abcam 公司;兔抗人caspase3抗体、HRP标记的羊抗兔IgG,羊抗鼠IgG均购于美国CST公司;兔抗人Bax、Bcl-2抗体购于万类生物科技公司;重组慢病毒(LV-shRNA-SCO2)购于苏州吉玛基因股份有限公司;Annein V PE apoptosis Detection试剂盒购于BD公司。
1.2实验方法
1.2.1细胞培养 人正常乳腺上皮细胞株MCF-10A用含10% 胎牛血清和100 U/ml青链霉素的RPMI1640液体培养体系培养,人乳腺癌细胞株MCF-7及MDA-MB-231用含10% 胎牛血清和100 U/ml青链霉素的DMEM液体培养体系培养,均置于37℃、5%CO2培养箱内培养。
1.2.2慢病毒感染MCF-7细胞 将处于对数生长期的MCF-7细胞按2×103个/孔接种于 96 孔板中,用含10% 胎牛血清、不含抗生素的DMEM培养液于37℃、5%CO2条件下培养24 h,待细胞融合度达到约40%时,加入重组慢病毒LV-shRNA-SCO2或阴性对照病毒LV-shRNA-NC感染MCF-7细胞,72 h后,用嘌呤霉素筛选得到稳定表达细胞株,转染成功的实验组MCF-7细胞命名为MCF-7/shRNA-SCO2,阴性对照组为MCF-7/shRNA-NC。以下各种细胞实验均重复3次。
1.2.3qRT-PCR检测mRNA的表达 用Trizol提取细胞中总的RNA,并检测其纯度,根据说明书步骤进行逆转录反应,以逆转录所得cDNA为模板,进行qRT-PCR实验。反应条件:95℃预变性30 s,95℃ 5 s,60℃ 30 s,72℃ 30 s,共40个循环。以GAPDH为内参。结果用 2-ΔΔCT法计算 mRNA 相对表达量。GAPDH的上游引物5′-AGAAGGCTGGGGCTCATTTG-3′,下游引物:5′-AGGGGCCATCCACAGTCTTC-3′。SCO2的上游引物:5′-AGCAGCAAAAGCGAACAGAAG-3′,下游引物:5′-GGCAGTGAGTGAAGCCAAAG-3′。
1.2.4Western blot检测蛋白的表达 收集各组细胞裂解蛋白后上样,以60 V恒压电泳30 min后再以100 V恒压电泳。冰浴条件下,100 mA恒流转膜 90 min,PVDF 膜于5%脱脂奶粉中封闭2 h,摇床上4℃孵育一抗(SCO20.5 μg/ml、β-actin 1∶1 000、Cleaved-caspase3 1∶1 000、Bax 1∶1 000 、Bcl-2 1∶500)过夜。TBST漂洗3次,每次10 min;加入HRP标记的二抗(羊抗鼠1∶1 000、羊抗兔1∶1 000)室温孵育1 h,TBST漂洗3次,每次10 min。ECL 化学发光显影。以β-actin为内参,计算目的蛋白的相对表达量。
1.2.5生长曲线的绘制 将处于对数生长期的各组细胞经0.25%的胰蛋白酶消化制备成单个细胞悬液,细胞计数后,按照约2 000个细胞每孔接种于96孔板,置于37℃、5%CO2培养箱内培养0、1、2、3、4、5 d后取出,加入10 μl/孔CCK8试剂后继续孵育2 h,于酶标仪 450 nm波长下检测每孔吸光度值。1.2.6平板克隆形成实验 分别取各组细胞以200个/孔密度接种于6孔板中,置于37℃,5%CO2培养箱内培养12 d,用PBS小心洗涤细胞3次,甲醇固定20 min,Giemsa染液染色20 min,流水缓慢洗去染色液。镜下计数大于50个细胞的克隆数,计算克隆形成率。克隆形成率(%)=(细胞克隆数/接种细胞数)×100%。
1.2.7流式细胞术检测细胞凋亡 感染96 h后,胰酶消化各组细胞,2 000 r/min离心5 min,收集细胞;用1XPBS重悬洗涤细胞一次,2 000 r/min 离心5 min;加入300 μl的1×Binding Buffer重悬细胞;加入5 μl 7-AAD和5 μl PE Annexin V,室温避光孵育30 min;上机前,补加400 μl的1×Binding Buffer;流式细胞仪检测细胞凋亡情况。

2 结果
2.1SCO2mRNA及蛋白在MCF-10A、MCF-7、MDA-MB-231细胞的表达 qRT-PCR和Western blot分析结果显示,人乳腺癌细胞株MCF-7及人乳腺癌细胞株MDA-MB-231中SCO2mRNA及SCO2蛋白的相对表达水平均低于人正常乳腺上皮细胞株MCF-10A,差异具有统计学意义(P<0.05),表明 SCO2mRNA和SCO2蛋白在人乳腺癌细胞的表达水平明显低于人正常乳腺上皮细胞,同时,SCO2mRNA和SCO2蛋白在MDA-MB-231人乳腺癌细胞株的相对表达水平明显低于MCF-7人乳腺癌细胞株,差异具有统计学意义(P<0.05),结果见表1,图1、2。
2.2重组慢病毒转染乳腺癌 MCF-7 细胞 慢病毒转染乳腺癌MCF-7细胞96 h后荧光显微镜下观察EGFP的表达,阴性对照组MCF-7/shRNA-NC和SCO2基因转染组MCF-7/shRNA-SCO2细胞均可见到绿色荧光,且带有绿色荧光细胞数占总细胞数的90%左右,表明转染成功。见图3。
表1MCF-10A、MCF-7、MDA-MB-231细胞中SCO2mRNA和SCO2蛋白的相对表达水平
Tab.1RelativeexpressionlevelsofSCO2mRNAandSCO2proteininMCF-10A,MCF-7andMDA-MB-231cells

GroupsmRNA ProteinMCF-10A1.000±0.0001.702±0.041MCF-70.583±0.0271)1.524±0.0201)MDA-MB-2310.143±0.0332)1.435±0.1902)
Note:1)P<0.05 vs MCF-10A group and MDA-MB-231 group;2)P<0.05 vs MCF-10A group and MCF-7 group.

图1 MCF-10A、MCF-7、MDA-MB-231细胞中SCO2 mRNA的表达水平Fig.1 SCO2 mRNA expression levels in MCF-10A,MCF-7 and MDA-MB-231 cellsNote: Compared with control group,*.P<0.05,**.P<0.01.
2.3沉默SCO2基因后各组细胞中SCO2mRNA及蛋白的表达 qRT-PCR和Western blot分析结果显示, 实验组MCF-7/shRNA-SCO2的SCO2mRNA和SCO2蛋白的相对表达量低于空白对照组MCF-7和阴性对照组MCF-7/shRNA-NC,差异具有统计学意义(P<0.05),结果见表2,图4、5。
2.4SCO2基因表达对MCF-7细胞增殖能力的影响 CCK8法检测各组细胞增殖水平,结果显示,实验组MCF-7/shRNA-SCO2细胞在第1、2、3、4、5天各时间点吸光度值均高于相应时间点的阴性对照组MCF-7/shRNA-NC细胞和空白对照组MCF-7细胞,差异具有统计学意义(P<0.05),见图6。说明沉默SCO2基因可以增强MCF-7细胞的增殖能力。
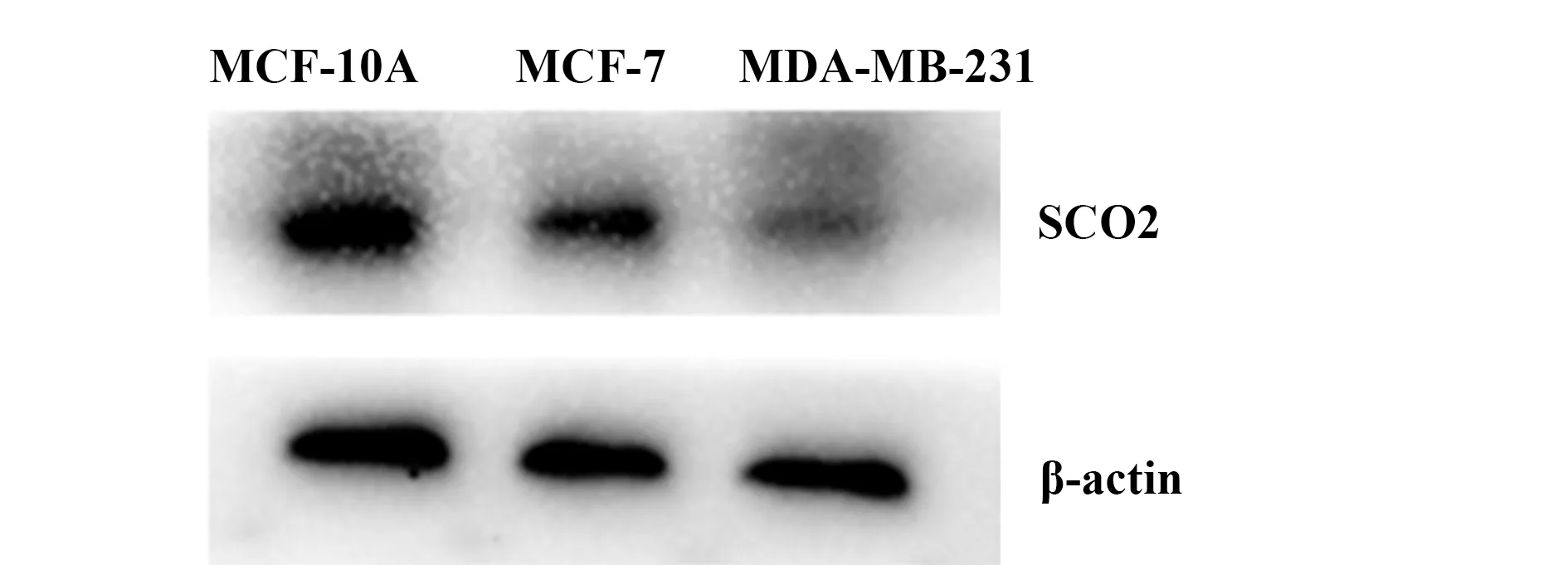
图2 MCF-10A、MCF-7、MDA-MB-231细胞中SCO2蛋白的表达水平Fig.2 SCO2 protein expression levels in MCF-10A,MCF-7 and MDA-MB-231 cells
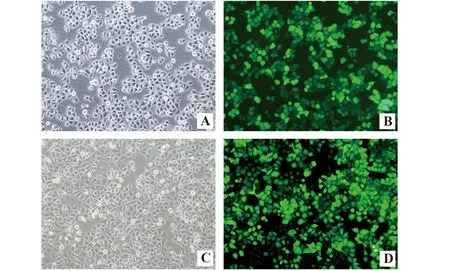
图3 荧光显微镜下观察转染SCO2慢病毒后的乳腺癌MCF-7细胞(×100)Fig.3 Fluorescence imagines of MCF-7 cells when infection with lentivirus(×100)Note: A.Negative group under bright view;B.Negative group under fluorescence view;C.shRNA-SCO2 group under bright view;D.shRNA-SCO2 group under fluorescence view.
2.5SCO2基因表达对MCF-7细胞克隆形成能力的影响 平板克隆形成实验结果显示,实验组MCF-7/shRNA-SCO2细胞的克隆形成率高于阴性对照组MCF-7/shRNA-NC细胞和空白对照组MCF-7细胞,差异具有统计学意义(P<0.05),见图7。说明沉默SCO2基因促进MCF-7细胞克隆形成。
2.6SCO2基因表达对MCF-7细胞凋亡的影响 流式细胞术检测凋亡结果显示,实验组MCF-7/shRNA-SCO2细胞的凋亡率低于阴性对照组MCF-7/shRNA-NC细胞和空白对照组MCF-7细胞, 差异具有统计学意义(P<0.05),见图8。说明沉默SCO2基因抑制MCF-7细胞的凋亡。
表2沉默SCO2基因前后MCF-7细胞中SCO2mRNA和SCO2蛋白的表达水平
Tab.2RelativeexpressionlevelsofSCO2mRNAandSCO2proteinincellsinfectionwithlentivirus

GroupsmRNAProteinControl1.000±0.0000.634±0.044Negative1.035±0.1990.662±0.031shRNA-SCO20.232±0.2331)2)0.374±0.2251)2)
Note:1)P<0.05,2)P<0.05 vs negative group.

图4 沉默SCO2基因前后MCF-7细胞中SCO2 mRNA的表达水平Fig.4 SCO2 mRNA expression levels in cells infection with lentivirusNote: Compared with control and negative group,**.P<0.01.
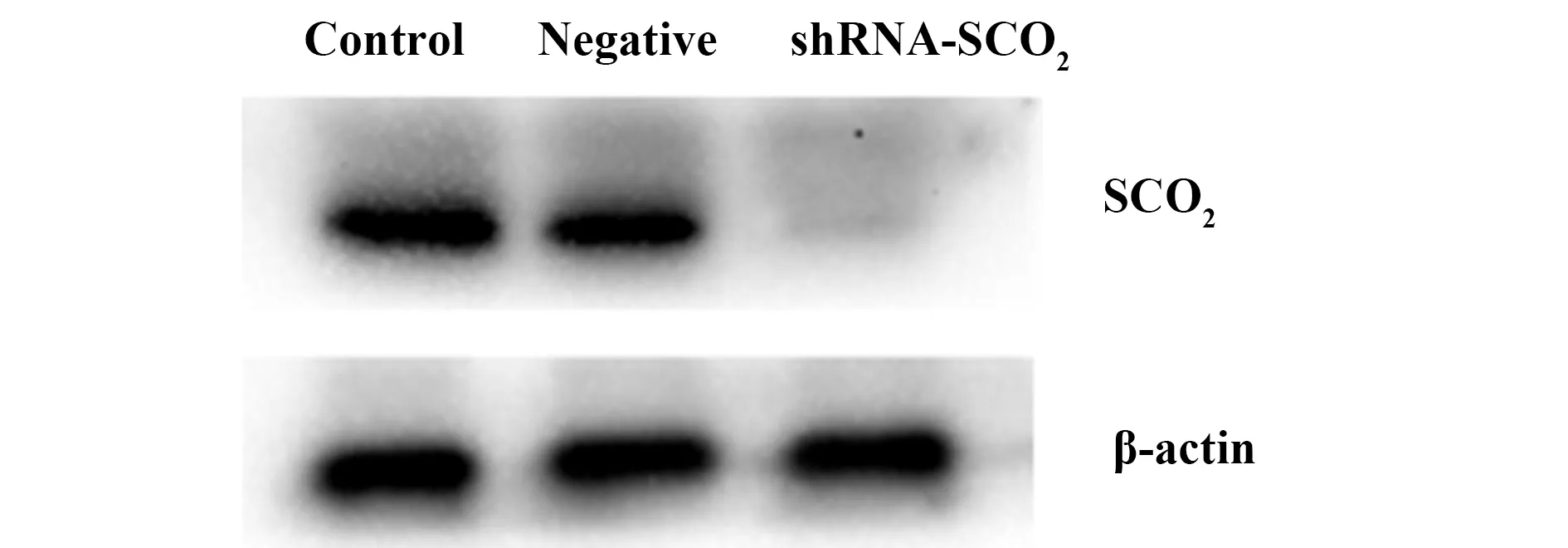
图5 沉默SCO2基因前后MCF-7细胞中SCO2蛋白的表达水平Fig.5 SCO2 protein expression levels in cells infection with lentivirus

图6 沉默SCO2基因对MCF-7细胞增殖能力的影响Fig.6 Effect of silencing SCO2 gene on proliferation of MCF-7 cells

图7 沉默SCO2基因对MCF-7细胞克隆形成能力的影响Fig.7 Effect of silencing SCO2 gene on clone formation of MCF-7 cellsNote: Compared with control group and negative group,*.P<0.05.

图8 沉默SCO2基因对MCF-7细胞凋亡的影响Fig.8 Effect of silencing SCO2 gene on apoptosis of MCF-7 cellsNote: A.Control;B.Negative;C.shRNA-SCO2;D.The apoptosis rate in each group.Compared with control group and negative group,*.P<0.05.

图9 抑制SCO2的表达对细胞中Bax、Bcl-2、Pro-caspase3、Cleaved-caspase3蛋白表达的影响Fig.9 Effects of silencing SCO2 gene on expression of protein levels of Bax,Bcl-2,Pro-caspase3 and Cleaved-caspase3 in cellsNote: Compared with control group and negative group,*.P<0.05.
2.7SCO2基因对MCF-7细胞凋亡相关蛋白的影响 Western blot结果显示,实验组MCF-7/shRNA-SCO2细胞中Bax、Cleaved caspase3蛋白的相对表达量低于空白对照组MCF-7细胞和阴性对照组MCF-7/shRNA-NC细胞中的相对表达量,而实验组MCF-7/shRNA-SCO2细胞中Bcl-2蛋白的相对表达量高于空白对照组MCF-7细胞和阴性对照组MCF-7/shRNA-NC细胞中的相对表达量,差异具有统计学意义(P<0.05),见图9。
3 讨论
p53基因在调节肿瘤能量代谢过程中发挥着至关重要的作用[8],目前认为,p53主要通过调控下游基因TIGAR(TP53 induced glycolysis and apoptosis regulator)和SCO2的表达来调节细胞有氧呼吸及糖酵解之间的平衡[9]。而SCO2是第一个被确认的p53基因转录调控能量代谢的靶基因[10]。p53基因可能通过SCO2影响肿瘤的发生发展。Won等[11]发现SCO2基因低表达的乳腺癌患者预后比较差。我们的研究也发现,不同细胞系中SCO2mRNA和蛋白表达水平差异具有显著统计学意义,其在乳腺癌细胞系MCF-7细胞中表达水平显著低于正常乳腺上皮细胞,而在侵袭能力较强的MDA-MB-231中的表达又显著低于MCF-7细胞。由此可见,SCO2水平可能与乳腺癌的侵袭能力相关,SCO2低表达可能是造成乳腺癌预后不良的原因之一,探索SCO2参与乳腺癌发生发展的机制,可能对乳腺癌防治起到重要作用,SCO2基因可能具有作为乳腺癌基因靶向治疗靶点的潜力。
本研究结果发现,随着SCO2表达水平的下降,乳腺癌MCF-7细胞增殖能力增强,凋亡率下降,差异有统计学意义(P<0.05),说明SCO2基因的表达与乳腺癌的增殖及凋亡有关。降低其表达水平后可促进乳腺癌细胞增殖,并抑制乳腺癌细胞凋亡,提示我们SCO2基因可能通过参与凋亡过程在乳腺癌发展中起作用。细胞凋亡是细胞的一种程序化死亡过程,其中涉及多种凋亡调控因子,例如Bcl-2蛋白质家族,包括抑制凋亡的蛋白Bcl-2和促凋亡蛋白 Bax等关键蛋白[12,13],研究认为细胞内Bcl-2和Bax蛋白间的比率关系是决定细胞存亡的关键,比例的降低提示凋亡被抑制[14]。大量研究显示[15],caspase 家族在细胞凋亡转导通路尤其是线粒体途径中发挥了极为重要的调控作用。其中,caspase-3在细胞凋亡过程中占据核心地位,caspase-3被激活后最终诱导细胞发生凋亡[16],本研究发现,沉默SCO2基因后下调乳腺癌MCF-7细胞中Bax和Cleaved-caspase3的蛋白表达量,同时上调Bcl-2的蛋白表达量,提示SCO2基因可能通过调节Bcl-2和Bax的蛋白表达进一步调控caspase3活化水平,从而诱导乳腺癌发生凋亡,干扰乳腺癌发展。
综上所述,SCO2基因沉默可促进乳腺癌细胞的增殖,抑制肿瘤细胞的凋亡,SCO2的表达对乳腺癌细胞的代谢调节及凋亡至关重要。但是乳腺癌的发展与体内环境密切相关,体外研究结果具有局限性,通过体内研究进一步探索SCO2在乳腺癌发展中的作用,将进一步促进乳腺癌发生发展机制的探索。
