原位交联壳聚糖季铵盐香精微胶囊的制备
2019-01-15李珊珊张宝莲李建红贺巧霞
李珊珊,张宝莲,李建红,贺巧霞
(天津城建大学 材料科学与工程学院,天津 300384)
香精的微胶囊化是微胶囊化技术的一种,同时也是在微胶囊化技术中比较典型的应用之一.长效香精微胶囊的主要特性就是能够较长时间内散发出怡人的香气.由于香精的物理化学性质特殊,它极易挥发,易变质,但经过了微胶囊化可以提高其稳定性,防止了各种成分之间的互相反应干扰.通过选择不同的芯材与囊材,以及在制备方法上进行选择可以得到不同用途与性能的香精微胶囊.如今,香精微胶囊已被普遍应用在食品、医药、纺织品工业、空气清新剂、日化产品等多种领域上,并迅速发展成为一种新颖的香料制品[1-2].Roxana等[3]以玫瑰精油作为芯材,以乙基纤维素为囊材,采用聚合法的制备方法得到香精微胶囊,并将其微胶囊在棉布纤维上进行整理,得到了加香的织物.孙爱华[4]以果香型香精为芯材,以壳聚糖作为囊材,采用喷雾干燥法得到了香精微胶囊,并讨论了囊材的浓度、乳化剂的用量、芯壁材比等多种影响因素对微胶囊形成的影响.陈科兵等[5]采用复凝聚相的制备方法,以薄荷香精为芯材,以壳聚糖、海藻酸钠为囊材得到微胶囊,并主要讨论了香精微胶囊制备的最佳工艺条件.陈敏杰[6]分别探讨了以壳聚糖季铵盐和海藻酸钠为壁材,植物油为芯材,采用不同的方法制备微胶囊.Xiao等[7-8]采用锐孔法的方法,以海藻酸钠为囊材凝胶制备出甜橙油微胶囊,并得出了最佳的工艺实验条件.
在制备香精微胶囊的方法上,采用喷雾干燥法制得香精微胶囊的流动性比较差,且包埋率比较低;复凝聚法存在需要精确控制等电点的PH值等反应条件,及后期难以过滤干燥等技术问题.另外,在一些实验中采用原位交联聚合制备的香精微胶囊,在制备过程中使用戊二醛作为交联剂,小分子醛类具有一定的毒性,会对后续应用性能造成一定影响.为此,本文以天然、无毒且兼具抗菌性的壳聚糖季铵盐作为壁材,以醛香7328为芯材,以醛化聚乙二醇作为分散剂和原位交联剂,采用原位交联聚合的制备方法来制备香精微胶囊.将所制备的壳聚糖季铵盐香精微胶囊进行显微镜观察、FTIR分析,研究了不同种类的分散剂兼原位交联剂、聚乙二醇分子量、用量等工艺条件对壳聚糖季铵盐香精微胶囊形成的影响.
1 实验部分
1.1 实验主要原料和仪器设备
环氧氯丙烷,分析纯,天津市康科科技有限公司生产;聚乙二醇(200/400/800),分析纯,天津博迪化工股份有限公司生产;二甲基亚砜,分析纯,天津市化学试剂一厂生产;三氯甲烷,分析纯,天津市江天化工技术有限公司生产;乙酸酐、乙醇,均为分析纯,天津市基准化学试剂有限公司生产;壳聚糖季铵盐,工业品,郑州奇华顿化工产品有限公司生产;醛香7328,工业品,天津市双马香精香料新技术有限公司生产.
超声波清洗机,BL6-180A型,上海比郎仪器有限公司生产;生物显微镜,B203型,重庆奥特光仪器有限公司生产;傅里叶变换红外光谱仪,Thermo Nicolet 380型,Thermo Fisher Scientific生产;激光粒度分布仪,LS-POP(Ⅲ),(珠海)欧美克仪器有限公司生产;数显机械搅拌机,DW-3型,河南巩义市予华仪器有限责任公司生产;同步热分析仪,TGA-Q600型,美国TA公司生产.
1.2 实验方法
壳聚糖季铵盐香精微胶囊的制备大致分为两个步骤:首先是两种不同分散剂兼原位交联剂聚乙二醇的制备,其次是壳聚糖季铵盐香精微胶囊的制备.
1.2.1 分散剂兼原位交联剂PEG的制备
(1)醛化PEG的制备
准确称取20.0 g聚乙二醇(PEG)于烧瓶中,然后分别加入一定量经过无水处理的二甲基亚砜,10.0 mL氯仿,超声30 min溶解后,加入25.0 mL乙酸酐,并在磁力搅拌条件下室温搅拌反应12 h,结束反应,接着减压抽真空蒸出溶剂无水二甲基亚砜和未参加反应的氯仿和乙酸酐,最后得到淡白色透明液体,即醛化PEG.
(2)双环氧化PEG的制备
准确称取20.0 g聚乙二醇(PEG-400)于烧瓶中,然后再分别称取环氧氯丙烷37.0 g,氢氧化钾22.0 g,加入烧瓶中,磁力强烈搅拌使其溶解,控制反应温度在40℃左右,反应20 h,反应结束,减压抽滤并减压蒸出没有参加反应的环氧氯丙烷,得淡黄色透明液体,即聚乙二醇双环氧丙烷醚.
(3)采用盐酸羟胺法测定PEG醛化度
准确称取0.500 0 g醛化的PEG试样于锥形瓶中,加入30.00 mL 0.1%盐酸羟胺溶液,立即盖上瓶盖,在冰水中放置3 min后,加入一定量的甲基橙指示剂,用0.02 mol/L的NaOH溶液滴定,当溶液由红色变为黄色即为终点.用同样的操作做空白试验.
1.2.2 壳聚糖季铵盐香精微胶囊的制备
量取壳聚糖季铵盐6.7 g加入烧瓶中加水溶解,加入一定量的上述自制醛化PEG或双环氧化PEG,加入香精20.0 g和一定量去离子水至100.0 g,在机械搅拌下进行乳化30 min,室温下反应4 h,升温45℃反应1 h,使用稀NaOH溶液调节反应体系pH值至弱碱性,继续在45℃下反应1 h,反应结束,得到壳聚糖季铵盐香精微胶囊乳液.
1.2.3 测试与表征
(1)FTIR 分析
称量极少量经过干燥处理的壳聚糖香精微胶囊,采用溴化钾压片法,用红外光谱分析仪进行分析,红外波数的扫描范围在400~4 000 cm-1.
(2)OM 观察
将少量微胶囊乳液稀释,均匀地涂抹在载玻片表面,待干燥后使用生物显微镜观察.
(3)粒径测试
用激光粒度仪LS-POP(Ⅲ)对香精微胶囊进行粒径分析.将微胶囊分散在水中,在合适的遮光率下进行测试.
(4)TG-DTG 分析
用同步热分析仪,对香精微胶囊的热稳定性进行分析.在N2氛围下,升温速率为10℃/min,测量20~600℃范围的TG-DTG曲线.
2 结果与讨论
2.1 不同种类分散剂兼原位交联剂对壳聚糖季铵盐香精微胶囊形成的影响
文中自制的两种分散剂兼原位交联剂分别为醛化PEG和双环氧化PEG,它们在一定的条件下具有很相似的化学性质.利用这两种分散剂兼原位交联剂制备得到的微胶囊,在显微镜下的成囊情况见图1.

图1 不同分散剂兼原位交联剂制备的微胶囊显微镜图
从图1中对比可知使用两种新型的分散剂兼原位交联剂所制备的微胶囊存在明显的差异,图1a中的微胶囊粒径较小,分布较集中,可以看到有大量饱满的微胶囊存在;而图1b中有较多大粒径的微胶囊出现,粒径分布不均匀,只有少量饱满的微胶囊存在.这是由于壁材壳聚糖季铵盐中存在—NH2比较容易与醛化聚乙二醇中含有的—CHO发生缩合从而进行交联;而双环氧聚乙二醇中的环氧在与壳聚糖季铵盐发生缩合反应的时候需要提前进行开环反应,反应比较缓慢,不容易发生.相比之下,醛化聚乙二醇更快更容易与壳聚糖季铵盐进行交联将香精包裹.因此选用醛化PEG较为合适.
2.2 不同分子量的醛化聚乙二醇对香精微胶囊制备的影响
不同分子量的醛化PEG都能制备出微胶囊,但是其形态有所差别.采用3种不同分子量的醛化PEG制备出的微胶囊显微镜图如图2所示.

图2 不同分子量的醛化PEG微胶囊的显微镜图
从图2中可以看出3种不同分子量的醛化PEG都能制备出微胶囊,但是它们之间存在着明显的差异,随着分子量的增加,微胶囊的粒径也在不断增大:其中分子量为200的醛化PEG香精微胶囊几乎看不到完整的微胶囊;分子量为400的醛化PFG香精微胶囊粒径大小均一,能看到大量饱满的香精微胶囊粒;分子量较大的醛化PEG-800香精微胶囊粒径分布不均匀,能看到有饱满的香精微胶囊粒.因此选择分子量为400的醛化PEG较为合适.
2.3 醛化PFG-400用量对香精微胶囊制备的影响
在本文的研究中,没有使用交联剂戊二醛,而是选择自制的醛化PEG代替,它的用量对微胶囊的形成和稳定性的影响至关重要.其对微胶囊形态的影响如图3所示,其对微胶囊粒径大小的影响如图4和表1所示.

图3 不同用量的醛化PEG-400微胶囊显微镜图
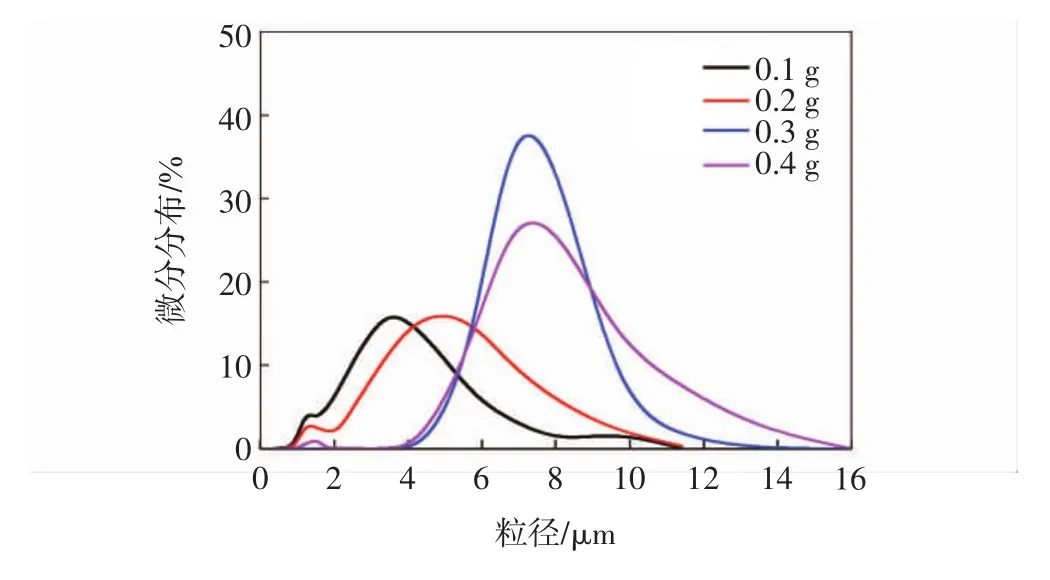
图4 不同用量的醛化PEG-400微胶囊粒径分布图
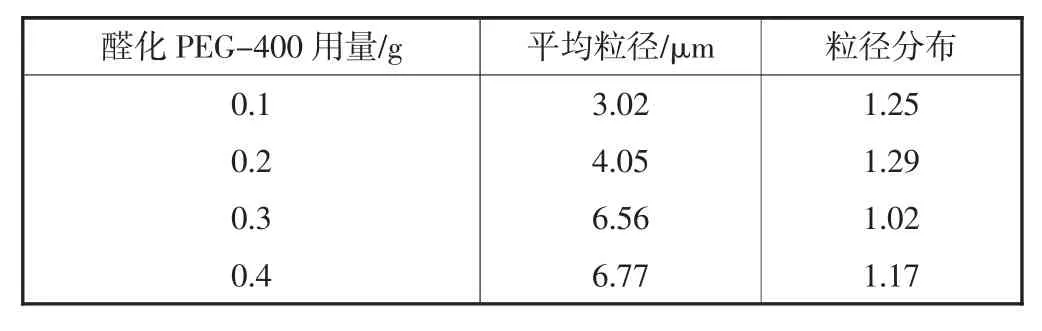
表1 不同用量的醛化PEG-400对香精微胶囊粒径的影响
通过图3可以看出,当醛化PEG-400用量不同时都能制备出微胶囊,但是它们之间存在着明显的差异,其中用量0.1,0.2,0.4 g的微胶囊粒径分布不均匀,存在破裂的微胶囊,用量为0.3 g的微胶囊有大量的饱满囊粒,且大小均一.从图4与表1中可以看出,随着醛化PEG-400用量的增加,微胶囊的平均粒径增加;图4中可以看出0.1,0.2,0.4 g的微胶囊的粒径分布较宽,或出现双分布,随着醛化PEG-400用量的增加双分布现象减小,0.3 g的微胶囊粒径分布较窄.综合图3,图4和表1可知,用量为0.3 g的醛化PEG-400微胶囊的囊粒饱满,表面光滑,粒径分布均匀.
2.4 对交联壳聚糖季铵盐香精微胶囊制备的跟踪试验
选用醛化PEG-400制备得到的香精微胶囊效果最好,因此对采用0.3 g醛化PEG-400分散剂兼原位交联剂制备香精微胶囊的过程进行跟踪试验,观察整个反应过程中香精微胶囊的变化,如图5所示.
从图5中显微跟踪反应过程发现,反应时间20 min内涂膜干燥后胶囊大部分破裂,随着反应时间的延长,微胶囊稳定性增加.反应时间300 min,可观察到稳定、无破裂微胶囊,说明此时交联反应完全.

图5 壳聚糖季铵盐香精微胶囊制备显微跟踪图
2.5 醛化PEG结构分析
2.5.1 醛化聚乙二醇FTIR分析
聚乙二醇-400,醛化聚乙二醇-400的红外谱图如图6所示.
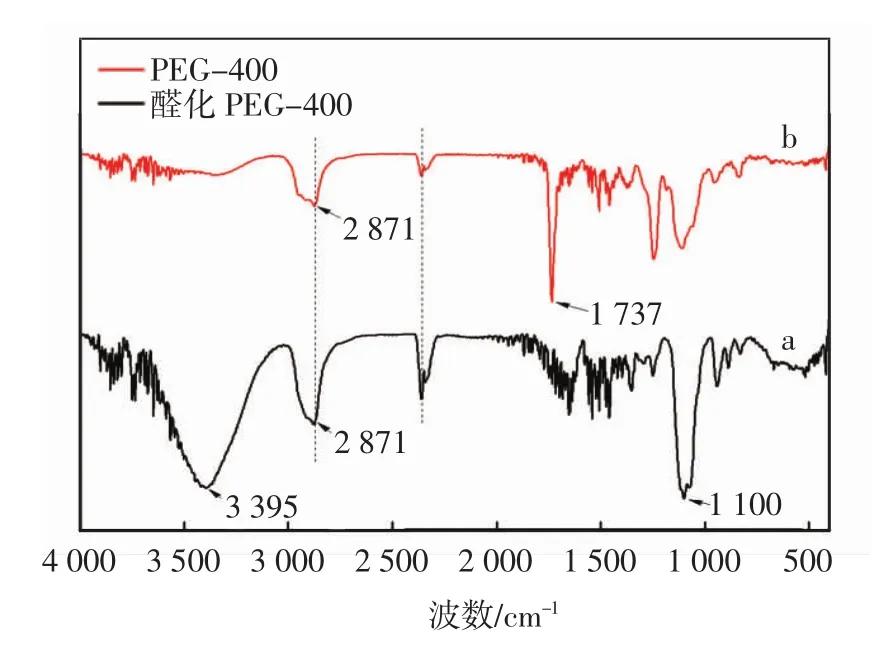
图6 醛化PEG的红外光谱图
从图6可以看出:在曲线a,b上的特征吸收峰2 871 cm-1是C—H的对称伸缩振动;曲线a上的3 395 cm-1是羟基的红外特征吸收峰,1 100 cm-1是C—O—C键的特征振动吸收峰;在曲线b上出现的1 737 cm-1吸收峰是C=O的振动吸收峰,而曲线a中的羟基吸收峰在曲线b中消失,这说明聚乙二醇-400上的羟基被氧化成了醛基.
2.5.2 醛化PEG醛化度测定
盐酸羟胺与醛基可以发生肟化反应,反应生成的HCl用标准NaOH溶液滴定.反应如下
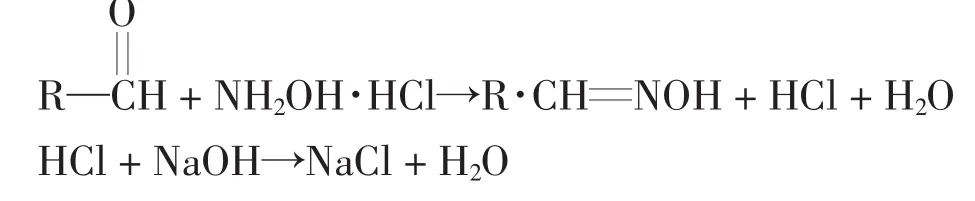
因此可以用盐酸羟胺法通过简单酸碱滴定测定试样中醛基的含量,测定3次取平均值.
试样中醛化PEG的质量分数计算公式为
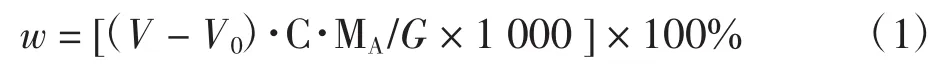
式中:V为醛化PEG消耗NaOH标准溶液体积,mL;V0为PEG所消耗NaOH标准溶液体积,mL;C为NaOH标准溶液的浓度,mol/L;MA为PEG的摩尔质量,g/mol;G为醛化PEG的质量,g.
表2为醛化PEG-400与盐酸羟胺反应后用氢氧化钠滴定数据.
从表2可知,试样中PEG成功被醛化,且醛化PEG质量分数为34.60%.
2.6 壳聚糖季铵盐香精微胶囊红外分析
壳聚糖季铵盐香精微胶囊、芯材香精和壁材壳聚糖季铵盐的红外吸收光谱图如图7所示.
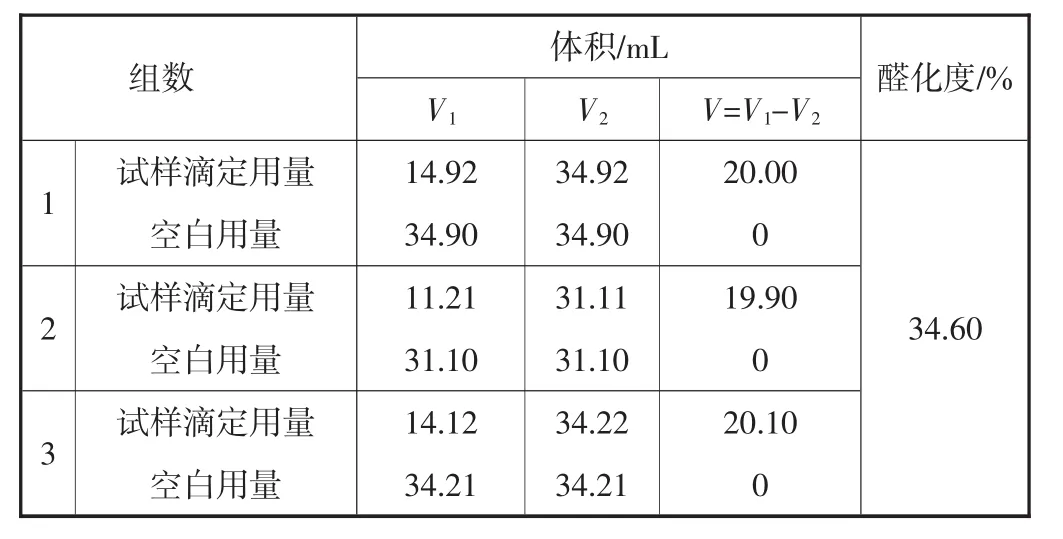
表2 采用盐酸羟胺法测定聚乙二醇的醛化度数据分析
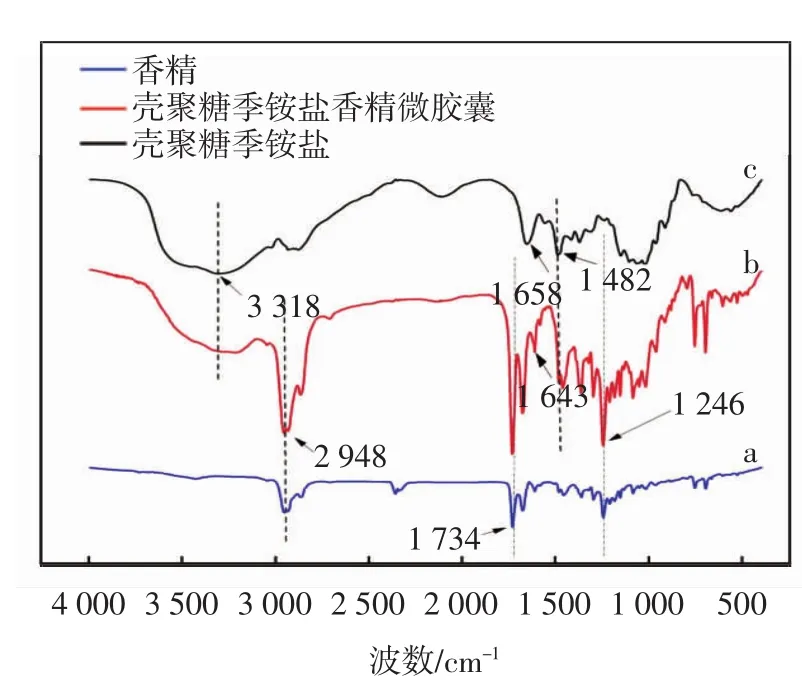
图7 香精微胶囊的红外光谱图
从图7可以看出,曲线a是芯材香精的红外谱图,图7曲线中出现了其几个具有代表性的吸收峰,分别为2 948 cm-1处属于烷烃C—H伸缩振动峰,1 734 cm-1处属于C=O的伸缩振动峰,1 246 cm-1处的吸收属于C—O的伸缩振动峰.曲线c是壳聚糖季铵盐的红外谱图,曲线中3 318 cm-1处出现的弱而宽的吸收峰是O—H和—NH2伸缩振动峰,1 658 cm-1处的吸收为—NH2弯曲振动吸收峰,1 482 cm-1处是—N+(CH3)3弯曲振动的特征吸收峰.曲线b是壳聚糖季铵盐香精微胶囊的红外谱图,壳聚糖香精微胶囊同时具备壳聚糖季铵盐和香精的特征峰,说明壳聚糖季铵盐与香精之间是物理包覆.曲线c在1 643 cm-1处出现C=N吸收峰,说明壳聚糖季铵盐与醛化聚乙二醇间发生了交联.
2.7 壳聚糖季铵盐香精微胶囊TG-DTG分析
芯材香精、壁材壳聚糖季铵盐和微胶囊的TG曲线如图8所示,DTG曲线如图9所示.
图8中曲线a为醛香香精的热失重曲线,可以清楚地看到香精在37℃之前几乎不发生失重,自37℃开始出现剧烈的失重,直到168℃,失重率约为98%.结合图9中曲线a,其最大失重速率出现在129℃,此过程可能是由于香精的沸点较低,香精直接挥发.
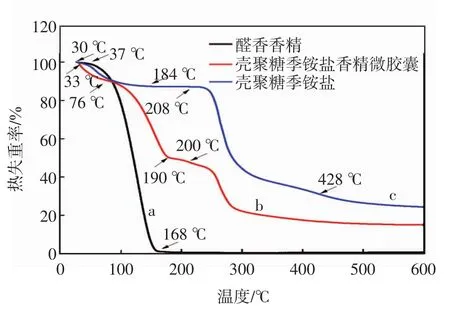
图8 香精微胶囊的热重谱图
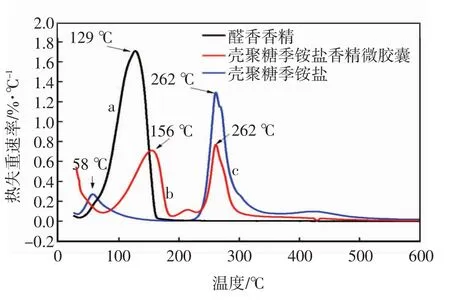
图9 香精微胶囊的微分热重谱图
图8中曲线b为壳聚糖香精微胶囊的热失重曲线,有大致三个失重阶段.第一阶段在33~76℃,失重率约为8%,此过程可能是由于微胶囊中残留水挥发所造成的重量减少;第二个阶段在76~190℃,失重率约为41%,结合图9中曲线b,其最大失重速率出现在156℃,此过程是香精中的部分物质达到沸点,微胶囊壁材逐步胀破,芯材香精从微胶囊中释放出来,其失重速度相比于图8曲线a所示更加缓慢,且温度区间比起纯香精也要宽,说明香精确实被壁材包裹而不是粘附在其表面,微胶囊的包覆显著提高了芯材香精的热稳定性;第三阶段,在200℃开始出现失重,失重率约为30%,结合图9曲线b,其最大失重速率出现在262℃,这是由于壁材壳聚糖破裂并在高温下发生了分解.
图8中曲线c是壳聚糖季铵盐的热失重曲线,有两个失重阶段,第一阶段在30~184℃,失重率约为13%,结合图9中曲线c,其最大失重速率出现在58℃,此过程可能是由于壳聚糖内部的结合水失去造成的;第二个阶段在208~428℃,失重率约为56%,结合图9中曲线b,其最大失重速率出现在262℃,此过程可能是因为壳聚糖季铵盐在高温下发生了复杂的分解反应.综上分析可见香精经微胶囊化后明显提升了香精的热稳定性,说明芯材被壁材包裹在内部,而不是附着在壁材的表面.
3 结论
采用了原位交联聚合的方法以壳聚糖季铵盐为壁材,以醛香香精为芯材,自制双环氧化聚乙二醇或醛化聚乙二醇(PEG)为分散剂和原位交联剂制备壳聚糖季铵盐香精微胶囊.结果表明:
(1)利用显微镜观察发现醛化PEG比双环氧化PEG更易与壳聚糖季铵盐交联,制备得到的香精微胶囊效果最好,从而形成香精微胶囊.
(2)选用不同分子量的醛化PEG进行对比实验,发现分子量过小过大都不利于微胶囊的形成,醛化PEG分子量为400时,可以形成囊粒饱满,粒径分布均一的微胶囊;在用量为0.3 g时,可以制备出粒径大小均一,囊粒饱满的香精微胶囊.
(3)通过FTIR分析,证明反应所用的分散剂和原位交联剂聚乙二醇(PEG)成功被醛化.通过对壳聚糖季铵盐香精微胶囊FTIR分析、TG-DTG分析,证明壳聚糖季铵盐成功包裹了香精.
(4)通过显微镜对0.3 g醛化PEG-400制备的香精微胶囊的过程进行跟踪试验,观察发现反应全程均有球形、粒径均匀的微胶囊,随着反应时间的延长,微胶囊稳定性增加.反应时间300 min,可观察到稳定、无破裂微胶囊,说明此时交联反应完全.
