核壳聚苯胺选择性磁性固相萃取-高效液相色谱-质谱法测定牛奶中痕量磺胺类药物
2019-01-14王泽岚周艳芬李吉光李和平任建林刘万毅
王泽岚 周艳芬 孟 哲 李吉光 李和平 任建林 刘万毅
(宁夏大学化学化工学院,省部共建煤炭高效利用与绿色化工国家重点实验室,银川 750021)
1 引 言
磺胺类药物(Sulfonamides,SAs)是一类含有对氨基苯磺酰胺结构的药物,具有低成本、有效性和广谱抗菌性,在大型畜禽养殖业中常被作为饲料添加剂用于预防、治疗动物疾病以及促进动物的生长,但是不足的停药期和滥用可能导致磺胺类药物在乳制品中残留。长期食用含有磺胺类药物及其代谢物残留的乳制品,会引起肾损害[1,2]。欧盟制定了乳制品中大部分SAs的最大允许残留限(Maximum residue limits,MRL),并规定SAs总和低于100g/L[3],我国制定了乳制品中16种SAs抗生素残留量测定方法的标准[4]。目前,高效液相色谱-质谱联用技术是动物源食品中痕量磺胺类药物残留检测的标准技术,分离富集前处理几乎是所有色谱-质谱检测前的必须步骤[5]。 因此,选择性地分离富集痕量目标物已经成为现代分析技术关注的热点。
近年来,基于磁性纳米颗粒(Magnetic nanoparticles,MNPs)作为吸附剂的新型磁性固相萃取技术(Magnetic solid-phase extraction,MSPE)引起了研究者的极大兴趣。MSPE技术是将磁性吸附剂分散到样品溶液中,目标化合物被选择性地吸附到分散的磁性吸附剂表面,在外部磁场作用下实现目标化合物与样品基质的分离。MSPE技术相比于传统的固相萃取(Solid-phase extraction,SPE)、固相微萃取(Solid-phase microextraction,SPME)、加速溶剂萃取(Accelerated solvent extraction,ASE)和液液萃取(Liquid-liquid extraction,LLE)等样品前处理技术具有以下优势[6~8]: 基于纳米结构的吸附剂具有大的表面积,增强的活性位点和表面丰富的官能团; 操作简单、省时快速,无需离心过滤等繁琐操作,可避免SPE中常出现的柱堵塞问题,且磁性吸附材料能够重复使用。目前,MSPE技术在SAs检测中的应用已有很多文献报道,如Li等[9]制备了CoFe2O4-石墨烯纳米复合材料磁性固相萃取牛奶样品中的磺胺类药物。Karami-Osboo等[10]采用Fe3O4磁性纳米粒子(Fe3O4MNPs)固相萃取牛奶样品中磺胺嘧啶和磺胺噻唑。曹小吉等[11]制备离子液体自聚集磁性多壁碳纳米管固相萃取环境水样中的磺胺类药物。王栋纬等[12]开展了氧化石墨烯对磺胺甲噁唑和磺胺甲基嘧啶吸附性能的研究。然而,相关研究采用的磁性固相吸附材料缺乏对目标物SAs选择性。尤其是纳米Fe3O4容易聚集,导致其磁性丧失,且没有良好的选择性。纳米磁性核壳结构的Fe3O4@SiO2复合物相对于单一组分纳米Fe3O4,更容易通过对壳层的化学改性或物理改性而获得新功能,尤其是聚合物涂覆的多层核壳磁性纳米颗粒会呈现出更好的选择性。聚合物涂层不仅赋予了磁性纳米粒子多种吸附选择性,而且为磁性纳米粒子提供了防止聚集和氧化的保护层。聚苯胺(Polyaniline,PANI)[13,14]是一种热稳定性良好的共轭导电纤维链状聚合物,其原料廉价、合成简单,有极好的耐酸碱性,在电磁波吸收领域中的应用广泛。基于PANI涂层表面的π-π键和富含的官能团,Gao等[15]采用化学氧化-原位聚合法构建了一维磁性聚苯胺(1D-PANI@Fe3O4)复合材料,用于分离富集蜂蜜中的抗生素喹诺酮; 文锐等[16]研究了磁性聚苯胺/Fe3O4复合微球吸附废水中铬离子; 丁艳等[17]基于聚苯胺稳定的光生电子和光生电子空穴的性质,构建了空心铁氧体(ZnFe2O4)硅磁/聚苯胺复合物(ZnFe2O4/SiO2/PANI),用于光催化降解废水中的甲基橙。
本研究通过构建表面疏松的多层核壳复合材料,充分暴露纤维状PANI表面官能团,以增强其对痕量目标分析物的选择性吸附。以硅磁微粒(Fe3O4@SiO2)为核,在冰水浴下,采用化学氧化-原位聚合共沉淀法制备纳米级纤维聚苯胺包覆的多层核壳硅磁聚苯胺复合材料(Fe3O4@SiO2@PANI)。将其作为磁性固相吸附剂,采用Box-Behnken Design响应面法优化影响萃取与洗脱效果的关键参数(如溶液pH值、吸附剂剂量、富集时间、洗脱液组成、洗脱体积及次数),结合高效液相色谱-质谱法(High performance liquid chromatography-mass spectrometry,HPLC-MS),建立了乳制品中痕量磺胺氯哒嗪(Sulfachloropyridazine,SCP)、磺胺二甲氧嘧啶(Sulfadimethoxine,SDM)、磺胺间甲氧嘧啶(Sulfamonomethoxine,SMM)、磺胺甲噁唑(Sulfamethoxazole,SMZ)简单快速的分析方法。
2 实验部分
2.1 仪器与试剂
高效液相色谱-串联质谱仪(LC/MS-2010EV,日本Shimadzu公司); TGL-20M高速冷冻离心机(长沙湘仪离心机有限公司); MX-F涡流混合器(美国LLC公司); DZF-6020真空干燥箱(上海精宏实验设备有限公司); LGJ-10C真空冷冻干燥机(北京四环科学仪器厂有限公司制造); Talos 200s场发射透射电子显微镜(TEM,美国FEI公司); JSM-7500F场发射扫描电子显微镜(SEM,日本电子株式会社); Spectrum Two型傅里叶变换红外光谱仪(美国PerkinElmer公司),KBr压片,扫描波数范围为4000~400 cm-1。
苯胺(An,分析纯,天津市凯通化学试剂有限公司),经减压蒸馏后使用; 过硫酸铵、六水合氯化铁(FeCl3·6H2O)、氨水(25%~28%,m/m)、HCl(36%~38%,m/m)、无水乙酸钠、无水乙醇(烟台市双双化工有限公司); 乙二醇、聚乙二醇-6000、正硅酸四乙酯(TEOS)、十六烷基三甲基溴化铵(CTAB)和三氯乙酸(分析纯,天津市大茂化学试剂厂); 甲醇、乙腈、甲酸(HPLC级, 纯度≥99.0%,Dikma公司); 磺胺氯哒嗪(SCP)、磺胺二甲氧嘧啶(SDM)、磺胺间甲氧嘧啶(SMM)、磺胺甲噁唑(SMZ)、洛美沙星(Lomefloxacin,LOM)和甲氧苄啶(Trimethoprim,TMP)标准品(纯度>99.0%,美国Sigma-Aldrich公司)。
标准溶液的配制: 分别准确称取适量的6种标准品,用甲醇溶解并配制成1000 mg/L标准储备液,分别移取适量4种磺胺类抗生素标准储备液,配制成200 mg/L的标准混合溶液,于4℃储存。
2.2 Fe3O4@SiO2@PANI复合材料的制备
2.2.1Fe3O4纳米粒子的制备采用水热法[18]制备Fe3O4纳米粒子。称取1.10 g FeCl36H2O置于33 mL乙二醇溶液中,超声5 min,再加入2.94 g无水醋酸钠和0.82 g聚乙二醇-6000,超声溶解后置于50 mL聚四氟乙烯内衬的高压反应釜中,密封, 置于烘箱,在(1805)℃水热反应16 h。待反应结束并冷却后,外磁场分离,转移Fe3O4至烧杯,用无水乙醇和纯净水清洗(每次20 mL),50℃真空干燥,得到Fe3O4纳米粒子。
2.2.2Fe3O4@SiO2的制备在250 mL烧杯中加入100 mL乙醇-水溶液(85∶15,V/V)和0.30 g Fe3O4,超声分散10 min; 在机械搅拌下,加入1.8 mL浓NH3·H2O,再缓慢滴加1 mL TEOS,搅拌6 h后,在外磁场的作用下分离,弃去上清液,分别用无水乙醇和纯净水(每次约20 mL,超声10 min)洗至pH值近中性,50℃真空干燥,得到硅磁复合物Fe3O4@SiO2。
2.2.3Fe3O4@SiO2@PANI的制备在500 mL烧杯中分别加入0.40 g硅磁复合物(Fe3O4@SiO2)、0.3 g CTAB和250 mL 1.2 mol/L HCl,超声10 min,将烧杯置于冰水浴中,在机械搅拌下,先逐滴加入0.25 mL苯胺,再滴加5 mL 0.30 mol/L过硫酸铵溶液,持续搅拌2 h。反应结束后,在外磁场作用下分离,沉淀部分用无水乙醇及纯净水洗至pH近中性。将合成的材料在冻干机冷冻干燥。图1为Fe3O4@SiO2@PANI多层核壳复合物的合成路线图。

图1 Fe3O4@SiO2@PANI复合物的制备示意图Fig.1 Schematic illustration for preparation of Fe3O4@SiO2@PANI composite. PANI: polyaniline
2.3 高效液相色谱-质谱条件
色谱柱: Kromasil-C18色谱柱(100 mm×4.6 mm,3.5 μm); 流动相A为0.1%甲酸溶液,B为0.1%甲酸-甲醇溶液; 线性梯度洗脱程序: 0~3 min,30%~40% B; 4~30 min,40%~70% B; 31~35 min,70% B; 36~40 min,70%~30% B。流速: 0.35 mL/min; 柱温: 35℃; 进样量: 20 μL。
质谱条件: 采用电喷雾离子源(Electrospray ionization,ESI)正离子扫描模式,选择离子扫描(Selective ion monitoring,SIM)模式进行定量分析,目标物的准分子离子[M+H]+分别为:m/z285(SCP)、m/z281(SMM)、m/z311(SDM)、m/z254(SMZ)、m/z291(TMP)、m/z352(LOM)。毛细管电压3.5 kV; 毛细管温度320℃; 喷雾器流速1.5 L/min,干燥器流速10 L/min。
2.4 磁性固相萃取实验
2.4.1牛奶样品的预处理4个品牌的纯牛奶样品购于超市,2个新鲜牛奶样品来自奶牛养殖场(宁夏银川)。取30 mL牛奶置于50 mL离心管,8000 r/min离心分离,转移除脂后的牛乳样品至50 mL离心管,加入4.0 mL乙腈-20%三氯乙酸(10∶1,V/V)。涡旋2 min,沉淀蛋白质,8000 r/min离心分离,收集上清液,备用,其pH<6.0。
2.4.2磁性分散固相萃取过程将10.0 mL加标100g/L预处理空白牛奶样品(pH<6.0)置于50.0 mL具盖塑料离心管,加入15.0 mg Fe3O4@SiO2@PANI复合材料,室温下振荡孵育40 min,将磁铁静置于离心管外壁,分离弃去上清液。加入甲醇-水溶液(7∶3,V/V),孵育4 min,涡旋1 min,磁性分离洗脱液,过0.22m尼龙滤膜,待HPLC-MS分析。
2.5 Fe3O4@SiO2@PANI复合物的解吸附及循环使用
收集吸附目标物的Fe3O4@SiO2@PANI复合物约60 mg置于10 mL离心管中,加入4 mL甲醇-水(7∶3,V/V),孵育4 min,涡旋1 min,外磁场分离,弃去洗脱液,再用纯水洗至中性,冷冻干燥至恒重。按照2.4.2节进行磁性分散固相萃取实验,考察材料的循环使用性能。
2.6 响应面实验设计
在单因素试验的基础上,固定目标物溶液10.0 mL,加标浓度100g/L,采用Box-Behnken响应面实验设计原理,分别考察吸附阶段样品溶液中磺胺类化合物的去除率和洗脱阶段磺胺类化合物的回收率。在吸附阶段,依据公式(1)考察溶液pH值、吸附剂剂量、富集时间3个变量影响加标溶液(100g/L)中磺胺类化合物的去除率; 在洗脱阶段,依据公式(2)考察洗脱液的组成、洗脱液体积及洗脱次数影响加标溶液(100g/L)中磺胺类化合物的回收率。
(1)
(2)
其中,C0、Ce和Ct分别为磺胺类化合物的初始浓度、吸附平衡时的浓度和t时间的吸附浓度(μg/L)。
采用Design-Expert 8.0.6设计三变量三水平的响应面分析实验,考察多层核壳Fe3O4@SiO2@PANI复合物磁性分散固相萃取牛奶样品中磺胺类抗生素的最佳萃取条件。实验变量与响应面实验水平设计见表1。
表1 实验变量与响应面实验水平
Table 1 Experimental variables and levels of the response surface analysis

吸附阶段 Adsorption step水平Level吸附剂剂量Sorbent amount(mg)(A)pH(B)吸附时间Adsorption time(min)(C)儊110.04.020015.06.040120.08.060洗脱阶段 Elution step水平Level洗脱液组成Eluent composition(V/V)(A)洗脱液体积Eluent volune(mL)(B)洗脱次数Eluent cycles(C)儊13∶70.5107∶31215∶523
3 结果与讨论
3.1 Fe3O4@SiO2@PANI复合材料的表征


图2 红外光谱图: (a)Fe3O4; (b).Fe3O4@SiO2; (c)Fe3O4@SiO2@PANI; (d)吸附磺胺抗生素的Fe3O4@SiO2@PANIFig.2 Fourier transform infrared (FTIR) spectra: (a) Fe3O4; (b) Fe3O4@SiO2; (c) Fe3O4@SiO2@PANI; (d)Fe3O4@SiO2@PANI after adsorption of analytes
振动样品磁强计(Vibrating sample magnetometer,VSM)测定结果表明,Fe3O4@SiO2@PANI复合物没有剩磁和磁矫顽力,具有良好的超顺磁性,最大饱和磁化强度(Ms)为42.20 emu/g,可满足磁性分离的磁响应要求。
由多层核壳Fe3O4@SiO2@PANI复合物的扫描电镜图(SEM,图3A)可见,复合物呈较规则的球形,平均尺寸200 nm,每个微球的表面均匀地分布着长约30 nm的纤维状PANI。在复合物的透射电镜图(Transmission electron microscope,TEM,图3B)中,内部深色的Fe3O4和渐进深色的SiO2,以及最外层的PANI层均清晰可见,表明PANI分子链具有较好的柔顺性,能够很好地包覆在Fe3O4@SiO2纳米粒子的表面。说明低温氧化自组装法可成功地制备出均匀、分散性较好、大比表面的Fe3O4@SiO2@PANI多层核壳复合物,其球形表面疏松地分布大量的纳米纤维PANI,使其表面的化学活性位点充分暴露,有利于对目标物的选择性吸附。

图3 Fe3O4@SiO2@PANI的扫描电镜图(A)和透射电镜图(B)Fig.3 Scanning electron microscopy (SEM) images (A) and transmission electron microscopy (TEM) images(B)of Fe3O4@SiO2@PANI
3.2 磁性固相萃取条件的优化
3.2.1洗脱剂的选择分别考察甲醇、0.1%甲酸-甲醇、甲醇溶液、0.1%甲酸-甲醇溶液、丙酮及丙酮-甲醇溶液(7∶3,V/V)作为洗脱溶液的洗脱效果。结果表明,采用甲醇-水溶液孵育洗脱一次,即可达到满意的洗脱效果。
3.2.2响应面设计方案根据Box-Behnken原理,采用Design-Expert 8.0.6进行三因素三水平实验,确定磁性固相萃取牛奶样品中痕量目标物SAs的最佳实验条件。在富集阶段,选择3个变量,包括吸附剂剂量、pH值和吸附时间,依据式(1)以目标化合物的去除率平均值(%)为“实验响应”。同样,在洗脱阶段,选择主要变量包括洗脱液组成,洗脱液体积和洗脱次数,依据式(2)以优化目标化合物的回收率的平均值(%)为评价洗脱性能的“实验响应”。
通过综合分析, 得到最佳磁性固相萃取条件为: 15.0 mg吸附剂、pH=6、富集时间40 min为吸附阶段的最佳参数; 1.0 mL的甲醇-水溶液(7∶3,V/V)洗脱1次为洗脱阶段的最佳参数。以磺胺氯哒嗪为例,在此条件下由公式计算的回收率理论值为73.94%,实验验证测得磺胺氯哒嗪的平均回收率为73.12%,实测值与预测值吻合性较好。
3.3 选择性实验
3.3.1Fe3O4@SiO2@PANI复合物对目标物的选择性考察吸附剂Fe3O4@SiO2@PANI对不同类型抗生素的选择性富集效果。 磺胺类抗生素磺胺氯哒嗪、磺胺二甲氧嘧啶、磺胺间甲氧嘧啶、磺胺甲噁唑,喹诺酮类抗生素洛美沙星以及甲氧苄啶,其结构式见图4。按照2.4.2节进行实验,结果见图5A,磁性Fe3O4@SiO2@PANI复合物对磺胺类目标物富集分离的回收率均大于69.7%,富集倍数高达20倍。对于甲氧苄啶和洛美沙星富集分离的回收率分别为8.3%和2.3%。研究结果表明,在弱酸性条件下,磁性Fe3O4@SiO2@PANI复合物对磺胺类化合物具有强的选择性吸附能力。

图4 目标化合物的结构式Fig.4 Structural formula of the target compounds
3.3.2Fe3O4@SiO2和Fe3O4@SiO2@PANI对磺胺类化合物选择性的对比以磺胺类抗生素磺胺氯哒嗪、磺胺二甲氧嘧啶、磺胺间甲氧嘧啶和磺胺甲噁唑为目标分子,吸附材料分别为制备的核壳Fe3O4@SiO2和Fe3O4@SiO2@PANI复合物。按照2.4.2节进行实验,考察Fe3O4@SiO2和Fe3O4@SiO2@PANI对磺胺类目标分子的选择性吸附。由图5B可见,Fe3O4@SiO2@PANI对4种磺胺类药物的富集回收率均大于69.7%,而Fe3O4@SiO2富集回收率均小于18.6%,表明Fe3O4@SiO2@PANI壳层PANI对4种磺胺类药物有较高效率的选择性吸附。

图5 MSPE吸附剂的选择性: (A)不同目标化合物; (B)不同吸附剂Fig.5 Selectivity of magnetic solid phase extraction (MSPE) sorbents: (A) different target analytes;(B) different sorbents
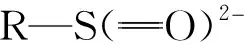
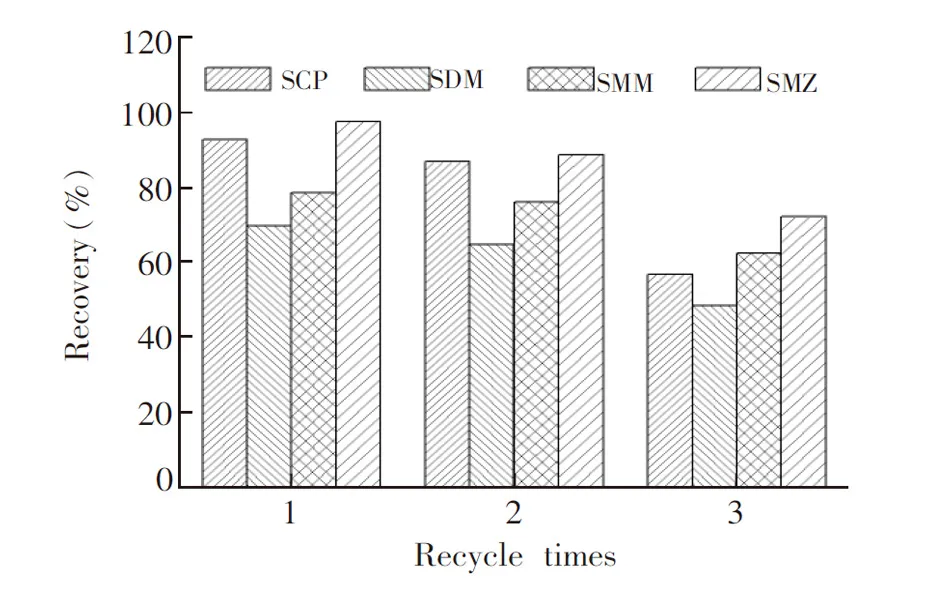
图6 吸附剂Fe3O4@SiO2@PANI重复使用的评价Fig.6 Reusability of Fe3O4@SiO2@PANI for MSPE
3.3.4吸附剂解吸和循环利用在MSPE达到平衡并磁性分离后,采用甲醇-水溶液(7∶3,V/V)一步涡旋洗脱、冷冻干燥,考察Fe3O4@SiO2@PANI对磺胺类化合物的MSPE循环使用效果。以甲醇-水溶液为洗脱剂,甲醇的静电溶剂化效应,破坏了吸附剂壳层PANI活性位点与磺酰基之间的氢键,能够实现一步快速洗脱,表明SAs在Fe3O4@SiO2@PANI表面是一个可逆的吸附-洗脱过程。吸附剂经洗脱后,在最佳条件下重复使用效果见图6,重复使用1次目标物的提取效率约损失1.0%,2次约损失7.0%,3次约损失40.0%,表明多层核壳Fe3O4@SiO2@PANI复合材料作为磁性分散固相萃取剂可循环使用2次。
3.4 方法的分析性能
在优化的实验条件下,采用基质匹配外标法对4种磺胺类目标物的线性范围、相关系数、检出限及精密度等进行了考察,结果见表2,在10~1500 μg/L浓度范围内,。SCP、SDM、SMM和SMZ浓度与色谱峰面积呈良好的线性关系,相关系数(R2)在0.9976~0.9995之间。本方法采用HPLC-MS检测的检出限(S/N=3)在1.3~8.2g/kg范围,基本符合国家标准采用高灵敏度的HPLC-MS/MS检测磺胺的最大允许残留量范围(1.0~4.0g/kg)[4]。考察了方法的重现性,以两个浓度水平(50.0和100g/kg)的加标样品进行了日内及日间精密度的测定,日内精密度≤4.6%,日间精密度≤10.7%(表2)。
表2 Fe3O4@SiO2@PANI-MSPE-HPLC-MS方法的分析性能
Table 2 Performance characteristics of Fe3O4@SiO2@PANI-MSPE-HPLC-MS

名称Compound线性方程Linear equation相关系数Correlationcoefficient(R2)线性范围Linear range(〷g/L)检出限LOD(〷g/kg)定量限LOQ(〷g/kg)日内精密度Intra-dayRSD(%)日间精密度Inter-dayRSD(%)SCPy=16167.84x+42115.150.999510~15003.110.04.510.7SDMy =45850.71x +88356.600.998910~15001.35.03.48.6SMMy =25586.34x-5934.630.999310~15002.37.54.69.6SMZy =9460.88x +90329.550.997610~15008.26.03.87.8
将本方法与文献报道方法以及GB/T 22966-2008标准方法进行比较,结果(表3)表明,Fe3O4@SiO2@PANI对磺胺类抗生素的富集具有高效的选择性,方法线性范围宽,检出限低,操作简单,实用性强。
表3 本方法与文献报道的测定牛奶中SAs方法的比较
Table 3 Comparison of references methods and this method for determination of sulfonamides (SAs) in milk

分析物Analyte基质Matrix提取方法Extraction检测方法Detection method检出限LOD回收率Recovery (%)参考文献Reference5SAsMilkCoFe2O4-grapheneHPLC-UV1.16~1.59 μg/L62.0~104.3[9]7SAsMilkCloud point extractionLC-UV2.23~9.79 μg/L67.0~105.7[28]6SAsMilkHydrochloric acid(pH 2)LC-MS/MS2.7~31.5 μg/kg68~115[29]SMM,N-ASMMMilkUltrasonication-LLEHPLC-DADLOQ: <7.5 μg/L>81[30]16SAsMilkOasis HLBHPLC-MS/MS1.0~4.0 μg/kg64.8~103.3[4]4SAsMilkHCP/Fe3O4HPLC-AD2.0~2.5 μg/L84~105[31]4SAsMilkFe3O4@SiO2@PANIHPLC-MS1.3〠8.2 〷g/kg69.7〠99.6本工作This work
3.5 实际样品分析
采用MSPE-HPLC-MS方法对本地区的4个品牌牛奶样品和2个新鲜牛奶样品进行分析,在2个新鲜牛奶样品中均检测到SCP、SDM、SMM和SMZ,4种磺胺类抗生素的总含量约为117.0g/kg,大于奶制品中总磺胺类残留的MRL。新鲜牛奶样品和加标浓度为100 μg/kg的新鲜牛奶样品的SIM离子流色谱图见图7。品牌牛奶加标回收率结果如表4所示,4种磺胺类目标物的回收率在69.7%~99.6%之间,满足国家标准[4]对奶制品中SAs目标物回收率的要求。
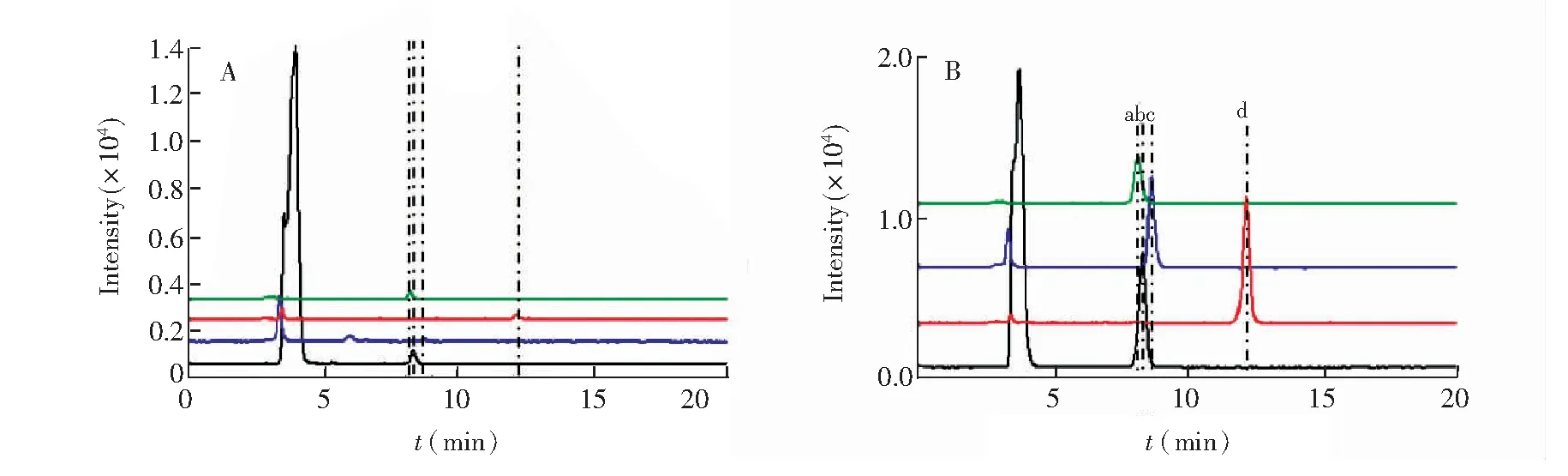
图7 新鲜牛奶样品(A)和加标新鲜牛奶样品(B)的SIM离子流图Fig.7 Typical chromatogram of fresh milk sample (A) and spiked fresh milk sample (B) in selective ion monitoring (SIM) scan mode
表4 品牌牛奶样品中4种磺胺类目标化合物的测定
Table 4 Determination results of four SAs target compounds in brand milk sample (n=3)
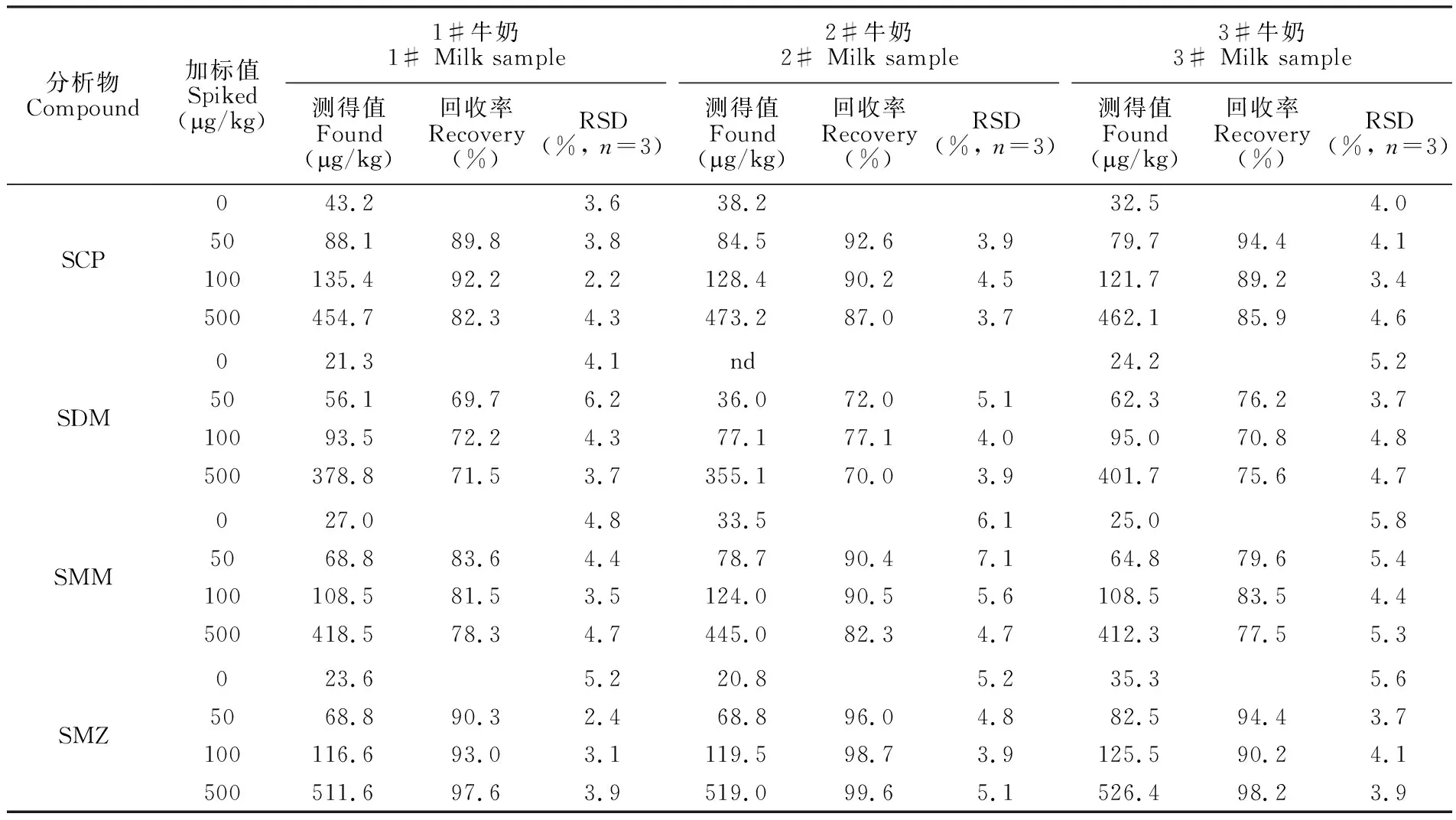
分析物Compound加标值Spiked(〷g/kg)1#牛奶1# Milk sample测得值Found(〷g/kg)回收率Recovery(%)RSD(%, n=3)2#牛奶2# Milk sample测得值Found(〷g/kg)回收率Recovery(%)RSD(%, n=3)3#牛奶3# Milk sample测得值Found(〷g/kg)回收率Recovery(%)RSD(%, n=3)SCPSDMSMMSMZ043.23.638.232.54.05088.189.83.884.592.63.979.794.44.1100135.492.22.2128.490.24.5121.789.23.4500454.782.34.3473.287.03.7462.185.94.6021.34.1nd24.25.25056.169.76.236.072.05.162.376.23.710093.572.24.377.177.14.095.070.84.8500378.871.53.7355.170.03.9401.775.64.7027.04.833.56.125.05.85068.883.64.478.790.47.164.879.65.4100108.581.53.5124.090.55.6108.583.54.4500418.578.34.7445.082.34.7412.377.55.3023.65.220.85.235.35.65068.890.32.468.896.04.882.594.43.7100116.693.03.1119.598.73.9125.590.24.1500511.697.63.9519.099.65.1526.498.23.9
4 结 论
建立了基于多层核壳Fe3O4@SiO2@PANI复合物的磁性固相萃取HPLC-MS分析测定牛奶中4种痕量磺胺类抗生素的方法。在磁性纳米粒子Fe3O4@SiO2表面修饰上一层疏松的纳米纤维PANI涂层,所合成的Fe3O4@SiO2@PANI复合物对磺胺类化合物具有好的识别能力。在单因素试验的基础上,利用Box-Behnken响应面实验设计原理,分别对吸附阶段溶液pH值、吸附剂剂量和富集时间以及洗脱阶段中洗脱液的组成、体积及洗脱次数进行优化。本方法操作简便、快速、绿色环保,选择性好,检出限低,重现性好,适用于牛奶样品中痕量磺胺类抗生素的富集及检测。
