花生内生菌的分离及促生长作用初步研究
2019-01-14杜全能齐文武谭玲玲兰时乐
杨 鑫,杜全能,齐文武,张 旭,谭玲玲,廉 欣,兰时乐*,李 林*
(1.湖南农业大学生物科学技术学院,湖南 长沙 410128; 2.中法合营王朝葡萄酒有限公司,天津 300402)
花生(ArachishypogaeaL.)是一年生豆科草本植物,是我国重要的油料作物和经济作物之一[1]。据统计,我国花生年均总产达1648.34万吨,种植面积461.11万公顷,占世界总产的40%左右[2]。由于花生连作现象普遍,导致花生种植地土壤理化条件恶化[3]、土壤微生物种群失衡[4-5]、化感自毒作用[6]、产量下降[7]等问题,给我国的花生生产带来了巨大的经济损失。
植物内生菌是指定殖在健康植物组织内的一类微生物,可与宿主植物形成共生或寄生关系,且不引起植物侵染性的病害[8]。近年来,内生菌对植物生长发育的影响,国内外学者做了大量的研究工作[9-11]。研究发现,花生内生菌以芽孢杆菌属、欧文氏菌属和黄单孢菌属为优势菌[12];带有Bt基因的花生内生菌可提高花生的株高、分枝数、主根长和地上部、地下部鲜质量等生物学指标[13]。
本文从花生根茎叶中分离内生细菌,采用沙培法,以地上部鲜质量、根鲜质量、根长和苗高、根系活力、叶绿素含量以及保护酶活力为指标,研究其促生长作用,为花生内生菌的应用提供技术支持。
1 材料与方法
1.1 试验材料
内生菌分离样品为湘花2008饱果期的健康植株。供试花生品种为湘花2008,由湖南农业大学花生研究所提供。斜面及筛选培养基(牛肉膏蛋白胨培养基)[14];生理生化测定培养基[15]。发酵培养基:葡萄糖3%,酵母提取粉 0.4%,蛋白胨0.6%,KH2PO40.24%,MgSO4·7H2O 0.12%,NaCl 0.3%,CaCO30.3%,pH 7.5。
1.2 方法
1.2.1 花生内生菌的初筛
参照文献[16]提供的分离方法进行。将花生根茎和果实利用自来水冲洗后晾干。将根茎剪成2~3 cm长,果实去壳,分别用95%乙醇和0.1% HgCl2进行表面消毒5 min,用无菌水将根茎和果实表面连续冲洗3次后,分别置于灭菌的研钵中,无菌条件下充分磨碎,适当稀释后,取0.1 mL稀释液于牛肉膏蛋白胨培养基平板中央,涂布均匀,同时取最后一次的冲洗液0.1 mL涂布平板以证明表面消毒是否彻底。37 ℃下培养至长出菌落,划线纯化,编号,保存。
1.2.2 花生内生菌复筛
(1) 将河沙用自来水洗净、晒干后置于干热灭菌箱160 ℃灭菌2 h,冷却后称取2.5 kg于140 mm×111.5 mm×95 mm的花盆中备用。
(2) 幼苗培养[17]:将从花生根茎和果实中分离得到的11株内生细菌分别接种于牛肉膏蛋白胨液体培养基中,37℃,150 r/min恒温振荡培养48 h,用无菌水稀释至含菌数为106cfu/mL,将花生种子浸泡于稀释液中10 min,播种于装有灭菌河沙的花钵中,置于25 ℃光照培养箱中,保持河沙湿润,以无菌水浸泡的种子为对照。每钵播种3粒种子,每菌3次重复。观察种子的发芽和生长情况。出苗30 d后将花生苗轻轻地拔出,用自来水将根上的沙子洗净,用吸水纸将植株及根表面的水吸干,称根茎重并量取株高。以根鲜质量,地上部鲜质量和根长等为指标,筛选对花生具有促生作用的菌株。
1.2.3 内生菌鉴定
(1) 形态观察。① 菌落形态特征观察。将花生内生菌YX-1接种于牛肉膏蛋白胨固体培养基平板上,于37 ℃培养箱中培养24~48 h,观察菌落形态特征。② 菌体形态特征观察。通过简单染色和革兰氏染色技术观察菌体形态和革兰氏染色反应。
(2) 生理生化特征试验。参照文献[18-19]提供的方法进行碳源利用试验、氮源利用试验、葡萄糖发酵试验、淀粉水解试验、纤维素分解试验、M.R.试验、V.P.试验、柠檬酸盐试验、过氧化氢酶试验、吲哚试验等。
(3) 16S rDNA序列分析。基因组总DNA提取:按照Ezup柱式细菌基因组DNA抽提试剂盒提取总DNA,作为后续16S rDNA序列扩增反应模板。PCR扩增:使用细菌鉴定通用引物27F(5'-AGTTTGATCMTGGCTCAG-3')和1492R(5'-GGTTACCTTGTTACGACTT-3')。PCR反应体系:0.5 μL DNA模板、0.5 μL 上下游引物、1 μL dNTP、2.5 μL 10×PCR buffer(MgCl2)、0.2 μL Taq DNA 聚合酶,ddH2O补齐到25 μL。PCR循环条件:94 ℃预变性4 min,然后94 ℃变性45 s、55 ℃退火45 s、72 ℃延伸1 min,完成30个循环,最后72 ℃修复延伸10 min。
用1%琼脂糖凝胶检测PCR产物,用SanPrep柱式DNA 胶回收试剂盒回收。将回收的PCR产物送至上海生工生物工程技术服务有限公司进行测序。测序结果通过http://www.ncbi.nih.nlm.gov网站用BLAST进行序列同源性比对,用MEGA6.06的Neighbor-Joining法构建系统发育树,并进行1000次Bootstraps检验。
1.2.4 内生菌促生作用
(1) 内生菌菌液制备。将经斜面培养基活化的内生菌YX-1接种于发酵培养基中,32 ℃,180 r/min条件下振荡培养48 h,备用。
(2) 花生种子的发芽和处理。将花生种子浸泡于28 ℃温水中并置于28 ℃恒温培养箱中催芽至芽长2~3 cm,种植于装有灭菌河沙的花钵中,每钵3粒种子。将用发酵培养基培养至活菌数为109cfu/mL的YX-1菌株培养液分别用无菌水稀释10、100、1000和10000倍。试验组分为:CK:浇施等量无菌水;Ⅰ组:浇施10倍培养液稀释液;Ⅱ组:浇施100倍培养液稀释液;Ⅲ组:浇施1000倍培养液稀释液;Ⅳ组:浇施10000倍培养液稀释液。每次浇量为30 mL。随机摆放于光照培养箱中,保持25 ℃、湿度80%~90%培养30 d,光照时间12 h/d。每处理重复3次。期间每7 d浇施1次菌稀释液,并保持河沙湿润。
(3) 测定项目。① 花生幼苗指标测定:出苗30 d后将花生苗轻轻拔出,用自来水将根上的沙子洗净,用吸水纸将植株及根表面的水吸干,测量地上、地下部鲜质量以及株高、主根长。② 叶绿素含量测定:参照文献[20]提供的方法进行。③ 根系活力测定:采用氯化三苯基四氮唑(TTC)法测定[21]。④ 花生植株体内保护酶测定:参照文献[22]提供的方法进行。
1.2.5 数据处理
所得数据采用Microsoft Excel 2010软件进行统计分析。
2 结果与分析
2.1 花生内生菌初筛结果
从花生植株及果实共分离得到11株花生内生细菌,其中根中分离到4株,分别编号为YX-1~4;茎中分离到3株,分别编号为YX-5~7;从果实中分离到4株,分别编号为YX-8~11。结果见表1。
2.2 内生菌复筛结果
表2可看出,内生菌株YX-1的平均株高、地上部鲜质量和根鲜质量均最大,分别为19.52cm、3.87 g和1.44 g,但根长较菌株YX-9小。综合考虑,选择内生菌YX-1进行后续试验。
2.3 内生菌YX-1鉴定
2.3.1 形态特征观察
菌株菌落为米黄色,圆形,凸起,边缘整齐,菌落表面湿润,革兰氏染色阳性,细胞杆状,芽孢椭圆形,偏端生。

表1 初筛结果

表2 内生菌对幼苗生长的影响

表3 生理生化特征结果
注:"+"表示试验结果为阳性,"-"表示试验结果为阴性,"Θ"表示产酸不产气。
Note: + indicate positive result, - indicate negative result, Θ indicate acid production without gas.
2.3.2 生理生化试验结果
对分离得到的纯菌株YX-1进行部分生理生化试验,结果见表3。根据菌株YX-1的形态特征和生理生化特征,初步鉴定该菌为芽孢杆菌属菌株。
2.3.3 16S rDNA序列分析
通过16S rDNA通用引物(27F/1492R)扩增后进行电泳分析如图1。
将菌株YX-1的PCR扩增产物进行回收测序,结果在NCBI网站中使用Blast在GeneBank基因库中进行同源性搜索,选择同源性较高的菌株16S rDNA进行多序列比对,构建系统发育树。结果见图2。根据菌株YX-1的形态特征、生理生化特征鉴定结果,结合基于16S rDNA系统发育分析,将该菌鉴定为苏云金芽孢杆菌(Bacillusthuringiensis)。

图1 菌株YX-1 16S rDNA PCR扩增结果 Fig.1 Result of 16SrDNA PCR amplification of YX-1strain

图2 菌株YX-1基于16S rDNA的系统发育树 Fig.2 Phylogenetic tree of YX-1 strain based on 16S rDNA sequence identity
2.4 花生内生菌YX-1的促生作用
2.4.1 内生菌YX-1对花生幼苗生长的影响
从表4可知,施用内生菌YX-1不同稀释倍数的发酵液对花生幼苗地上部鲜质量、根鲜质量、根长和苗高与对照比均有不同程度的提高。当施用稀释倍数为1000倍的发酵液时,地上部鲜质量、根鲜质量、根长和苗高较对照分别提高44.05%、43.40%、27.76%和25.57%,且均达到显著水平(p<0.05),但根长和苗高与施用其他稀释倍数的处理之间差异不显著(p>0.05)。

表4 内生菌YX-1对花生幼苗生长结果
注:表中同列数据后不同小写字母表示不同处理间差异显著水平p<0.05。
Note: Different small letters in the same column indicate the significance level of difference atp<0.05.
2.4.2 苏云金芽孢杆菌YX-1对叶绿素含量的影响
图3可看出,施用不同稀释浓度的花生内生菌苏云金芽孢杆菌,花生植株叶片叶绿素含量明显高于对照。当苏云金芽孢杆菌发酵液稀释1000倍时,叶绿素含量最高,达2.3972 mg·g-1FM,较对照提高38.19%,但与稀释100倍和10000倍的处理差异不显著(p>0.05),而稀释10倍的处理叶绿素含量显著低于其他处理(p<0.05)。原因可能为稀释倍数小,pH值高,导致沙土酸碱度高,从而改变了花生适宜生长的酸碱度。
2.4.3 苏云金芽孢杆菌YX-1对根系活力的影响
根系是植物的主要功能器官,可以从土壤中吸收水分和各种营养物质,促进植物的生长。从图4可知,不同稀释倍数的苏云金芽孢杆菌稀释液对花生根系活力的影响较大。当稀释倍数为1000倍时,根系活力最大,为272.5 μg·g-1·h-1,显著高于其他处理组和对照组(p<0.05)。说明苏云金芽孢杆菌YX-1发酵液在适当的稀释倍数下能提高花生的根系活力。
2.4.4 内生菌YX-1对花生保护酶活力的影响
表5可知,处理组和对照组根系中SOD酶活性都较低,但叶片中的SOD酶活性较高。当稀释倍数为1000倍时,花生根系和叶片中的SOD酶活性均最高,分别为20.15 U·g-1FM和255.74 U·g-1FM,均与对照和10倍处理差异显著(p<0.05),但与稀释100倍至稀释10000倍差异不显著(p>0.05)。
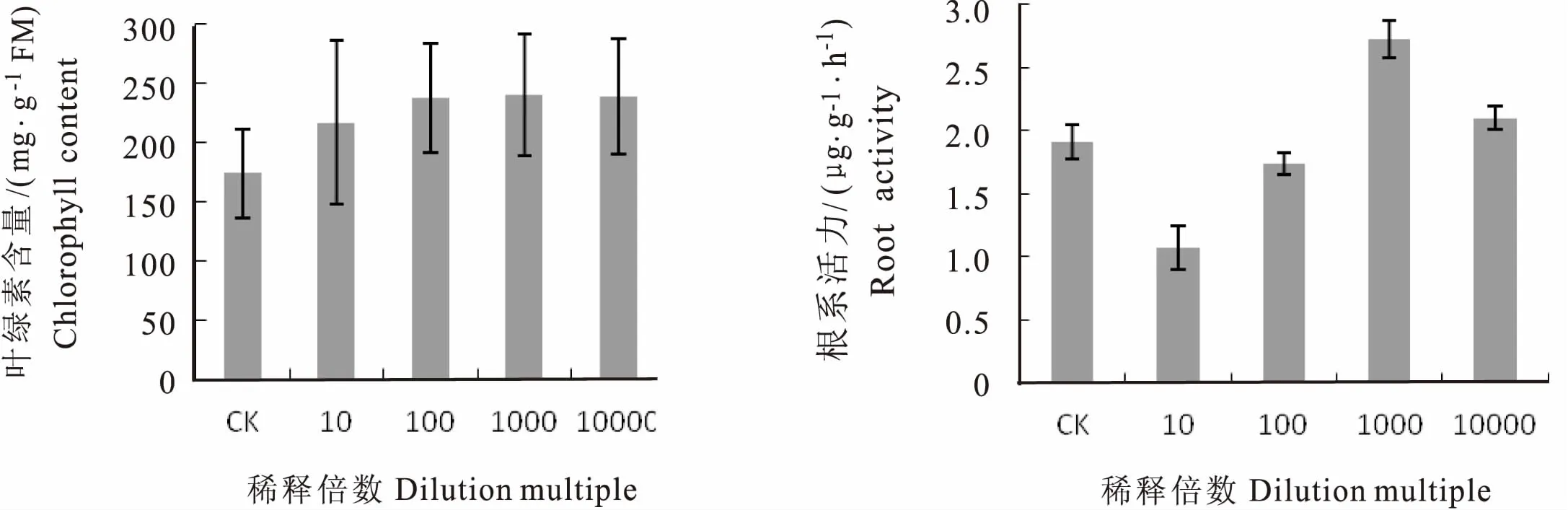
图3 不同稀释倍数YX-1对叶绿素含量的影响
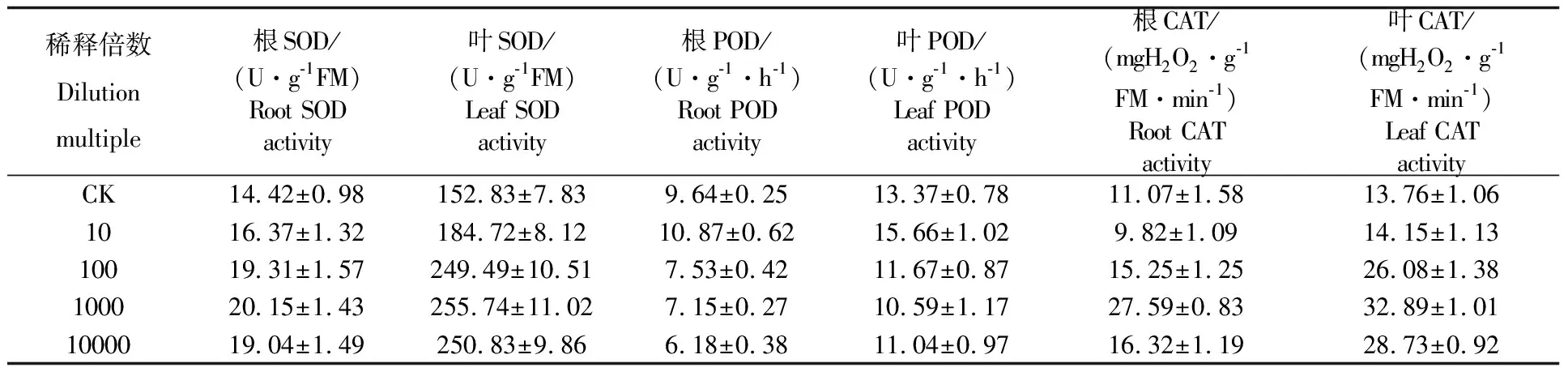
表5 不同稀释倍数内生菌YX-1对花生保护酶活力的影响
根和叶中POD酶活力除了施用10倍稀释液的处理高于对照处理外,其他处理根和叶中POD酶活力均低于对照处理,但处理之间差异不显著。
在稀释倍数10~1000倍之内,随着稀释倍数的增加,花生根系和叶片内的CAT酶活性也随之增加。当稀释倍数为1000倍时,根系和叶片中的CAT酶活性最高,分别为27.59 mgH2O2·g-1FM和32.89 mgH2O2·g-1FM,但稀释倍数超过1000倍,CAT酶活性均下降,而且稀释倍数在100~10000倍之间,CAT酶活性与对照比,差异显著(p<0.05)。说明花生内生菌苏云金芽孢杆菌YX-1能提高花生植株体内CAT酶活性。
3 讨 论
3.1 内生菌促生作用
内生菌的促生长作用主要是通过为宿主植物提供营养、代谢产物、产生生长激素和增强宿主的抗逆能力等[23]。研究表明,从霍山石斛中分离的甲基营养芽孢杆菌(Bacillusmethylotrophicus)能显著促进玉米幼苗生长[24];从盐生碱蓬中分离的内生真菌Glomerellacingulata能促进水稻幼苗生长[25];番茄内生菌102能促进番茄、青菜种子的萌发,对青菜、菠菜具有显著的促进生长作用[26];从花生根际中分离出1株高产植物生长素的特基拉芽孢杆菌,能有效提高花生的产量[27]。本研究结果表明,施用不同浓度的花生内生菌YX-1发酵液稀释液,能显著提高花生幼苗地上部鲜质量、根鲜质量、根长和苗高、根系活力、叶绿素含量,说明内生菌YX-1发酵液在适当稀释倍数下能促进花生生长。
3.2 内生菌对植株保护酶的影响
SOD、POD和CAT为植物抗氧化防御系统中最重要的3个保护酶,在清除自由基、H2O2、过氧化物和减少羟基自由基等方面起到至关重要的作用[28]。国内外研究逆境影响植株体内SOD、POD和CAT的活性报道较多[29-31],但植物内生菌对植物体内SOD、POD和CAT活性的影响报道较少。本研究表明,花生内生菌苏云金芽孢杆菌YX-1发酵液在适当稀释度下能提高植株体内SOD、CAT的活性,而POD活性随内生菌发酵液稀释倍数的增加而下降。
4 结论
从花生中分离到1株内生细菌YX-1,通过形态学特征、生理生化特征并结合16S rDNA序列分析将该菌鉴定为苏云金芽孢杆菌(Bacillusthuringiensis);沙培试验结果表明,当施用稀释倍数为1000倍的发酵液时,地上部鲜质量、根鲜质量、根长和苗高较对照分别提高44.05%、43.40%、27.76%和25.57%,且均达到显著水平(p<0.05),幼苗叶片中叶绿素含量、根系活力较对照分别提高38.19%、42.08%,叶和根中的SOD、CAT显著高于对照处理,而POD酶活力低于对照处理。
