香附挥发油诱导A549细胞凋亡作用
2019-01-12,
,
(浙江工业大学 药学院,浙江 杭州 310014)
目前,肺癌是最常见的恶性肿瘤之一,是世界公认的“癌症之王”。近年来,受城市工业化进程的加速、环境污染和吸烟人群增多等因素的影响,肺癌的发病率呈迅速上升趋势。2015年癌症统计数据显示[1]:中国癌症总发病429.16万例,总死亡281.42万例,2015年全国肺癌发病73.33万例,死亡61.02万例,取代肝癌成为恶性肿瘤之首。如此高的发病率及死亡率表明现有治疗肺癌的药物疗效较差,急需大力研发高效低毒的抗肺癌新药。
香附是常用的中药之一,主要用于治疗肝郁气滞、胸肋胀痛、脾胃气滞和月经不调等病症。活性成分主要为挥发油(含单萜、倍半萜、黄酮类、糖类、生物碱、酚类及三萜类化合物)[2],其中α-香附酮和α-香附烯为主要成分,占挥发油成分的28.85%[3]。单味香附抗肺癌方面的研究未见报道。本课题组前期研究发现:利用超临界CO2萃取香附挥发油(ACA),对正常细胞毒性较小,能杀死多种癌细胞。
1 材料与方法
1.1 材 料
1.1.1 细胞株
人肺腺癌细胞A549购自上海中科院细胞所。
1.1.2 试 剂
香附购自杭州中药饮片厂;RPMI-1640培养液、0.25%胰蛋白酶和PBS购自吉诺生物医药技术有限公司;MTT(噻唑兰)、DMSO和Rhodamine123购自SIGMA公司;澳洲胎牛血清(Fetal bovine serum,FBS)购自CLARK Bioscience公司;注射用顺铂(冻干型)购自齐鲁制药有限公司,批号H20023461;乳酸脱氢酶(LDH)试剂盒、丙二醛(MDA)试剂盒和超氧化物歧化酶(SOD)试剂盒均购自南京建成生物工程研究所;Annexin V-EGFP细胞凋亡检测试剂盒购自南京凯基生物技术有限公司;Fura-2 AM钙离子荧光探针试剂盒、ATP含量测定试剂盒均购自碧云天生物技术有限公司。
1.1.3 仪 器
超临界CO2萃取装置(南通华安超临界萃取有限公司,型号HA221-50-03);生物安全柜(Nuaire,型号NU-425-400S);CO2培养箱(Thermo electron corporation,型号NU-5510E);倒置光学显微镜(Nikon eclipse,型号TS100-FDH1);多功能酶标仪(BioTek,型号synergy HI)和离心机(Heraeus,型号LDZ5-2);台式低温高速离心机(Thermo,型号Z36HK)。
1.2 试验方法
1.2.1 超临界CO2装置萃取香附挥发油成分
将香附研磨成粉,取1 kg置萃取釜中,萃取条件:温度55 ℃,压强20 MPa,时间4 h[4]。萃取率计算公式为
萃取率=(ACA质量/原料质量)×100%
1.2.2 MTT法检测细胞活力
收集对数生长期A549细胞,用RPMI-1640培养液(含10% FBS)制成细胞悬液,以103个/孔接种于96孔板,置于37 ℃,5%的CO2饱和湿度培养箱中进行培养24 h。设正常组(RPMI-1640培养液),不同质量浓度ACA和顺铂(cisplatin, DDP)阳性对照组,每组设6个复孔。药物作用时间分别设置为24,48,72 h。采用MTT法,用多功能酶标仪在490 nm处检测各孔吸光度值,重复实验3次,研究不同质量浓度的药物作用不同时间对A549细胞活力的影响,以确定药物致A549细胞死亡作用及其量-效、时-效关系和IC50(半数致死质量浓度)。细胞抑制率计算公式为
抑制率=(1-OD实验组-OD空白)/(OD正常组-OD空白)×100%
1.2.3 LDH,SOD活性及MDA浓度检测
采用1.2.2方法进行细胞培养及接种。分别设置正常组(RPMI-1640培养液),不同质量浓度ACA组,每组设6个复孔。药物作用24 h后,收集细胞上清液按照试剂盒说明书检测LDH活性,裂解细胞后按照试剂盒说明书检测MDA浓度及SOD活性,重复实验3次。
1.2.4 Annexin V-EGFP/PI双重荧光染色观察ACA致A549细胞凋亡
细胞培养及接种方法同1.2.2。分别设置正常组(RPMI-1640培养液)、ACA组(经预实验,终质量浓度为140μg/mL),每组设6个复孔。药物分别作用3,6,12 h后,弃去上清,用PBS清洗3次,每孔分别加入40 μL Binding Buffer+5 μL Annexin V-EGFP室温避光反应15 min,再加入5 μL PI室温避光反应15 min。荧光显微镜下观察、拍照[5-6]。
1.2.5 A549细胞内Ca2+浓度测定
同1.2.2方法进行细胞培养、接种和分组。用不同质量浓度ACA作用24 h后,弃去培养液后,PBS清洗3次。用RPMI-1640培养液将2 mmol/L Fura-2 AM稀释至5 μmol/L,每孔加入40 μL,在37 ℃孵育1 h,激发波长为340 nm和380 nm,发射波长为510 nm,检测荧光强度。用340 nm和380 nm荧光的比值来检测细胞内的Ca2+浓度[7-8]。
1.2.6 A549细胞内ATP浓度测定
取对数生长期A549细胞,以1×105个/孔接种于6孔板内,分别设置正常组(RPMI-1640培养液),不同质量浓度ACA组,每组设6个复孔。药物作用24 h后,按照试剂盒说明书检测细胞内ATP浓度[9]。
1.2.7 A549细胞线粒体膜电位(Δψ)检测
细胞培养、接种和分组方法同1.2.2。用不同质量浓度ACA作用24 h后,弃去培养液后,PBS清洗3次,加入含10 μg/mL Rh 123的无酚红RPMI-1640培养液,37 ℃孵育30 min,弃去培养液,PBS清洗多次至背景较浅,加入适量无酚红RPMI-1640培养液,荧光显微镜观察、拍照。多功能酶标仪检测荧光值,激发波长为488 nm,发射波长为530 nm[10]。
1.2.8 统计学分析
采用GraphPad Prism软件处理实验数据,数据用(Mean±SD)表示,采用One-way ANOVA检测均数差异显著性,以P<0.05为差异有显著性意义。
2 实验结果及分析
2.1 超临界CO2装置萃取ACA
萃取获得棕黄色油状液体,萃取率为1.045%。
2.2 ACA对A549细胞的毒性作用
2.2.1 A549细胞形态学改变
细胞形态变化(×200)见图1,正常组随时间延长细胞数量增多,形态呈扁平不规则多角形。不同质量浓度ACA组,随质量浓度增加,作用时间延长,细胞数量逐渐减少,形态变圆,细胞膜皱缩,出现膜泡样变、体积缩小、核固缩,表现凋亡特征性变化,最终解体。本结果提示ACA诱导A549凋亡的可能性,将在后续研究中进一步确定。
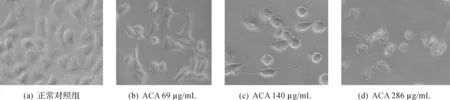
图1 ACA作用24 h致A549细胞形态变化(200倍)Fig.1 ACA induced morphological changes of A549 cells after 24 h (×200)
2.2.2 ACA对A549细胞毒性作用的量-效、时-效关系
顺铂(DDP)属于铂类配合物,是临床上常用的一线抗癌药物,疗效肯定,具有破坏DNA的结构和功能,是一种广谱的细胞周期非特异性抗癌药物,常用于肺癌、前列腺癌和头颈部磷状细胞癌等的治疗,因此选DDP为阳性对照药。
当ACA质量浓度范围在48~286 μg/mL,作用时间分别为24,48,72 h,随着质量浓度的增加和作用时间的延长,A549细胞活力逐渐降低,有明显量-效和时-效依赖关系(图2)。本部分结果发现:1) ACA效能极强,光镜下可见能完全杀死肺癌细胞,远高于DDP;2) 相较正常组,当ACA质量浓度为286 μg/mL,作用24 h时,细胞活力抑制率达99.8%(P<0.001);作用2 d,200 μg/mL也达同一峰效应;表明ACA杀伤癌细胞起效快,效能强,提示可以用短期冲击治疗;3) 前期实验结果表明,DDP为4 μg/mL,作用72 h,对正常肝细胞活力抑制率为97.9%,已超过临床可接受的毒性范围,因此本研究为比较抗癌效能而采用这一质量浓度;而ACA 140 μg/mL,作用72 h,对正常肝细胞活力的抑制率为50.1%,考虑到肝细胞再生能力强,ACA对正常肝细胞的毒性在可接受范围[4]。结果表明:ACA比DDP更适于肺癌治疗,治疗质量浓度范围以98~200 μg/mL为宜。作用时间为24,48,72 h,ACA的IC50分别为161.47,126.35,72.37 μg/mL,即ACA对肺癌细胞的毒性随着作用时间延长而增大。图2中,与正常对照组(0质量浓度,下同)比较,*P<0.05,**P<0.01,***P<0.001。


图2 DDP和ACA对A549细胞毒作用的量-效和时-效关系Fig.2 Dose-and time-cytotoxic effect relationship of ACA on A549 cells
2.2.3 ACA诱发A549细胞LDH释放
乳酸脱氢酶(LDH)是细胞内酶,细胞膜受损致LDH漏出,故培养上清液中LDH活性测定可间接反映细胞严重损伤乃至死亡情况。如图3所示,ACA质量浓度依赖性增加,LDH释放增多,最小有效质量浓度为69 μg/mL。该结果与MTT法测细胞活力的实验结果一致。图3中,与正常对照组比较,*P<0.05,**P<0.01,***P<0.001。
2.3 Annexin V-EGFP/PI双重荧光染色观察ACA致A549细胞凋亡
ACA(140 μg/mL)作用不同时间后,经Annexin V-EGFP/PI双重荧光染色(×200),细胞变化见图4,正常组细胞未着色,ACA作用3 h时细胞呈绿色,提示细胞进入凋亡早期(膜损伤)。6 h时少量细胞呈红绿双染,12 h时大量细胞呈红绿双染,表明这些细胞不可逆死亡。本结果表明:ACA杀伤细胞的主要机制是诱导细胞凋亡,可能少量细胞发生坏死;ACA起效时间短,12 h即可杀死大量癌细胞。

图3 ACA致A549细胞LDH释放Fig.3 Effects of ACA on LDH levels in A549 cell

图4 Annexin V-EGFP/PI双重荧光染色法(200倍)Fig.4 Fluorescence images of Annexin V-EGFP/PI double staining(×200)
2.4 ACA致A549细胞内Ca2+超载
作为细胞死亡信号[11-12],Ca2+超载能引起氧化应激,激活细胞凋亡的内源性线粒体途径、细胞坏死和自噬过程。Fura-2 AM是一种可以穿透细胞的荧光染料,其进入细胞后可以被细胞内酯酶剪切成水溶性Fura-2,从而被滞留在细胞内,Fura-2可以和钙离子结合,在330~350 nm激发光下产生较强的荧光,在380 nm激发光下则会导致荧光减弱。用340 nm和380 nm这两个荧光比值来检测细胞内Ca2+浓度是国际常用经典方法。
如图5所示,相较正常组,随ACA质量浓度的增加,细胞内Ca2+浓度显著增高(P<0.05,P<0.001),提示ACA可致细胞内钙超载,参与细胞死亡过程。
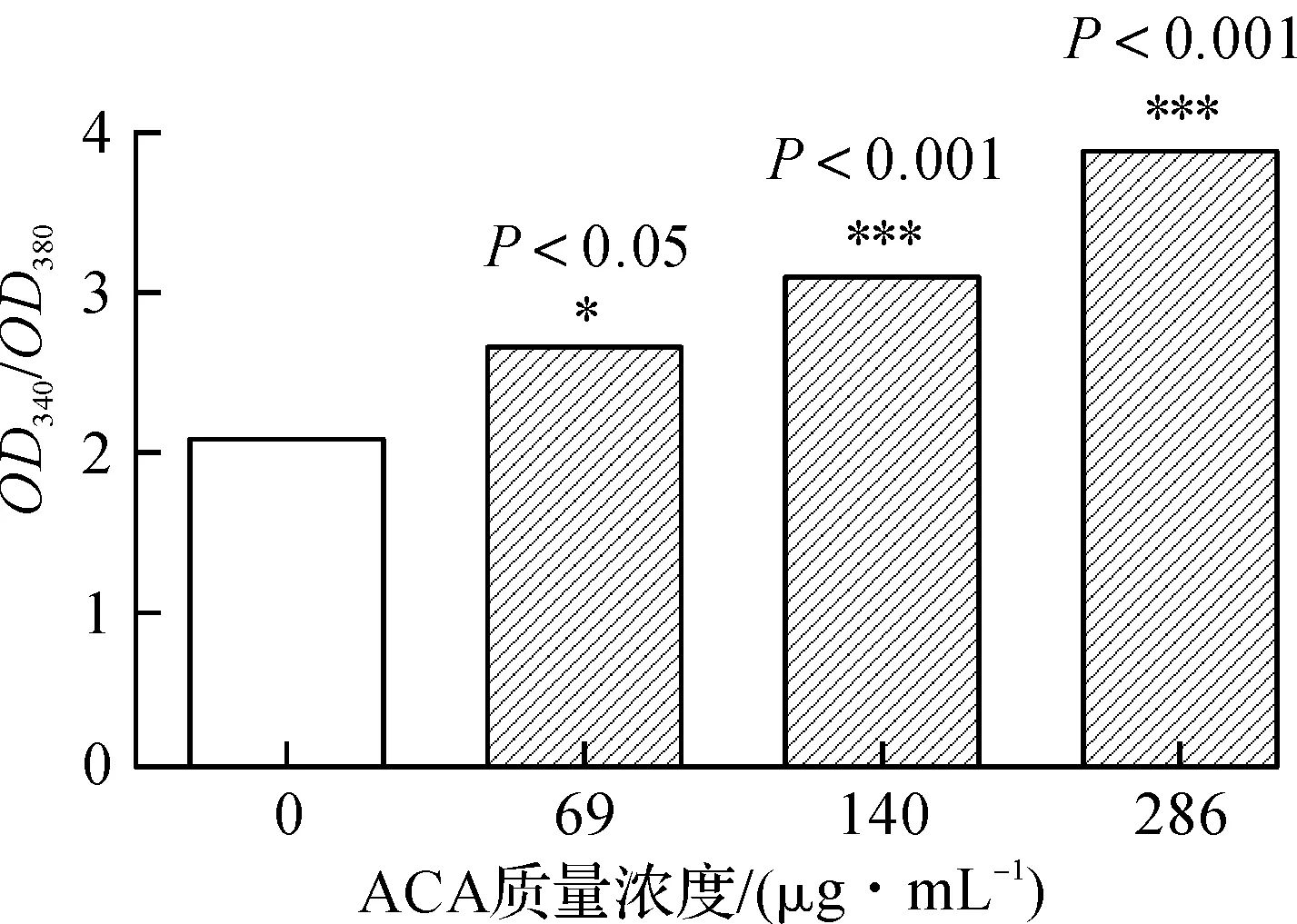
图5 ACA致A549细胞Ca2+超载Fig.5 ACA increases Ca2+levels in A549 cells
2.5 ACA致A549细胞氧化损伤
丙二醛(MDA)是脂质过氧化产物,MDA的浓度反映脂质过氧化程度。超氧化物歧化酶(SOD)活性高低则能间接反映细胞清除氧自由基的能力。测定两者可以反映细胞氧化损伤的情况。当细胞抗氧化能力减弱,细胞内活性氧(ROS)堆积,引起的细胞应激反应,是理化因子诱发细胞凋亡的重要触发方式[13]。
如图6所示,随ACA质量浓度渐增,细胞内MDA浓度不断增加,而SOD活力不断下降,表明ACA呈质量浓度依赖性引起A549细胞氧化损伤。图6中,与正常组相比较,**P<0.01,***P<0.001。
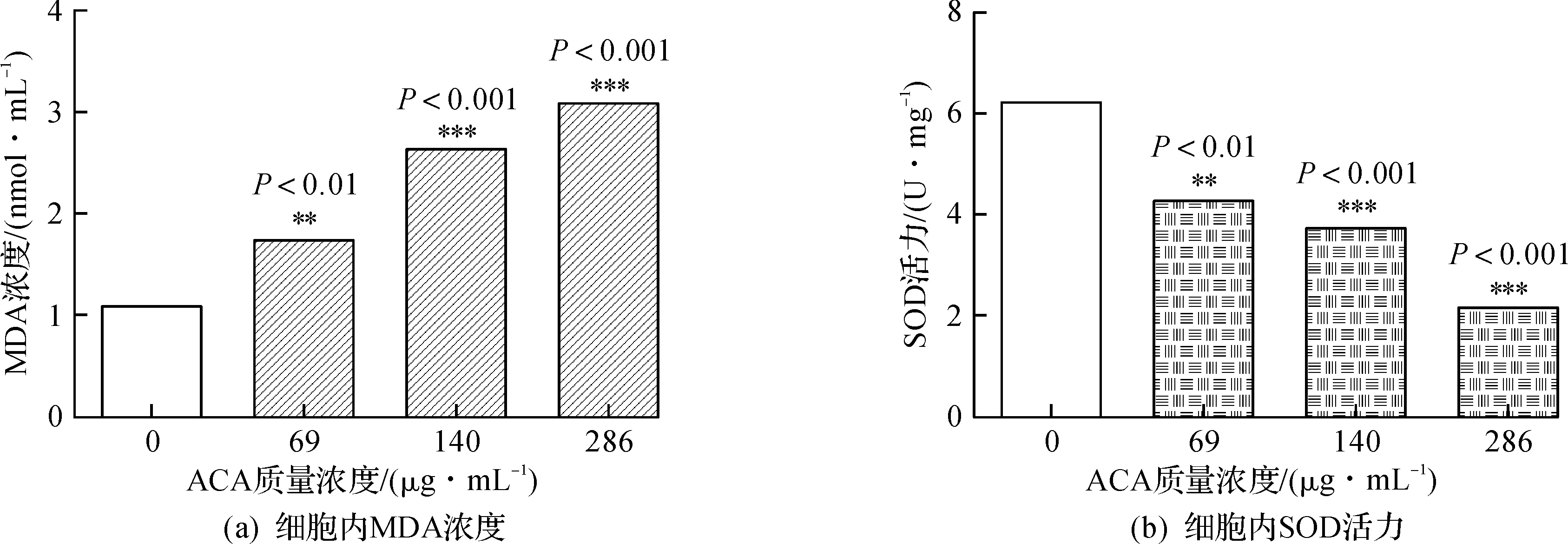
图6 ACA致A549细胞氧化损伤作用Fig.6 Oxidative effects of ACA on A549 cells
2.6 ACA致A549细胞内ATP合成减少
如图7所示,与正常组相比较,随ACA质量浓度的增加,细胞内ATP浓度明显减少(P<0.05,P<0.001),尤其ACA质量浓度为286 μg/mL时,ATP浓度接近为0。说明ACA诱导A549细胞凋亡作用,与其导致细胞能量代谢异常有关。

图7 ACA致A549细胞内ATP合成减少Fig.7 ACA decreases ATP levels in A549 cells
2.7 ACA致A549细胞线粒体膜电位(Δψ)崩溃
线粒体是真核细胞生物能量和代谢的中心,也是在细胞凋亡、信号转导中起关键调节作用的细胞器。不仅线粒体的原发性损伤可诱导细胞的凋亡性死亡和非凋亡性死亡,而且也参与其他信号通路诱发的凋亡进程,因此线粒体也被称为细胞死亡信号整合器(Death signal integrator)[14]。当凋亡信号通过内质网,受体释放Ca2+,并迅速移至线粒体,并被其膜上的钙蛋白摄取,促进线粒体通透性相变孔(Mitochondrial permeability transition pore,MPTP)的开放。研究证明:氧化、毒素或缺血和缺氧等病理因素所致的内源性细胞凋亡时,首先引起线粒体膜渗透性改变[15],细胞色素C释放到胞浆[16],线粒体膜上的氧化呼吸链电子传递中断,氧化磷酸化失偶联,导致ATP合成受阻,基质Ca2+外流,线粒体内膜两侧离子梯度消失,Δψ崩溃。Rh 123为膜电位敏感的亲脂性阳离子荧光染料,能选择性地在活细胞线粒体内聚集,发出黄绿色荧光,其强度可以间接反映线粒体膜电位(Δψ)的高低。
如图8所示,正常组细胞线粒体呈黄绿色,表明细胞线粒体膜完整。相较正常组,当ACA质量浓度达69 μg/mL时,出现线粒体肿胀,如图9所示,相对荧光强度明显下降(P<0.05)。随ACA质量浓度增加,细胞摄取Rh 123能力逐渐下降,相对荧光强度逐渐减弱(P<0.001),ACA质量浓度达286 μg/mL时线粒体形态已不可见。结果表明:ACA致A549细胞凋亡和致线粒体严重损伤,与MPTP开放导致Δψ崩溃有关;线粒体损伤,激活线粒体凋亡通路,是ACA诱导细胞凋亡的主要分子机制。图9中,与正常组相比较,*P<0.05,***P<0.001。

图8 Rh 123荧光染色(200倍)Fig.8 Fluorescence images of Rh 123 staining(×200)
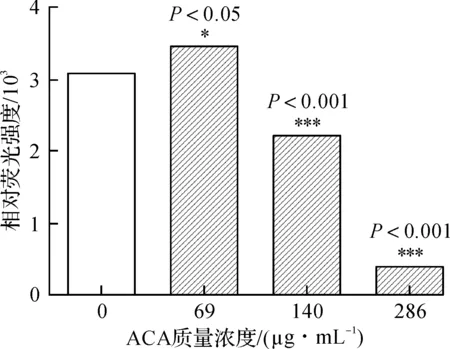
图9 ACA致A549细胞线粒体膜电位Δψ崩溃Fig.9 Stimulative effect of ACA on Δψ dissipation of A549 cells
3 结 论
实验主要研究ACA体外抗人肺腺癌细胞A549的作用及其机制。实验结果证明ACA对A549细胞有极强杀伤作用,呈良好的量-效和时-效依赖关系。相较临床上常用抗癌药DDP,ACA起效时间短,在高质量浓度下可100%杀死肺癌细胞,杀瘤效能强大,达到了研发抗癌药物希望的极致效果。通过光镜下观察细胞形态,Annexin V-EGFP/PI双重荧光染色观察均证明ACA通过诱导A549细胞凋亡产生抗癌作用。钙超载、氧化应激和能量代谢障碍是细胞凋亡的始发因素,这3种因素相互影响,互为因果。作用机制研究发现ACA致A549细胞发生Ca2+超载,氧化损伤,ATP合成受阻,能量代谢障碍。这3种因素合力,可以解释ACA强力杀瘤作用。能量代谢是线粒体的主要功能,氧化损伤的主要部位也是在线粒体。用罗丹明123检测线粒体膜电位(Δψ),发现ACA致线粒体膜电位崩溃,证明ACA作用主要靶细胞器是线粒体,通过致线粒体功能丧失,启动内源性凋亡通路致细胞凋亡。结果表明:ACA通过激活内源性凋亡通路,强力诱导细胞凋亡产生抗肺癌作用,在抗肺癌药物开发方面具有良好的前景。
