纤维二糖2-差向异构酶的酶学性质及在乳制品中的应用
2019-01-11肖雅琴陈秋铭沐万孟
方 正 , 肖雅琴 , 陈秋铭 , 张 涛 , 江 波 , 沐万孟 *
(1.食品科学与技术国家重点实验室,江南大学,江苏 无锡 214122;2.江南大学 食品安全国际合作联合实验室,江苏 无锡 214122)
糖类广泛存在于自然界中,具有广谱化学结构和生物功能。它不仅是营养物质,而且某些还具有特殊的生理活性。它们之间可以通过各种类型的酶促反应相互转化或合成,如氧化、还原、乙酰化、异构化和差向异构化等反应。异构化反应是指在相对分子质量不变的情况下改变化合物的结构。在此基础上,差向异构化则要求化合物含有两个或两个以上手性中心,差向异构酶可以将某手性中心的构型转换成其相反构型,形成的两种非对映异构体,称为差向异构体。
随着生活水平的提高,全球肥胖人口在过去40年中急速增长。主要原因之一就是饮食中高摄入量的蔗糖和果糖等高热量的糖类。在这种社会条件下,不可消化的糖类则具有特别显著的优势。在食品工业中,它们可以作为甜味剂,在满足人们对甜味需求的同时,降低热量的摄入以及减少龋齿的发生。有的还表现出对人体有益的生物活性,如具有益生元、抗肿瘤以及免疫抑制剂的效果[1]。还有一类甜味剂如阿斯巴甜、安赛蜜等,虽然热量低,甜味强烈,但是对人体无益,甚至有害人体健康。而大多数这类非营养型的甜味剂只能通过化学合成得到,而化学合成过程还可能因为化学试剂引发重大安全问题。有营养的功能性糖则可以通过微生物转化得到,更安全、方便、节约能源且对环境的污染更小。在这一过程中,差向异构酶则发挥着非常重要的作用,参与着糖类的代谢和转化。
日本香川大学教授Izumori[2]提出了一种名为“Izumoring”系统的生物制备策略,认为理论上所有单糖或糖醇都可以从某种单糖通过生物合成或转化得到。通过这种策略,可以将丰富廉价的自然资源合成罕见且昂贵的稀有糖。与单糖相比,天然存在的来源丰富的二糖也可以发生类似的酶促反应而得到具有特殊功能的稀有二糖。由于一些具有生物活性的二糖在食品工业中作为功能性甜味剂有着广阔的应用前景,一种被称为纤维二糖2-差向异构酶(CE,EC 5.1.3.11)的二糖差向异构酶引起科研工作者们的关注[3]。大量的研究表明纤维二糖2-差向异构酶可以将某些由β-1,4糖苷键的寡糖经差向异构化反应转化为依匹乳糖,部分则可催化异构化反应生成乳果糖,而这两种乳糖衍生物都是符合当今时代的健康饮食观念,具有很大的市场发展前景的功能性稀有糖。本文着重从工业应用角度总结纤维二糖2-差向异构酶酶促反应的最新进展。
1 纤维二糖2-差向异构酶的酶学性质
1.1 纤维二糖2-差向异构酶的生物分布及特性
1967年,Tyler和Leatherwood[4]在一种厌氧瘤胃细菌白色瘤胃球菌中发现纤维二糖2-差向异构酶,因其能催化纤维二糖生成 4-O-β-D-吡喃葡萄糖基-D-甘露糖而得名。但是其真正进入人们的视野,开始对纤维二糖2-差向异构酶进行深入的研究是在40年后,Ito等测得来源于R.albus NE1的纤维二糖2-差向异构酶基因序列[5],并首次发现该酶能够催化乳糖生成依匹乳糖[6]。此后大量不同微生物来源的被证明具有纤维二糖2-差向异构酶活性的纤维二糖2-差向异构酶相继被克隆表达。2012年,Kim等发现来自Dictyoglomus turgidum的纤维二糖2-差向异构酶还可以将乳糖转化为乳果糖[7]。
纤维二糖2-差向异构酶属于N-乙酰-D-葡糖胺-2-差向异构酶(EC 5.1.3.8,AGEs)超家族,大多数纤维二糖2-差向异构酶与N-乙酰-D-葡糖胺2-差向异构酶氨基酸序列的同源性很低,且在已报道的纤维二糖2-差向异构酶中没有一个显示出有N-乙酰-D-葡糖胺-2-差向异构酶的活性。迄今为止,来自厚壁菌、网团菌、螺旋体、绿弯菌、变形菌和硬壁菌门,6个门的19个细菌的CE已经被异源表达和表征。为了适应工业化生产需求,研究每个酶的酶学性质,以面对不同底物,不同生产环境来选择最合适的酶是具有重要意义的,除了对基本的最适pH值、温度等的探究,纤维二糖2-差向异构酶的动力学参数也是依匹乳糖转化的重要参数。现将已报道的19种纤维二糖2-差向异构酶的研究结果整理如表1所示。其中只有来源于R.marinus和P.heparinus的纤维二糖2-差向异构酶的最适pH为弱酸性6.3。在食品工业中,弱酸性的条件更适用于工业生产。而不同纤维二糖2-差向异构酶的最适温度范围(35~80℃)则较广。
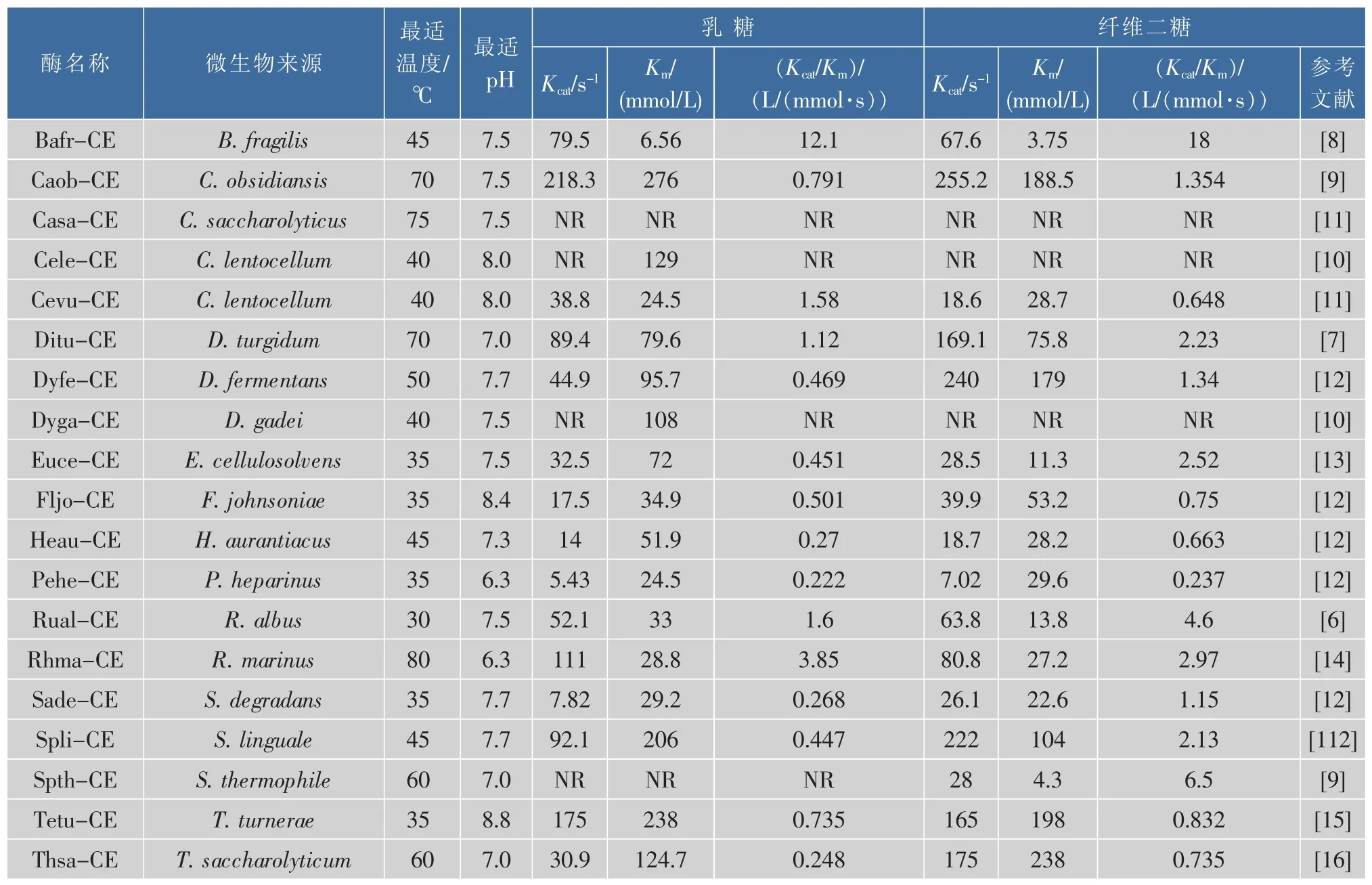
表1 已报道的纤维二糖差向异构酶的酶学性质比较Table 1 Comparison of enzyme properties of various Cellobiose 2-epimerase
1.2 纤维二糖2-差向异构酶的结构-催化活性关系
解析晶体结构对于预测催化机理是必需的,Rual-CE,Rhma-CE和Casa-CE的晶体结构已被解开,其基本支架是呈(α/α)6的桶状结构,该结构内外侧均为6个α螺旋组成的环状结构,且纤维二糖2-差向异构酶的结合口袋也位于这6个内部螺旋。在蛋白质结构分类数据库(SCOP)中,这是六发夹酶超家族和N-乙酰-D-葡糖胺-2-差向异构酶的特征,猜测该结构适用于催化含甘露糖残基的碳水化合物的差向异构化或异构化反应。
2013年,Fujiwara等[17]基于Rual-CE晶体结构,针对纤维二糖2-差向异构酶的差向异构化机制提出了涉及广义酸/碱催化剂和烯醇化中间产物的理论。一年后,该科研团队对Rhma-CE及其反应产物 4-O-β-D-吡喃葡萄糖基-D-甘露糖、依匹乳糖结合态的晶体结构进行了解析[18],并对催化机理进行了进一步分析,如图2所示。被广泛接受的是,催化反应可以被总结为以下3步:开环、差向异构化、闭环。在开环中,广义酸性催化剂向质子内环氧原子提供质子,而广义碱性催化剂从氧原子上夺取质子。在差向异构化过程中产生顺式烯二醇中间体,闭环过程可认为是开环的逆反应。
1.3 纤维二糖2-差向异构酶产物的测定
由于乳果糖和依匹乳糖难以分离。因此产物测定方法的提升对研究纤维二糖2-差向异构酶工作有重要意义。以前,科研工作者们主要通过离子交换色谱方法来完全分离和定量乳糖衍生物,通过改变洗脱液来改善分离效率,提高灵敏度。但依旧操作复杂,耗时久。近年来,对纤维二糖2-差向异构酶产物的定量测定主要由装备有折射率(RI)或蒸发光散射检测器的高效液相色谱法来检测,其优势在于检测速度快且灵敏度高,并且可用于分析复杂食品系统[19]及其酶促反应产物[10,20-21]。 2016年,Rentschler等[22]采用双重高效液相色谱法分析,使用两种色谱分离技术的组合,配置在两个并行系统中。柱前衍生后,可以在复杂的食物基质如牛奶中准确地分离乳糖,乳果糖和依匹乳糖。乳样中检测限依匹乳糖为3.3 mg/L,乳糖为4.7 mg/L,乳果糖为1.3 mg/L。此外,薄层色谱法也被广泛用作粗略的定性方法,以快速确定是否通过酶促或微生物反应产生了依匹乳糖。
2 纤维二糖2-差向异构酶生产功能性寡糖的应用
随着现代生物技术的发展,酶在食品和制药工业中的应用越来越广泛。目的性的酶促反应不仅可以增加食品的附加营养值,还可以减少资源浪费。乳糖的生物转化则是一个非常成功的案例。在乳制品工业中,全世界每年会产生上百万吨的乳糖无法利用。若不经处理就丢弃,不仅伴随着资源的浪费还会造成大量的环境问题。但是以乳糖为原料可以生产多种衍生物,用纤维二糖2-差向异构酶便可将乳糖经差向异构化或异构化反应转化为非常有营养价值的依匹乳糖和乳果糖,结构式如图1所示。最初人们在加热的牛奶和经碱性处理的乳糖溶液中发现了微量的依匹乳糖,由于难以制备,其生理功能一直不清楚。直到2004年,Miyasato等[23]报道了由β-半乳糖苷酶催化转糖基作用生产小于10 g规模的依匹乳糖。乳果糖最初也是在加热后的牛奶中找到的,不同的是,乳果糖在20世纪60年代,就已经大规模生产并且应用于制药行业。下文将对CE的这两种主要产物,以及CE在乳产品中的应用分别进行论述。
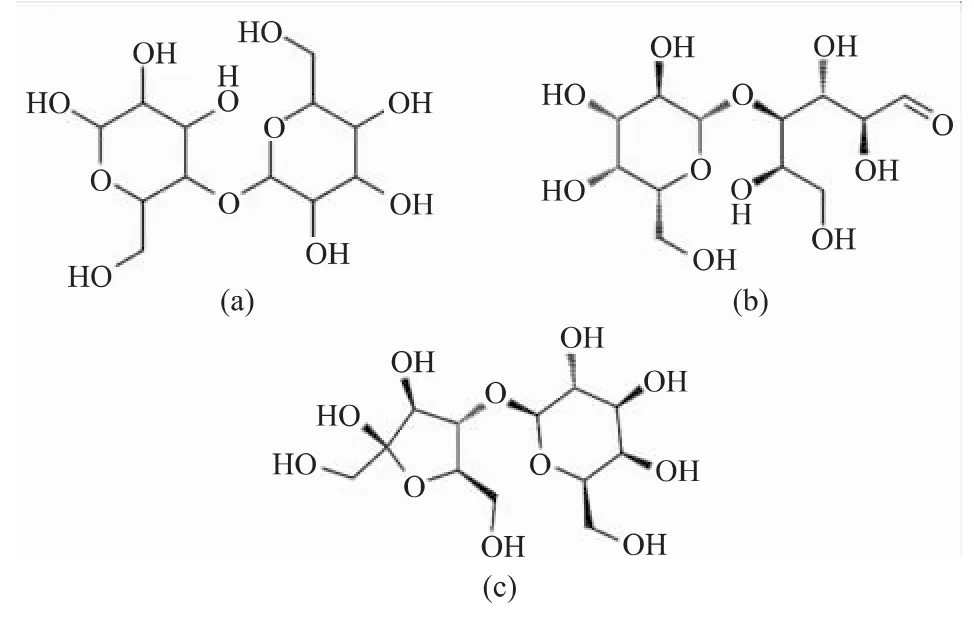
图1 乳糖、依匹乳糖、乳果糖结构式Fig.1 Molecular structure of lactose,lactose and lactulose
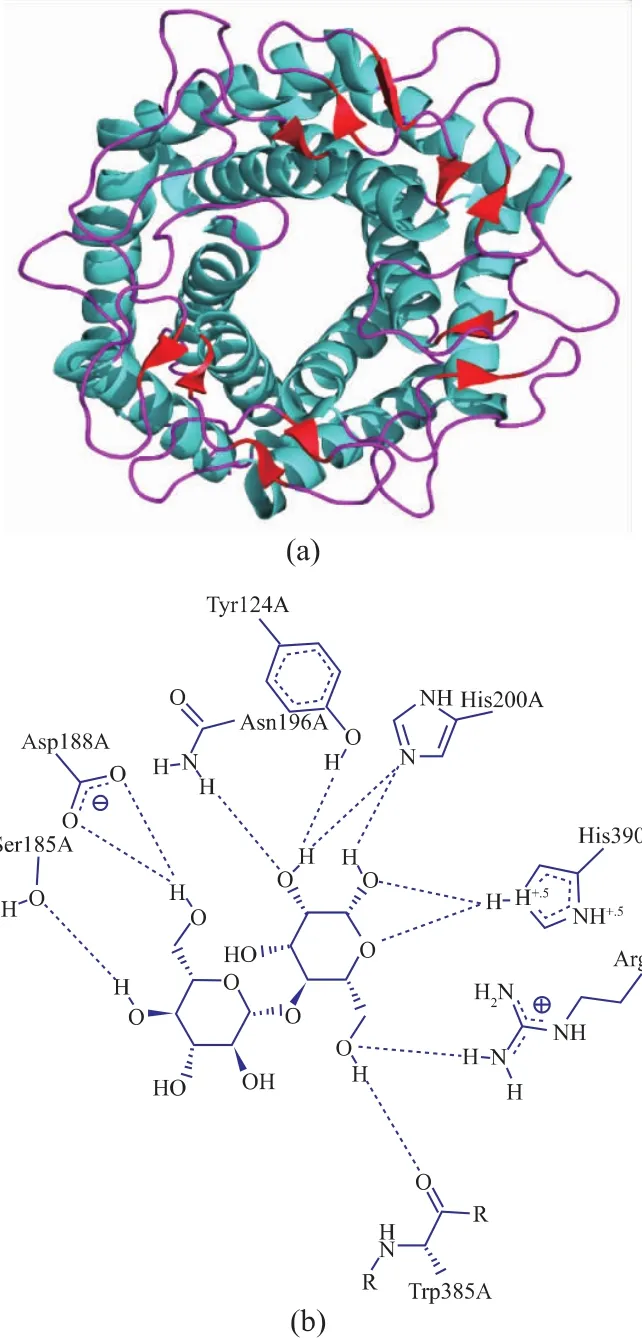
图2 Rhma-CE的蛋白分子结构和其与底物(依匹乳糖)结合情况示意图Fig.2 Molecular structure of protein Rhma-CE and its interaction with substrate(galactose)
2.1 依匹乳糖
2.1.1 依匹乳糖的生理功能 依匹乳糖(Epilactose:C12H22O11;4-O-β-D-吡喃半乳糖基-D-甘露糖)是乳糖的C2位的差向异构体,具有还原性。依匹乳糖不易被人体消化吸收[24],它在肠道消化酶中非常稳定,可以到达宿主的下胃肠道刺激双歧杆菌的生长[25],所以服用依匹乳糖后血浆内的血糖浓度不会升高。由于摄入依匹乳糖后矿物质吸收增强,可能是通过增殖的肠道细菌产生短链脂肪酸降低pH值而引起。Suzuki等[26]研究发现依匹乳糖通过诱导肌球蛋白轻链的磷酸化反应促进钙运输的细胞途径来增强钙吸收。使大鼠实验中胃切除术后骨量流失的症状以及贫血症得到改善[27],这表明依匹乳糖可能成为预防骨质疏松和贫血的优质功能食品。小鼠口服还能够抑制初级胆汁酸向次级胆汁酸的转化,降低患结肠癌的风险。依匹乳糖的摄入还能增加盲肠壁的重量,提升短链脂肪酸和其他有机酸的含量,降低血浆中总胆固醇和低密度脂蛋白胆固醇含量,从而降低动脉硬化的发病率[28]。依匹乳糖还可以有效地预防高脂饮食诱导的小鼠肥胖[29],口服依匹乳糖可以增加解偶联蛋白1的表达,解偶联蛋白1在骨骼肌和棕色脂肪组织中参与能量耗散的表达,从而导致全身能量消耗增加,减少小鼠肥胖及代谢障碍的危险。综上,依匹乳糖具有预防结肠癌、动脉硬化、肥胖及其相关疾病的潜力,而这些慢性病被认为是中发达国家的主要健康问题。
2.1.2 依匹乳糖的合成 有报道采用化学方法通过乳糖差向异构化产生依匹乳糖,或者经D-甘露糖和D-半乳糖合成依匹乳糖[30]。但这些化学方法步骤繁多且复杂,反应涉及的有机试剂还可能会引发重大人身及食品安全问题。有机化学反应副产物较多,纯化较困难、工作量大。而酶法催化生成依匹乳糖,因其操作简单、安全高效、方便环保受到了学者们的广泛关注。
使用单一催化剂纤维二糖2-差向异构酶,不需要其他底物就可从乳糖一步转化为依匹乳糖。当反应中酶浓度较低,反应时间较短时,反应体系中基本检测不到副产物[16]。Saburi等使用固定在阴离子交换树脂上的Rhma-CE连续反应[31],有效地减少了反应所需酶量。在该反应中,大约30%的乳糖被转化为依匹乳糖,通过乳糖结晶,水解剩余乳糖,消化单糖以及阳离子交换层析纯化依匹乳糖至纯度为91.1%,回收率为42.5%。2016年,Kuschel团队研发了一种半制备型高效液相色谱方法[32],由fljo-CE催化乳糖大量生产依匹乳糖,经结晶和色析法分离后,获得高纯度(99%)产品,总产量为51%。2018年,Chen等[33]报道了一条食品级的从乳糖酶法生产并纯化依匹乳糖的路线。利用不使用抗生素对转化子进行筛选的枯草芽孢杆菌表达CE,排除了抗生素基因的不安全因素的情况下生产依匹乳糖,并分3步将产物纯化至纯度大于98%。
2.2 乳果糖
2.2.1 乳果糖的生理功能 乳果糖(lactulose:C12H22O11;4-O-β-D-吡喃半乳糖基-D-果糖)是半乳糖和果糖通过β-1,4糖苷键结合得到具有还原性的双糖,也是乳糖的酮糖异构体。乳果糖稳定性好、热值低,为6.28 kJ/g。
与依匹乳糖相类似,乳果糖不会被人体的肠道消化,留存在肠道中的乳果糖能刺激肠道的蠕动,并为肠道中的乳杆菌和双歧杆菌提供能量[34-35],有助于维持或恢复人体小肠中菌群的自然平衡[36]。口服乳果糖还可以刺激机体免疫系统分泌免疫球蛋白A[37],增加肠道局部免疫力,同时乳果糖被发酵分解为乳酸、甲酸等小分子有机酸,使肠道的pH降低,抑制有害菌的生长代谢,保持水分,有防止便秘的功能。相对于其他功能性低聚糖主要应用于保健食品,乳果糖被大量应用于医药方面的研究。肝性脑病是与严重发病率和死亡率相关的急性和慢性肝病的严重并发症,国内外许多科研工作者通过随机试验分析表明乳果糖对肝性脑病表现和预防肝性脑病发作具有有益作用[38-39]。
2.2.2 乳果糖的合成 目前,用于商业利用的乳果糖主要通过化学方法生产[40]。由于化学方法生产过程包括复杂的纯化和脱盐步骤,而使用生物催化剂的环境友好型合成方法优于常规的化学反应。所以科研工作者们一直在积极探索,想要通过酶促生物转化的方式大量生产乳果糖,同时降低生产成本。
据报道,糖基水解酶和纤维二糖2-差向异构酶是目前所知能够催化合成乳果糖的两类酶。纤维二糖2-差向异构酶可直接将乳糖还原性末端的葡萄糖基异构化为果糖基,实现乳糖向乳果糖的直接转化。2012年,Kim等将来自嗜糖假单胞菌的纤维二糖2-差向异构酶的异构化活性用于高效酶促生产乳果糖[41]。一年后,该团队在硼酸盐存在下的乳糖溶液中使用Casa-CE产生乳果糖[42],转化率提升至88%,是通过化学或生物合成所实现的最高水平。然而,从反应产物中除去硼酸盐是困难且昂贵的。加入硼酸盐还会导致环境污染和安全问题,这就失去了生物法的优点。而在没有硼酸的条件下,2016年,Shen等经过四轮随机诱变和筛选[43],获得最佳突变体G4-C5,乳果糖产量增加至约76%。由于生产乳果糖温度较高,以前认为来自于嗜热微生物的纤维二糖2-差向异构酶才能应用于乳果糖的生产,2017年,Kuschel等发现来自于嗜温微生物的纤维二糖2-差向异构酶也可以发生异构化反应生成乳果糖[44],这可能意味着所有的纤维二糖2-差向异构酶都有异构化活性,只是活力的高低有区别而已。
2.3 纤维二糖2-差向异构酶在乳制品中的应用
随着对乳糖衍生物中功能性稀有糖的研究与开发,近年来,研究工作集中于在工业相关温度下直接在原料乳中生产所需要的乳糖衍生物,为特定的乳制品引入附加价值。与乳糖相比,其功能性衍生物具有更高的价值,不仅可以避免部分人群对乳糖的不耐受,还可以在食用乳制品的同时摄取到具有功能性的乳糖衍生物,同时也减少了从原乳中提取乳糖的步骤。此举不仅可以产生具有益生元特性的富含功能性乳糖衍生物的乳制品或益生元产品制剂,还可以扩大功能性食品范围,提供了将乳清或乳清渗透物等副产物转化为有价值的益生元产品的机会,提高副产品乳清的价值。根据制作工艺的不同,获得含有不同乳糖衍生物的乳制品,从而让有不同需求的人们有选择性地购买。
将纤维二糖2-差向异构酶运用到乳制品的生产工业中有两个关键问题需要解决,首先是安全问题,使用食品级菌生产的CE能消除致病菌所产生的安全隐患,且使用过程中不需要添加抗生素,能避免抗生素的滥用,作者利用营养缺陷型枯草芽孢杆菌宿主构建了生产CE的食品级工程菌,能够安全进行CE的生产,使其能够直接应用于乳制品的乳糖转化[33,45]。
第二个关键问题在于乳品的保质期较短,并且成分复杂,想要快速,便捷,减少副产物的生成来获得目的乳糖衍生物,就需要寻找在低温下有高效酶活的纤维二糖2-差向异构酶。乳制品的工业生产一般在8℃低温下进行以避免其他微生物污染或化学副反应的发生。而在此低温下大多数酶的活性一般较低,直接导致生产效率低下。2014年,Krewinkel等[46]发现来自2种嗜温微生物,约氏黄杆菌和肝素杆菌的纤维二糖2-差向异构酶,这两种酶在低温下都具有相当的活性,能够在复杂的牛奶系统中将乳糖转化成依匹乳糖,且没有检测到其他副产物的生成。该团队在2015年[47]将来自无色单胞菌的CE在12 L的搅拌罐反应器中生产并使用自动系统对酶进行纯化。以此规模的酶的生产和纯化来表明,纤维二糖2-差向异构酶生产的升级,及其在食品工业中应用的可能性。酶促反应在原料乳中的应用可能导致其被整合到乳制品的加工中,而在该过程结束后,通过超高温短时灭菌的处理使纤维二糖2-差向异构酶失活,同时这也是工业上乳制品灭菌必须要经过的步骤。同样在2015年,Rentschler等人[15]从一种嗜热纤维素分解菌中分离得到的纤维二糖2-差向异构酶首次在工业相关温度下直接在牛奶中产生乳果糖。每升牛奶中最多可产生28.0 g的乳果糖。通常酶的稳定性与其在低温下的酶活成反相关,酶的稳定性越好,柔韧性就更弱,在低温下与底物结合能力也越弱。因此为了提升纤维二糖2-差向异构酶在低温下的酶活,就应当结合蛋白结构的信息,对酶的某些氨基酸残基进行分子改造,以提升蛋白质的柔韧性。这种分子改造策略与寻找耐高温酶的策略相反,目前还没有人进行此类的报道,需要未来进行更多的尝试。
3 展望
功能性糖的兴起将减少高热值的甜味化合物如蔗糖的使用,减少了患糖尿病等疾病的风险。也符合现在低卡路里和低糖的生活观念。对纤维二糖2-差向异构酶催化反应的研究为合成乳糖衍生物提供了新的方向。酶促反应没有额外的底物,也没有冗长的步骤,纯化简单,高效环保。酶促反应生产将成为未来功能性食品原料生产的主要趋势。酶工程技术是发现新酶及提高酶学性质最有力的工具。当前纤维二糖2-差向异构酶的结构和突变实验还比较少,随着未来通过进一步的实验,全面了解纤维二糖2-差向异构酶的结构-功能关系和酶促催化机理,相信乳糖衍生物行业面貌将焕然一新。
