阿尔茨海默病标志物的探索:外周血淋巴细胞G1/S调控点功能障碍
2019-01-11周小英张微微高旭光
周小英, 张微微, 刘 扬, 高旭光
阿尔茨海默病(Alzheimer’s disease,AD)是以进行性全面认知功能障碍和行为损害为特征的中枢神经系统退行性病变。“神经退行性变-细胞周期”假说认为[1],AD脑神经元细胞周期调控异常发生于一个重要的细胞周期调控点:G1/S调控点,即异常进入细胞循环的神经元G1→S调控障碍。有报道[2],AD病程中细胞周期调控失败不仅局限于脑神经元,外周组织(如外周血淋巴细胞)亦有神经元细胞周期调控异常相关的表现。目前还没有AD简易有效的诊断标志物[3],这也是人们一直研究的热点与难点。
AD外周血细胞周期方面的研究很少,国内AD G1/S调控点功能的研究仅检索到一篇,出自本作者团队[4]。AD外周组织G1/S调控点的报道更少,国外仅检索到若干篇,其中一篇出自本作者团队[5]。我们前期研究发现[4,5]:AD者淋巴细胞G1/S调控点功能发生障碍,这可能是中枢神经系统神经元细胞周期调控异常在外周血淋巴细胞中的反应之一。本研究在前期基础上,除正常者外,另增设了血管性痴呆(vascular dementia,VaD)者以及其他神经系统变性病伴发的痴呆:帕金森病/帕金森叠加综合征(Parkinson’s disease/Parkinsonism-Plus syndrome,PD/PPS)者为对照组,对比各组G1/S调控点功能的差异情况,发现AD外周血淋巴细胞G1/S调控点功能障碍可能为AD所特有,这有望成为AD新的血液标志物。该项标志物的探索,不仅有助于我们更深入地理解AD的发病机制,还将对AD诊断准确性的提高及其新的治疗靶点的开创提供思路,可能具有广阔的临床应用前景。
1 资料与方法
1.1 研究对象 2011年6月-2016年6月于北京大学人民医院神经内科收集:AD者18例、VaD者14例、PD/PPS者12例,正常者18例。利用简易精神状态量表(MMSE)评价各组认知功能。全部研究对象通过北京大学人民医院伦理委员会批准,全部研究对象或其监护人已签署知情同意书。实验组:AD组(18例):男女比例为10∶8,年龄69~82岁,采用NINCDS-ADRDA(美国国立神经病、语言机能紊乱和卒中研究所及阿尔茨海默病和相关疾病协会)临床诊断标准,把诊断为“很可能AD”者列为AD组,MMSE≤23分。对照组:正常组(18例):男女比例为10∶8,年龄63~81岁,经临床检查和认知评估正常,确定为健康者。家族中均无痴呆患者。年龄、职业及教育程度等与实验组基本一致的正常人列为正常组。MMSE≥27分。排除全身系统性疾病,排除精神系统疾病,排除手术、外伤史。VaD组(14例):男女比例为9∶5,年龄68~88岁,采用NINDS-AIREN(美国国立精神病与卒中研究所/瑞士神经科学研究国际协会)诊断标准,将诊断为“很可能VaD”者列为VaD组,MMSE≤23分。PD/PPS组(12例):男女比例为7∶5,年龄67~79岁,PD诊断按照“2006版中国帕金森病诊断标准”;对有帕金森样症状、痴呆表现的其他神经系统变性疾病者列为PPS者,PD、PPS二者统一为PD/PDS组,MMSE≤23分。
1.2 研究方法 各组研究对象抽血5 ml于肝素抗凝管内,分离各组外周血淋巴细胞;于含青、链霉素的PRM1640培养液,37 ℃孵育,选择对数生长细胞做实验用。加入植物凝集素(促使细胞进入细胞循环),使其终浓度为10 ng/ml,37 ℃孵育24 h;而后加入雷帕霉素(特异性阻滞细胞由G1期向S期转换),使其终浓度为100 ng/ml,37 ℃继续孵育24 h(标记为T48期细胞)。细胞依次经洗涤、固定、RNA酶消化、DNA染色,Becton-Dickinson流式细胞分析仪分析,记录20,000个细胞事件。 采用Mod Fit LT 3.0与Multicycle计算机软件分析细胞周期。计算出在细胞周期不同阶段的细胞百分比,即细胞周期分布情况。细胞周期分布中的G1%=G0%+G1%,G2%=G2%+M%,所以用G1%、S%、G2%分别表示各时相。
1.3 统计学分析 根据不同的可能影响因素对各组结果进行分析。两组间结果的比较采用t检验,多组间比较采用单因素方差分析one-way ANOVA,若多组比较后总体差异有统计学意义,则进一步采用LSD、SNK或者Dunnett T3方法进行两两比较。使用SPSS 19.0软件,P<0.05认为组间有统计学差异。
2 结 果
2.1 病例一般资料比较 4组病例“年龄”总体差别无统计学意义(P>0.05);AD组、VaD组、PD/PPS组“发病年龄”总体差别无统计学意义(P>0.05);正常组MMSE评分高于VaD组(P<0.01)、PD/PPS组(P<0.01)和AD组(P<0.01),而VaD组、PD/PPS组、AD组间MMSE评分差别无统计学意义(P>0.05)(见表1)。
2.2 流式细胞仪检测细胞周期分布比较 AD组T48细胞G1%低于正常组(P<0.01)、VaD组(P<0.01)、PD/PPS组(P<0.01),而3组对照组间对比差异无统计学意义(P>0.05)。AD组T48细胞S%高于正常组(P<0.01)、VaD组(P<0.01)、PD/PPS组(P<0.01),而3组对照组间S%差异无统计学意义(P>0.05)。AD组T48细胞G2%高于VaD组(P<0.01)、PD/PPS组(P<0.01),AD组T48细胞G2%与正常组间差异无统计学意义(P>0.05)(见表2)。

表1 各组一般资料比较
与VaD组、PD/PPS组、AD组相比*P<0.01
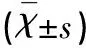
表2 各组T48细胞周期时相分布比较
与AD组相比*P<0.01
3 讨 论
细胞周期分为4个阶段:G1期(DNA合成前期)、S期(DNA合成期)、G2期(DNA合成后期)和M期(有丝分裂期)。为确保遗传信息的准确传递,细胞在长期的进化过程中逐渐形成了一整套细胞周期监督机制,称为细胞周期“调控点”(Cell Cycle Checkpoints)[6]。一些突发事件引发的细胞反应能影响驱动细胞周期前进的因子,从而使细胞周期停滞于调控点,以消除所受到的不利影响,这被称为细胞周期阻滞(Cell Cycle Arrest)[7]。作为体内细胞应激反应关键检测装备的细胞周期“调控点”又称为细胞周期“关卡”,是控制细胞增殖周期的限速位点,其功能是在DNA复制和有丝分裂前确定DNA合成的完整性,保证各个细胞周期事件的启动、完成与忠实地按序进行。细胞对DNA损伤作用的反应是激活细胞周期调控点。至少有两个调控点监测细胞DNA损伤:G1/S调控点(决定G1期向S期的转换)和G2/M调控点(决定G2期向M期的转换),其中以“G1/S调控点”最为关键[8,9],当细胞受到损害时,细胞便被G1/S期调控点阻滞于G1期,待基因组被修复完整后重返进入S期,若不能修复,则触发细胞进入程序性死亡。
已证实,AD脑神经元细胞周期调控异常发生于G1/S调控点[10,11],即异常进入细胞周期的神经元G1→S调控障碍,且该调控点功能异常可能是迄今发现的AD脑神经元最早期的病理改变[12]。AD中细胞DNA受损后,其G1/S调控点的功能不仅不能被激活,反而失去了本来的固有功能,使受损细胞不能停滞于G1期进行DNA修复,而是进入G2/M期,但是细胞不能进行正常的分裂,所以最终走向死亡。因此,可将AD的发展归纳为两阶段:首先是细胞周期调控障碍(G1/S调节失败,细胞周期进展),接着是DNA复制,细胞发生两种结局:经过凋亡程序死亡或存活并产生AD型病理改变,即AD的发生是从G1期→S期→G2期→细胞死亡形成的途径[13]。AD的病理形成是两个阶段过程,给AD的诊断及治疗带来了机会,G1/S调节失败在AD的发展中具有独特性,并可预测AD的发生和进展。
本研究首先用植物凝集素活化处于静止期(G0期)的淋巴细胞使其进入细胞循环,再进行雷帕霉素(细胞周期抑制剂,特异性阻止细胞由G1期向S期的转化,使细胞停滞于G1期)干预后应用流式细胞技术检测其细胞周期时相分布情况。发现:(1)正常组、VaD组、PD/PPS组间细胞周期时相分布无差异,说明雷帕霉素于3组对照组细胞中所发挥出的G1期向S期转换的阻滞效应大致相同,可以认为其G1/S调控点功能受损情况基本一致;(2)AD组G1%低于正常组、VaD组、PD/PPS组,表明:与AD组相比,雷帕霉素于对照组细胞中发挥出了更显著的G1期向S期转换的阻滞效应,说明AD组细胞对雷帕霉素的反应较对照组不敏感,从而经雷帕霉素处理的AD组细胞呈现出较对照组不明显的G1期停滞现象,提示:AD组淋巴细胞G1期至S期转换过程调控异常,即G1/S调控点功能障碍(不能行使其阻滞细胞于G1期的正常功能)导致,尽管在雷帕霉素作用下,AD组细胞仍不能停滞于G1期而是进入到细胞循环G2期。
本研究结果提示,外周血淋巴细胞周期G1/S调控点功能障碍可能为AD所特有,该指标有望成为早期诊断AD的一个血液标志物,但关于该方面的研究还远远不够,该标志物的准确性、特异性均需进一步验证。常见类型痴呆除AD外,还有血管性痴呆、神经系统变性病伴发痴呆等其他类型痴呆,故本研究在前期基础上除设立正常组为对照组外,还加设血管性痴呆者、帕金森病/帕金森叠加综合征伴发痴呆者为对照组,进一步对比AD与其他类型痴呆外周血淋巴细胞G1/S调控点功能障碍的差异情况,使AD诊断血液标志物的探索更有说服力。但AD分散发型AD及家族型AD,但绝大多数病例为散发型。本研究入选AD病例未能区分是散发型还是家族型,二者细胞周期调控点功能是否有差异,不得而知,这也是我们今后研究的计划内容之一。
本研究也将为AD提供新的治疗靶点,如可发展G1期向S期转换的阻断剂来治疗AD,这与以往的研究结果一致。促进细胞周期进程的药物可加速AD脑神经元死亡[14],而抑制细胞周期因子或阻滞细胞周期进程的药物可保护AD脑神经元免于死亡[15]。目前,虽然尚缺乏有效药物阻止疾病进展,但进入细胞周期的神经元由G1期向S期转换的阻断将给AD的治疗带来曙光。
