USP13抑制溶瘤病毒诱导的肝癌细胞凋亡机制
2019-01-10朱海珍黄湘王静静许艳陈瑾文王鑫涛
朱海珍 黄湘 王静静 许艳 陈瑾文 王鑫涛


摘 要:新城疫病毒(Newcastle Disease Virus,NDV)是一种复制能力较强且特异性识别并杀伤肿瘤细胞的禽类病毒. 肝癌细胞被NDV感染后,会特异性激活肝癌细胞中的凋亡信号通路,诱导肝癌细胞发生凋亡. USP13(Ubiquitin Specific Protease 13)是去泛素化酶家族的一员,能够去泛素化和稳定PTEN分子. 在Huh7和HLCZ01这两种肝癌细胞中感染NDV时,USP13的表达水平均明显降低. 在NDV感染的Huh7和HLCZ01细胞中过表达USP13,细胞凋亡均明显受到抑制. 反之,敲低细胞中USP13的水平,细胞凋亡明显得到增强. 进一步揭示了USP13抑制NDV诱导肝癌细胞凋亡的机制,在两种肝癌细胞中过表达USP13虽然不影响细胞中NDV的复制,但发现USP13能够上调凋亡信号通路中的一个重要分子Bcl-2,进而抑制肝癌细胞的凋亡. USP13在NDV诱导的肝癌细胞凋亡中发挥着重要的作用,同时为肝癌的溶瘤病毒治疗提供了一个新的理论依据.
关键词:USP13;NDV;肝癌;凋亡;c-PARP;Bcl-2;细胞;酶
中图分类号:Q71 文献标志码:A
USP13 Restrains Apoptosis of Liver Cancer Cells Induced by NDV
ZHU Haizhen1,2,3?,HUANG Xiang1,2,3,WANG Jingjing1,2,3,XU Yan1,2,3,
CHEN Jinwen1,2,3,WANG Xintao1,2,3
(1. College of Biology,Hunan University,Changsha 410082,China;
2. Institute of Pathogen Biology and Immunology,Hunan University,Changsha 410082,China;
3. State Key Laboratory of Chemo/Biosensing and Chemometrics,Hunan University,Changsha 410082,China)
Abstract: Newcastle Disease Virus is an avian virus with strong replication ability,which can specifically identify and kill tumor cells. When liver cancer cells are infected with NDV,the apoptosis signaling pathway is activated,inducing apoptosis. USP13 (Ubiquitin Specific Protease 13) is a member of the ubiquitination enzyme family,and deubiquitylate and stabilize PTEN. The expression of USP13 is obviously decreased when NDV infected Huh7 or HLCZ01 cells. USP13 is overexpressed in NDV-infected Huh7 or HLCZ01 cells,which significantly restrains apoptosis. Conversely,knockdown USP13 significantly enhances apoptosis. Further studies revealed the underlying mechanism that USP13 restrains NDV-induced apoptosis. Although overexpression of USP13 doesn't affect NDV replication in two types of liver cancer cells,USP13 can upregulate an important molecule Bcl-2,thereby inhibiting apoptosis. USP13 plays an important role in NDV-induced apoptosis. At the same time,a new theory basis for the oncolytic treatment of liver cancer is provided.
Key words: USP13;NDV;HCC;apoptosis;c-PARP;Bcl-2;cell;enzyme
肝癌是世界上较为常见的恶性肿瘤之一. 该肿瘤具有恶性程度较高,病情发展快,预后性较差等特点[1].目前肝癌的传统治疗方法主要以手术切除为主,结合放射治疗、化学药物治疗等方法进行综合治疗. 总体治疗效果不尽如人意. 临床上使用的化学治疗、放射治疗等治疗方法,除对患者的肿瘤细胞具有杀伤作用外,也会对正常细胞带来较大伤害,所以亟需寻找一种特异性高且副作用低的肝癌治疗方法[2].
溶瘤病毒发现于20世纪后期,一位女性宫颈癌病人在接种狂犬疫苗后,她体内肿瘤的生长竟“神奇地”受到抑制,科学家意识到某些溶瘤病毒可以杀伤肿瘤细胞. 随着生物技术的快速发展,科学家们可以修饰并且改造溶瘤病毒,使其具有特异性杀伤肿瘤的能力. 目前,溶瘤病毒治疗肿瘤已成为较有发展潜力的治疗方法之一,为癌症病人带来巨大的希望[3].
NDV属于副黏病毒科禽腮腺炎病毒属,它被发现于英国新城,因此命名为新城疫病毒,它的基因组是单股、负链的RNA. NDV能够感染禽类,在禽类中有很高的致病性,对禽类具有较大的杀伤力. 但是感染人的情况很少,即使感染人也不会传染给其他人,只是轻微地出现一些炎症反应等,可通过人体的免疫调节功能而自行消失. 经过诸多实验验证,NDV能够特异性杀伤很多类型的肿瘤细胞,并且对正常细胞没有较大影响. 同时在细胞感染NDV时,会产生许多细胞因子,如干扰素、肿瘤坏死因子等,这些细胞因子激活免疫系统中的T淋巴细胞,最后杀伤肿瘤细胞[4]. 由于NDV具有这些特性,它成为抗肿瘤溶瘤病毒当中研究较多的病毒之一.
据报道,NDV感染肿瘤细胞并杀伤肿瘤细胞是通过激活细胞内的凋亡信号通路,从而诱导肿瘤细胞发生凋亡. 细胞凋亡一般可分为外源性凋亡途径和内源性凋亡途径. 外源性凋亡途径又被称为死亡受体凋亡途径,当外源性凋亡信号通路被激活时,死亡配体结合膜上的死亡受体,死亡受体得到激活,死亡受体与信号通路中的转导分子FADD结合激活下游的Caspase8,从而级联激活下游的凋亡执行者Caspase3、Caspase6和Caspase7. Caspase家族中的凋亡执行者以聚ADP核糖聚合酶(PARP)为底物,把PARP切割成89 kD和24 kD两个分子蛋白,而被切割的PARP(cleaved-PARP)无法对损伤的DNA进行修复,最后导致细胞发生凋亡. 内源性凋亡途径又被称为线粒体凋亡途径,是脊椎动物细胞发生凋亡的主要途径之一. 当内部凋亡刺激因子刺激细胞,如DNA损伤、细胞低氧、癌基因活化等,線粒体凋亡信号通路就会被激活,线粒体膜通透性发生改变,致使线粒体内的细胞色素(Cytochrome C)被释放出来,最后细胞色素C、凋亡蛋白酶活因子-1和Caspase9形成一个凋亡小体. 该凋亡小体可以活化下游的Caspase3、Caspase7,最终使细胞发生凋亡[5].
在本文研究中,用NDV分别感染Huh7和HLCZ01两种肝癌细胞,发现去泛素化酶USP13的mRNA水平、蛋白水平都明显降低. 同时在两种肝癌细胞中过表达USP13,发现能够抑制NDV诱导的肝癌细胞凋亡. 反之,沉默USP13可以增强NDV诱导肝癌细胞的凋亡. 经过研究,发现USP13不影响NDV的复制,但是能够上调凋亡信号通路中的重要分子Bcl-2,进而抑制细胞凋亡,这也初步揭露了USP13抑制NDV诱导的肝癌细胞凋亡机制.
1 材料与方法
1.1 细胞系
Huh7细胞购买于美国模式培养物集存库 (ATCC). HLCZ01细胞是一种新型的肝癌细胞系[6],从湖南省肿瘤医院临床病人肝组织中分离并纯化培养. 293T细胞购买于博士德生物公司. 所有细胞均在CO2浓度为5%的37 ℃恒温细胞培养箱中培养.
1.2 实验材料
DMEM培养基底液和DMEM/F-12培养基底液,胎牛血清(FBS),地塞米松,ITS,青霉素和链霉素,左旋谷氨酰胺,非必须氨基酸,胰蛋白酶,1×PBS,TRIzol试剂,异丙醇,氯仿,DEPC水,逆转录试剂盒,SYBR定量PCR试剂盒,RIPA 细胞裂解液,蛋白酶抑制剂,BCA试剂盒,胶回收试剂盒,内切酶,T4连接酶,LB培养基,氨苄,质粒提取试剂盒,30%聚丙酰胺,10%APS,Flag、USP13、PARP、Bcl-2、β-actin、羊抗兔二抗、羊抗鼠二抗等抗体,1×TBS,吐温,化学发光显影液,新城疫病毒(NDV).
六孔细胞培养板,微量移液枪枪头,十二孔细胞培养板,1.5 mL离心管,15 mL离心管,10 cm细胞培养盘,RT-PCR八联管,滤纸,PVDF膜.
1.3 实验仪器
-80 ℃超低温冰箱,-20 ℃冰箱,4 ℃冰箱,4 ℃低温高速离心机,冷冻离心机,CO2恒温细胞培养箱,电动移液枪,水浴锅,超净工作台,超净生物安全柜,微量移液枪,细胞计数仪,细菌培养箱,倒置光学显微镜,细胞计数板,电泳槽,分光光度计,分析天平,超纯水仪,实时荧光定量PCR仪,电泳仪,PCR仪,凝胶成像仪器,化学发光成像仪器.
1.4 实验方法
1.4.1 构建质粒
为了构建USP13过表达质粒,首先在NCBI上找到相对应的编码区,再设计前后引物. 提取HLCZ01细胞中的总RNA,并以其逆转录产物cDNA为模板,优化PCR条件,扩增USP13目的基因. 接着进行琼脂糖凝胶电泳,根据核酸maker判断其条带大小是否正确. 然后进行胶回收PCR产物,分别双酶切PCR产物和p3×FLAG-CMV-vector 2 h,再进行琼脂糖凝胶电泳,胶回收纯化,确定目的基因和载体比例加入T4连接酶,在16 ℃连接12~16 h,用感受态大肠杆菌(DH5α)进行转化实验. 转化成功后,挑取单克隆菌落在LB培养基中进行摇菌扩大培养,最后用质粒提取试剂盒提取菌内的质粒. 提取的质粒经过双酶切鉴定,显示连接片段大小正确无误. 把质粒送去测序公司测序,测序公司返回测序序列. 经过软件比对,扩增的目的基因序列与USP13一致,并且无突变. 把该质粒转染进293T细胞,通过western blot检测该质粒表达成功.
为了构建USP13沉默质粒,首先在相关网站上得到USP13的沉默靶序列,再根据沉默载体说明书设计Top链和Bottom链,然后把这两条引物链退火结合后与pRNAT-U6载体连接,得到Sh-USP13沉默质粒,最后送去测序公司测序. 测序结果鉴定插入的序列是正确的. PCR克隆引物和沉默USP13质粒靶序列如表1、表2所示.
1.4.2 Real-time RCR实验
首先用PBS把铺在细胞培养板上的细胞洗一遍,之后加入TRIzol试剂把细胞吹打下来,吸到1.5 mL的离心管中,根据试剂说明书提细胞总RNA,然后使用逆转录试剂盒把RNA逆转录成cDNA,最后用SYBR RT-PCR试剂盒检测目的基因的表达水平. 目的基因的定量序列如表3所示.
1.4.3 western blot 实验
首先用PBS把铺在细胞培养板上的细胞洗一遍,加入含有蛋白酶抑制剂的RIPA Buffer裂解液,用刮子把细胞刮下来,吸到1. 5 mL的离心管中,低温下裂解15 min,然后以13 000 r/min的转速离心15 min,吸取上清. 根据BCA试剂盒说明书配置BCA试剂,37 ℃水浴加热0.5 h,借助分光光度计仪器测量蛋白浓度. 加入等量的蛋白样品,再加入2×Laemmli Sample Buffer使其体积相同,100 ℃恒温金属浴加热5 min使蛋白变性. 进行SDS-PAGE凝胶电泳,根据目的蛋白的大小决定电泳时间,采用PVDF膜进行转膜2 h,当蛋白转至PVDF膜上之后,1×TBST洗一遍,以5%的牛奶封闭0.5 h,1×TBST洗3遍,再加入目的蛋白一抗4 ℃孵育过夜. 第二天用1×TBST洗3遍,再选用一抗所对应的二抗室温下孵育2 h以上,1×TBST洗3遍后,配置化学发光显影液,随后将膜置于化学发光成像仪器上曝光合适的时间,得到所需的显影图像.
1.4.4 统计学分析
实验所得到的定量数据都以Excel文档形式保存,分析对照组和实验组之间的显著性差异采用Student t-test方法检测. *P <0.05,**P <0.01,***P <0.001指示显著性差异程度,认为P小于0.05存在统计学意义.
2 结 果
2.1 NDV感染肝癌细胞降低USP13的表达水平
Huh7细胞是由日本病毒学家Takaji Wakita从病人血清中分离出来的一种肝癌细胞系,HLCZ01细胞是由本实验室从临床病人肝组织分离出来的一种肝癌细胞系,Huh7细胞相较于HLCZ01细胞对NDV更为敏感. 本文以切割的PARP作为细胞发生凋亡的标志.
当前在很多临床试验中,采用溶瘤病毒杀伤肿瘤细胞. NDV是能选择性在肿瘤细胞中复制并导致肿瘤细胞凋亡[7],同时不影响正常细胞的一种溶瘤病毒. NDV感染本实验的两种肝癌细胞,当感染一定的时间,细胞形态会发生皱缩,最后被感染的许多细胞形成“病灶”,可在倒置显微镜观察到“病灶”(图1). 用NDV感染Huh7细胞24 h,收取细胞的mRNA,发现USP13的mRNA呈现下调趋势(图2). 接着同等实验条件收取病毒感染细胞24 h、30 h的蛋白,USP13的蛋白水平也明显降低(图3),western blot结果灰度分析如图4所示. 为了避免细胞的特异性,我们又选择了另外一个肝癌细胞系HLCZ01来进行实验,NDV感染HLCZ01细胞分别收取细胞的mRNA和蛋白,实验结果与上文的结果相一致(图5、图6),western blot结果灰度分析如图7所示. 本实验选取另一种病毒VSV作为阴性对照,说明NDV对USP13的调控是特异性的. 这些结果表明,NDV感染肝癌细胞可以降低USP13的表达水平,暗示USP13可能在NDV诱导的肝癌细胞凋亡中发挥着某种作用.
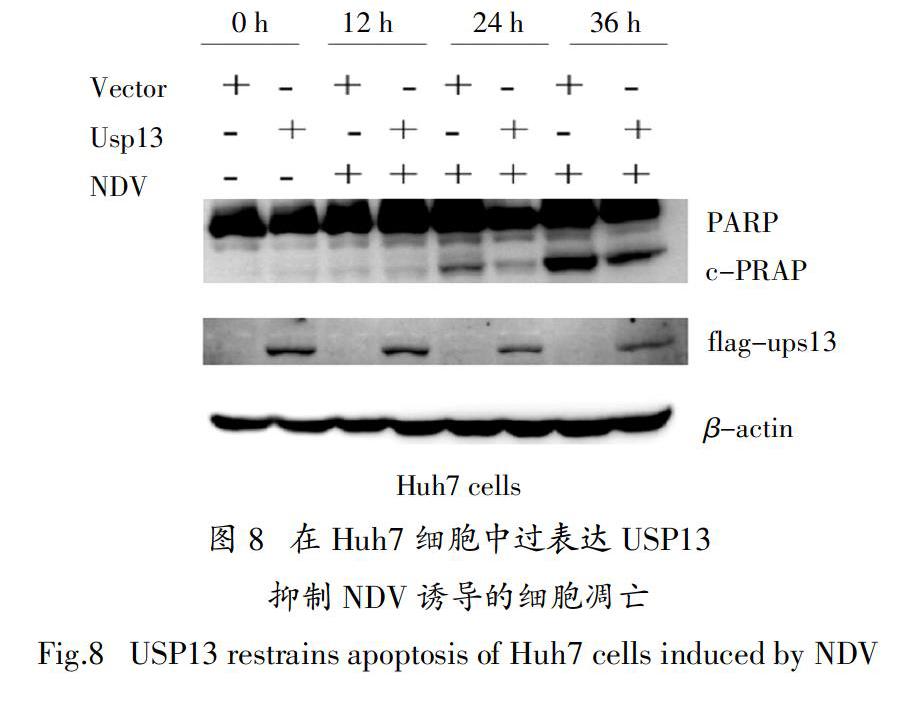
2.2 过表达USP13抑制NDV诱导的肝癌细胞凋亡
构建了USP13的过表达质粒,探究USP13对于NDV诱导的肝癌细胞凋亡是否有影响. 在Huh7细胞中转染USP13质粒24 h后,再用NDV感染细胞,通过离心把培养基上清的死细胞收集起来. Western blot结果显示PARP被切割程度明显减弱,说明USP13抑制了细胞凋亡(图8). 在另外一种肝癌细胞系HLCZ01重复该实验,得到的结果是相似的. 表明在HLCZ01细胞与Huh7细胞中过表达USP13都是抑制NDV诱导的肝癌细胞凋亡(图9),说明USP13在NDV诱导的细胞凋亡中扮演了重要的角色.
2.3 沉默USP13促进NDV诱导的肝癌细胞凋亡
过表达USP13抑制NDV诱导的肝癌细胞凋亡,沉默USP13能否能促进NDV诱导的肝癌细胞凋亡. 为了证实这一猜测,本文构建了USP13沉默质粒,分别在Huh7、HLCZ01细胞中转染Sh-USP13质粒24 h,再分别用NDV感染细胞. 结果表明,在Huh7、HLCZ01细胞中敲低USP13的水平,促进NDV诱导的肝癌细胞凋亡(图10,图11).
2.4 USP13不影响NDV的复制
为了探究USP13影响NDV诱导的肝癌细胞凋亡是否通过影响NDV的复制来实现. 在Huh7、HLCZ01细胞中分别转染USP13质粒24 h,再用NDV分别感染细胞24 h、36 h,提取细胞的RNA,检测细胞内NDV的RNA水平. qRT-PCR数据说明了细胞内NDV的复制水平没有较大差异(图12,图13),说明USP13不影响细胞内NDV的复制,同时也从侧面暗示了USP13在凋亡信号通路中发挥着重要作用.
2.5 USP13增强Bcl-2的蛋白水平
通过上述实验,说明USP13不影响细胞内NDV的复制,那么它一定靶向于细胞凋亡信号通路中的某个分子,从而影响细胞凋亡. Bcl-2家族在细胞凋亡中發挥着重要作用,它分为抑凋亡分子和促凋亡分子. 抑凋亡分子包括Bcl-2[8]和Bcl-x,促凋亡分子包括 Bax、Bak、Bad和Bid. 在Huh7细胞中转染USP13质粒24 h,再用NDV感染细胞,最后收集细胞的蛋白. 我们采用western blot方法检测了Bcl-2的蛋白水平,发现Bcl-2明显增强(图14,图15). 表明USP13调控凋亡信号通路中抑凋亡蛋白分子Bcl-2,进而抑制肝癌细胞的凋亡.
3 讨 论
肝癌严重威胁着人类健康,它的治疗方法包括手术切除、放射治疗、化学药物治疗等,但是都没有很好的疗效,所以亟待开发新的抗肿瘤治疗方法[9]. 溶瘤病毒能够特异性识别肿瘤细胞并且杀伤肿瘤细胞. NDV是溶瘤病毒大家庭的一员,NDV除了可以感染肿瘤细胞直接杀伤肿瘤细胞外,还可以影响肿瘤细胞免疫原性或者诱导机体产生免疫反应从而杀伤肿瘤细胞[10]. NDV可以激活外部凋亡信号通路从而诱导细胞凋亡. NDV可以激活線粒体凋亡信号通路. NDV诱导细胞凋亡是一个较为复杂的调控过程.
本文研究发现两种不同的肝癌细胞感染NDV,细胞中的USP13水平均呈现降低的趋势. USP13是一种去泛素化酶,泛素化和去泛素化这两种蛋白修饰参与了细胞中很多的生理进程[11]. USP13可能调控NDV诱导的肝癌细胞凋亡. 经过实验论证,过表达USP13能够抑制NDV诱导的肝癌细胞凋亡,反之,敲低细胞中USP13的水平能够促进NDV诱导的肝癌细胞凋亡. 实验表明,USP13不影响NDV的复制,也从侧面说明了USP13是影响细胞内的凋亡信号通路. western blot实验揭示USP13能够增强Bcl-2家族中的抑凋亡蛋白Bcl-2,进而导致细胞凋亡受到抑制. 虽然找到了USP13调控NDV诱导细胞凋亡的靶分子Bcl-2,但是还有很多问题需要深入探索. USP13是否与Bcl-2相互作用直接调控Bcl-2,又或者是USP13通过其他分子来间接调控Bcl-2,它是如何上调Bcl-2的蛋白水平,是否通过发挥USP13去泛素化酶的活性抑制Bcl-2的泛素化降解,这些还未解决的问题将会被继续探索,相信这是一个全新的挑战. 本文的研究为肝癌的溶瘤病毒治疗提供了一个新的理论依据,为以后研发新型特异的肝癌治疗方法奠定了基础.
参考文献
[1] GRANDHI M S,KIM A K,RONNEKLEIV-KELLY S M,et al. Hepatocellular carcinoma: from diagnosis to treatment[J]. World Journal of Hepatology,2015,7(8):74—85.
[2] MAHMOUD M,SAMOILOV D,WEINBERG G,et al. Treatment of hepatocellular carcinoma (HCC) using multi-modality therapy in a community based setting[J]. Am J Gastroenterol,2015,110:S918—S9199.
[3] FUJIWARA T. Targeted oncolytic adenovirus for human cancer therapy:gene-based therapies for cancer1970[M]. Gene-Based Therapies for Cancer,2010:79—93.
[4] SINKOVICS J G,HORVATH J C. Newcastle disease virus (NDV): brief history of its oncolytic strains [J]. Journal of Clinical Virology,2000,16(1):1—15.
[5] PE?INA-?LAUS N. Wnt signal transduction pathway and apoptosis: a review[J]. Cancer Cell International,2010,10(1):22—26.
[6] YANG D R,ZUO C H,WANG X H,et al. Complete replication of hepatitis B virus and hepatitis C virus in a newly developed hepatoma cell line [J]. Proceedings of the National Academy of Sciences of the United States of America,2014,111(13):1264—1273.
[7] FAN X,LU H,CUI Y,et al. Overexpression of p53 delivered using recombinant NDV induces apoptosis in glioma cells by regulating the apoptotic signaling pathway [J]. Experimental & Therapeutic Medicine,2018,15(5):4522—4530.
[8] WANG H G,MIYASHITA T,TAKAYAMA S,et al. Apoptosis regulation by interaction of Bcl-2 protein and Raf-1 kinase[J]. Oncogene,1994,9(9):2751—2756.
[9] KIM K W,LEE J M,CHOI B I. Assessment of the treatment response of HCC [J]. Abdom Imaging,2011,36(3):300—314.
[10] LIU N,LONG Y,LIU B,et al. ISG12a mediates cell response to Newcastle disease viral infection [J]. Virology,2014,462/463(1):283—294.
[11] ZHANG J S,ZHANG P J,WEI Y K,et al. Deubiquitylation and stabilization of PTEN by USP13 [J]. Nature cell biology,2013,15(12):1486—1494.
