长江中下游湖泊螺类beta多样性分析
2019-01-09王魏根
王魏根
长江中下游湖泊螺类beta多样性分析
王魏根
阜阳师范学院生物与食品工程学院,阜阳 236037
采用两种方法对长江中下游19个湖泊螺类beta多样性进行了分析。首先采用Legendre方法分析单个螺类物种(SCBD)和单个湖泊(LCBD)在β多样性中的贡献。结果表明分布范围居中的螺类, 如大沼螺(), SCBD值大, 分布范围窄的和分布范围广的螺类SCBD值均会降低; 花马湖LCBD值最大, 单个湖泊的LCBD值和其中分布的螺类物种数没有显著的相关性。二是采用Baselga方法分析螺类β多样性中的周转和嵌套成分。多位点计算结果表明长江中下游湖泊中螺类β多样性主要原因是物种在空间上的周转。配对的分析结果表明不同湖泊对间的β多样性周转和嵌套组成比例不同, 并且存在着完全的周转和完全的嵌套格局。
湖泊; 螺类; beta多样性; 周转; 嵌套
1 前言
比较不同群落中物种组成及其变化是群落生态学研究的重要内容, Whittaker(1960)首次将物种多样性分成3个层次: α多样性(局域物种的多样性)、γ多样性(区域尺度的物种多样性)和β多样性(群落组成沿样带或某一环境梯度、格局变化的测度)[1], 但反映不同采样单元间群落组成非方向性、无梯度的变化也是描述β多样性合适的方法[2]。由于Whittaker最初对beta多样性定义内容不很精确, 所以随后的研究者根据自己研究目的不同定义了很多β多样性内容及其度量方法[3–4]。
Legendre提出一种通过计算由位点-物种构成的群落组成资料矩阵的方差来估计β多样性的方法[5]。总β多样性(BD)等于总的离均差平方(SS)和除以其自由度(-1), 也就是方差。为了了解单一物种或单一位点在β多样性中的贡献, 总β多样性可以继续分解成单一物种对总β多样性的贡献度SCBD (Species Contribution to Beta Diversity)和单个位点对总β多样性的贡献度LCBD(Local Contribution to Beta Diversity)[2]。该方法既可以利用群落频度数据和丰度数据直接计算, 也可以通过相异性矩阵来计算, 但相异性矩阵必须是Euclidean性质距离, 只能计算LCBD[2]。某位点LCBD值大则表示该样点群落组成和区域内其它位点组成差异大, 也说明该位点具有较高的保护价值, 相反则说明该位点物种贫乏或者环境被破坏需要修复。某物种SCBD值大小则反映该物种对该区域β多样性影响的相对重要性。
根据群落间β多样性来源的相关理论, Baselga[6]提出β多样性可分解成物种在空间上周转和嵌套两个部分, 分别代表在空间上的物种替代和物种得失两个不同的过程, 并基于Sørensen相异性指数, 提出了加性的分解方法: βsor=βsim+βnes, 即总β多样性(βsor)可以分解成物种替换引起的β多样性(βsim)和嵌套结构导致的β多样性(βnes)。该方法既可以利用群落组成配对的相异性矩阵资料计算, 也可以利用多位点相异性矩阵资料计算, 多位点方法总β多样性、周转和嵌套部分分别用大写英文下标βSOR、βSIM、和βNES表示[6]。在保护生物学中, 总β多样性中周转和嵌套组分相对比例大小分别暗示着不同的保护措施, 嵌套为主导区域需要优先保护物种多样性丰富度高的位点, 周转为主导区域则需要同时保护多个位点[16]。
长江是中国最长的河流, 其中下游地区分布着众多湖泊, 湖泊总面积达15770 km2, 构成了一个复杂的江湖复合生态系统, 长期演化中形成了独特而多样的生物类群, 被世界自然基金会列为全球200个需要优先保护的生态区之一[7]。淡水螺类是底栖生物群落的重要组成部分, 是水生食物链的基本环节之一, 和人类生活关系也很密切。长江中下游是我国淡水螺类资源分布集中的地区, 特有种多。自20世纪50年代以来, 进行过几次零散的螺类资源调查, 但这些调查主要是了解各湖泊的区系组成[8]。近期研究表明, 江湖阻隔、过度利用和水体污染等人为因素已造成长江中下游湖泊的螺类多样性明显下降, 特别是受阻隔湖泊的螺类物种较少。根据物种保护价值指数,有5种处于受威胁等级, 5种处于近危等级[9]。
β多样性分解方法可以通过度量α多样性变化的方法在一定尺度上来预测γ多样性变化, 通过了解保持β多样性背后的机制可以为较大区域内生物多样性保护提供重要启示。生物多样性保护实践中, 对研究区域内β多样性进行定量分析, 有利于量化生物多样性损失并确定保护区的位置, 对生物入侵物种管理等都有重要意义[10]。因此我们采用2种β多样性分解方法, 对长江中下游地区湖泊淡水螺类群落组成资料进行β多样性分析, 探讨该地区螺类β多样变化的原因(周转和嵌套)以及各个物种(SCBD)、各个湖泊(LCBD)在整个β多样性中的贡献, 为该地区淡水螺类物种多样性保护和资源合理利用提供科学依据。
2 材料和方法
2.1 研究区概况
长江中下游地区属于亚热带季风气候, 年平均气温13—20 ℃, 年平均降水量800—1600mm[7]。本研究共编辑整理了长江中下游19个湖泊的螺类名录资料进行分析(见表1), 湖泊按面积由大到小顺序编号为1—19, 依次是鄱阳湖(江西)[17–19]、洞庭湖(湖南)[17,20]、太湖(江苏)[17,21–22]、巢湖(安徽)[23]、洪湖(湖北)[17,24]、梁子湖(湖北)[17]、菜子湖(安徽)[25]、南漪湖(安徽)[26]、大通湖(湖南)[27]、淀山湖(上海)[28]、牛山湖(湖北)[17]、保安湖(湖北)[17]、东湖(湖北)[17,29]、花马湖(湖北)[30]、桥墩湖(湖北)、青菱湖(湖北)、大黄家湖(湖北)、后湖(湖北)和扁担塘(湖北)[17]。这些湖泊处在长江流域最上游的是洞庭湖(28°18′8—30°12′ N, 110°24′—113°6′E), 处在长江流域最下游的是淀山湖(31°04′—31°12′ N, 120°54′—121°01′ E)(图1)。
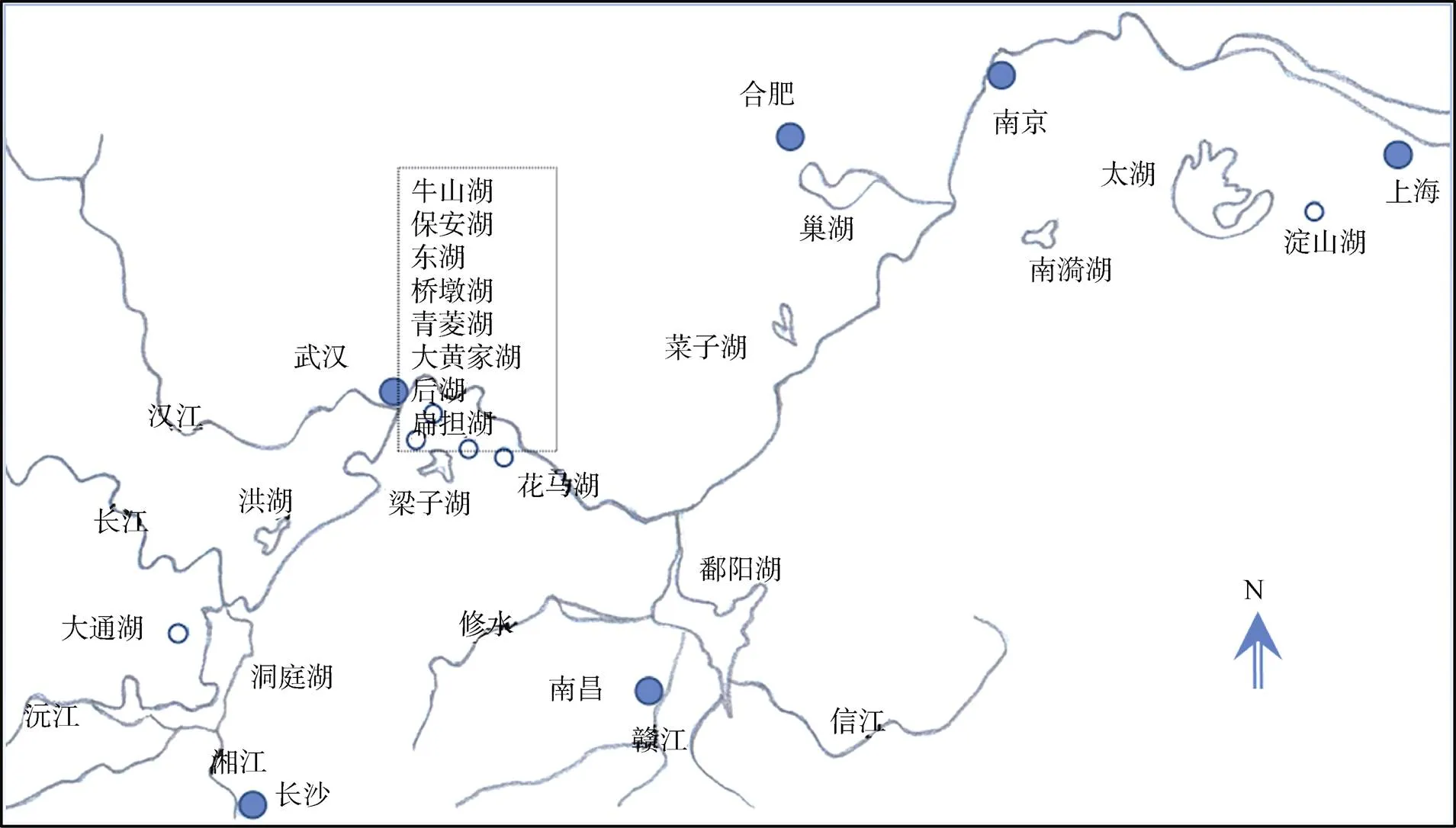
图1 湖泊位置示意图
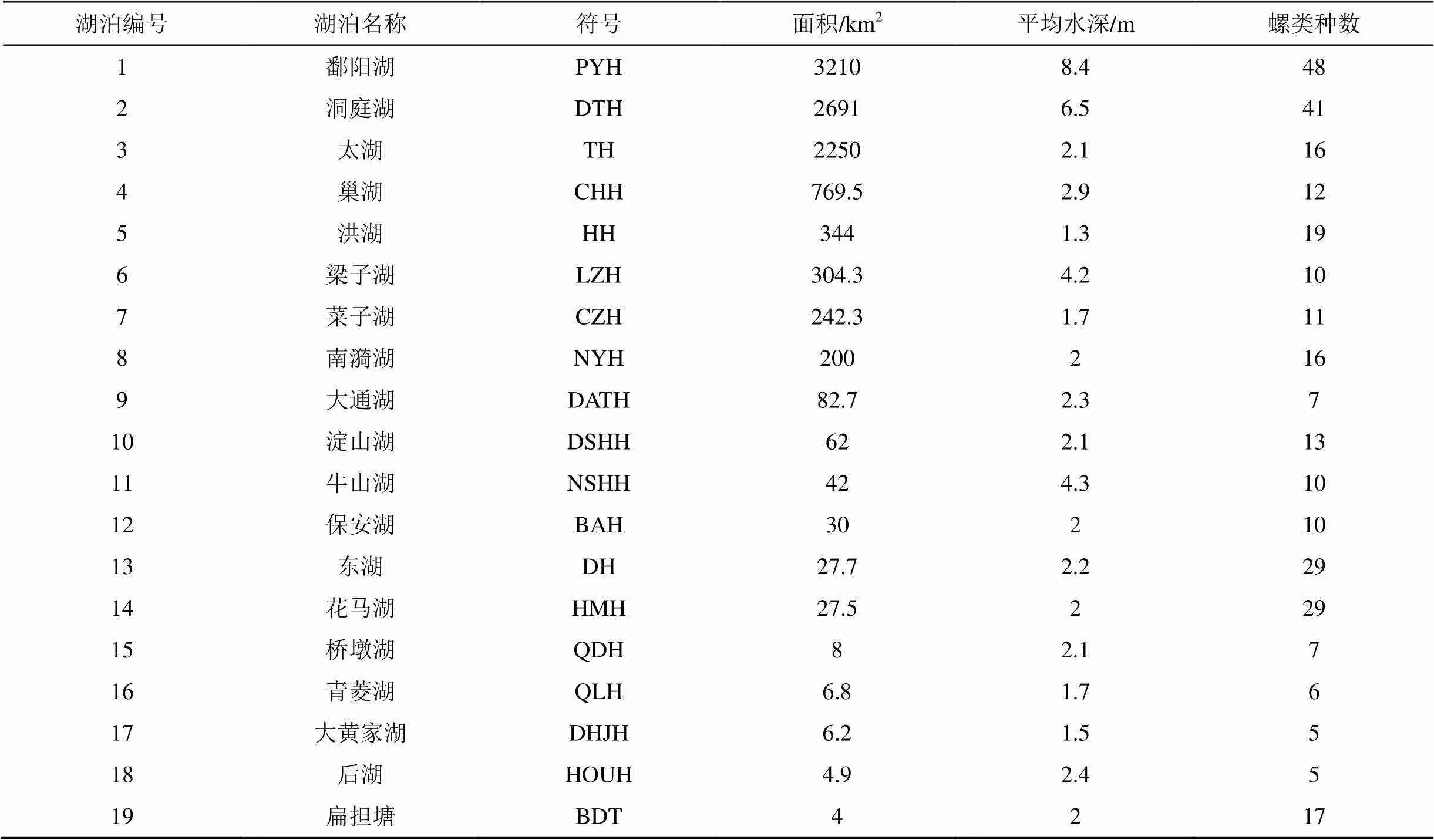
表1 长江中下游湖泊特征及螺类物种数
在这19个湖泊中, 共记录了螺类名录79种(表2), 隶属于9个科, 种类最多的为田螺科25种, 最少的膀胱螺科1种[17-30]。这些螺类分布范围差异较大,有的广泛分布, 如田螺科的铜锈环棱螺(a)在19个湖泊中都有分布, 豆螺科的长角涵螺()在18个湖泊中有分布。而分布稀少的仅在单个湖泊中出现记录。在各个湖泊中, 以鄱阳湖记录螺类种数最多为48种, 大黄家湖和后湖记录螺类种数最少为5种。
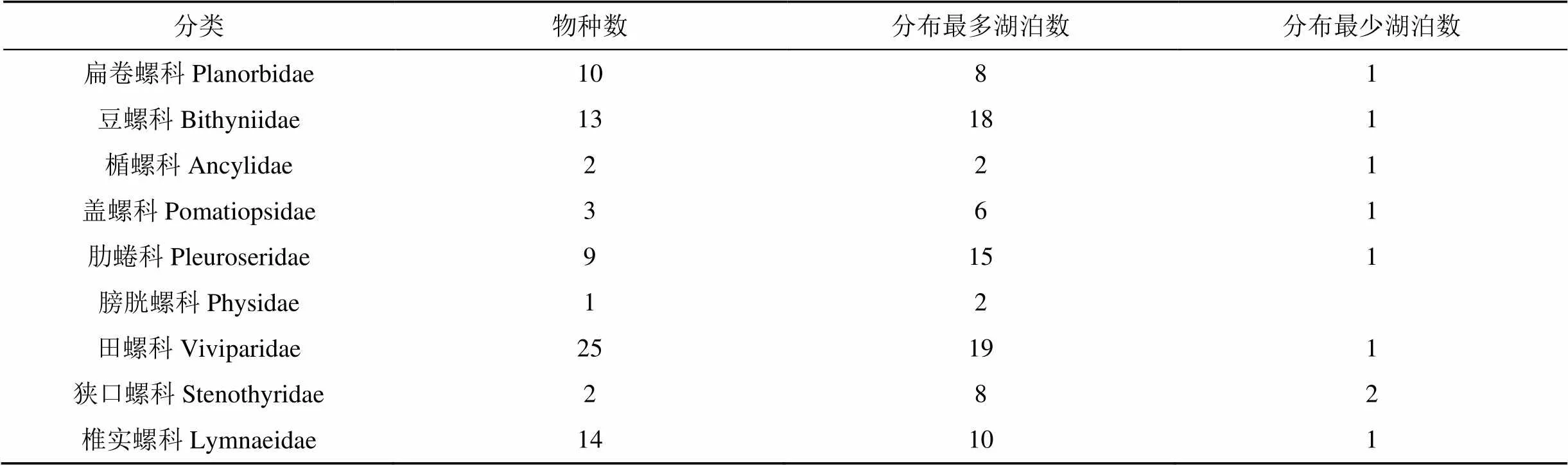
表2 长江中下游湖泊螺类组成概况
2.2 数据整理
为了尽可能全面了解长江中下游湖泊中螺类物种名录及其分布状况, 我们依据多年已经公开发表文献的调查记录进行编辑整理成数据集。数据记录成为有-无类型的二元数据表, 即某种螺类在该湖泊出现就记录为“1”, 没有出现则标记为“0”。所有用于统计分析的螺类分类单元均为“种”。对于不同文献中记录的同一物种中文名有可能不同, 则按照其拉丁名统一为一个物种。有的文献中记录的物种没有鉴定到种名, 这些物种则不包括在这次分析数据中。
2.3 β多样性分解方法
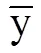
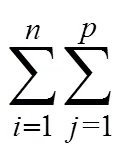
设SS和SS分别为物种的方差和第个湖泊的方差, 则SCBD和LCBD计算公式分别为:
SCBD=SS/Total; LCBD=SS/Total。
采用Baselga[6]的加性分解方法, 利用Sørensen相异性指数度量β多样性及其周转和嵌套成分, 配对的方法计算sor、sim和nes公式如下:

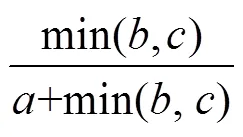
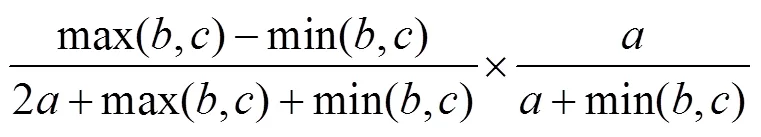
式中是两个湖泊共有的物种数,是只在第一个湖泊存在的物种数,是只在第二个湖泊存在的物种数, 总β多样性(βsor)通过Sørensen相异性指数计算而来, 周转成分(βsim)由Simpson相异性指数计算得到, 嵌套部分(βnes)则可由前两者之差计算得到。多位点方法计算总β多样性(βSOR)、周转(βSIM)和嵌套(βNES)组分计算公式请参阅文献[6]。
2.4 数据分析
单一物种对总β多样性的贡献度(SCBD)和单个样方对总β多样性的贡献度(LCBD)分析过程用R语言工具包adespatial中的beta.div函数完成[11]。即计算湖泊螺类组成矩阵总方差(BD)作为总β多样性值, 然后再分解为单个物种和单个湖泊对总β的贡献度。计算方差前, 螺类组成数据先进行“hellinger”转化, 使相异性矩阵具有Euclidean距离特征。LCBD值的显著性检验采用置换检验, 置换次数为999。为了探讨SCBD值和螺类物种分布范围的关系, 我们用SCBD值和物种分布湖泊数量进行相关分析。为了探讨LCBD值与湖泊面积、深度及其中螺类物种数之间的关系, 我们用LCBD值与各个湖泊面积、水深以及螺类物种数进行相关分析。相关分析用R语言工具包betareg完成[12]。
β多样性及其周转和嵌套组分的分解过程采用R语言工具包betapart完成[13]。为了可视化不同湖泊对之间β多样性关系, 我们利用配对计算的相异性矩阵进行非度量多维尺度分析(NMDS)和聚类分析(单连接聚合聚类法)。
以上两种β多样性分析过程均在统计软件R语言环境中进行[14], 除了以上所述工具包外, 还利用了beanplot[15]、vegan工具包[16]和R基础工具包。
3 结果与分析
3.1 单一螺类SCBD和单一湖泊LCBD
根据Legendre[5]方法计算结果表明, 长江中下游19个湖泊螺类SS即总的离均差平方和为9.8039,BD即总β多样性值为0.5447。
SCBD最小值为0.0020, 由瘦沼螺()、红带短沟蜷()、河环棱螺(贡献, 这三种螺类均只在鄱阳湖有分布。最大值为0.5133, 由大沼螺()贡献, 该螺在12个湖泊有分布。SCBD平均值为0.0127, 有26个物种超过平均值。Beta相关性分析表明, SCBD值和该物种分布的湖泊数量显著相关(<0.001,2=0.6243)(图2、3)。
LCBD值最小为0.0349, 由淀山湖贡献。最大值为0.0711, 由花马湖贡献。各个湖泊平均贡献度为0.0526, 有9个湖泊LCBD贡献度超过平均(按顺序依次是CZH、DHJH、CHH、DATH、HOUH、DTH、DH、NSHH、HMH)(图4)。但置换检验表明, 只有牛山湖(=0.047)和花马湖LCBD(=0.013)统计概率达到显著水平。相关分析结果表明, LCBD与湖泊面积、平均水深和螺类物种数三者关系均不显著(>0.14)。
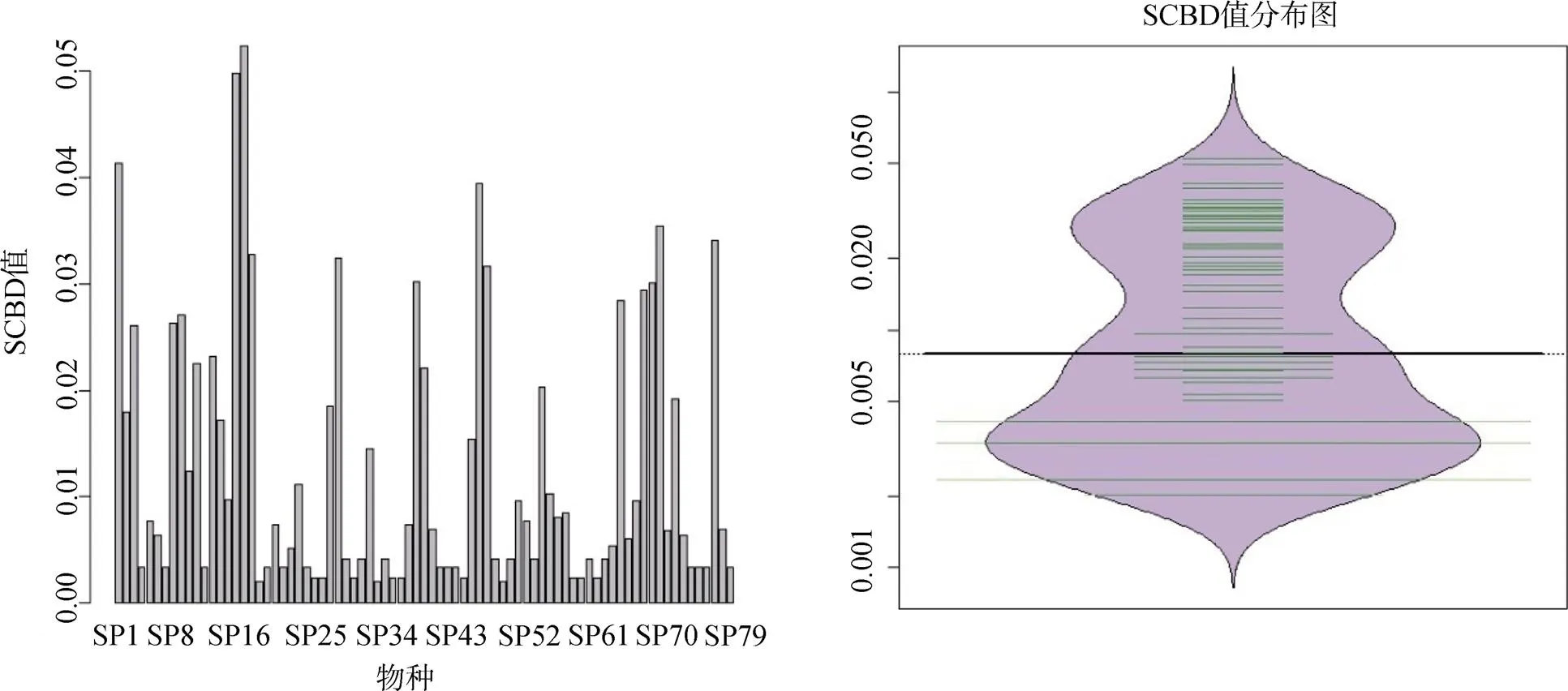
图2 SCBD值分布图
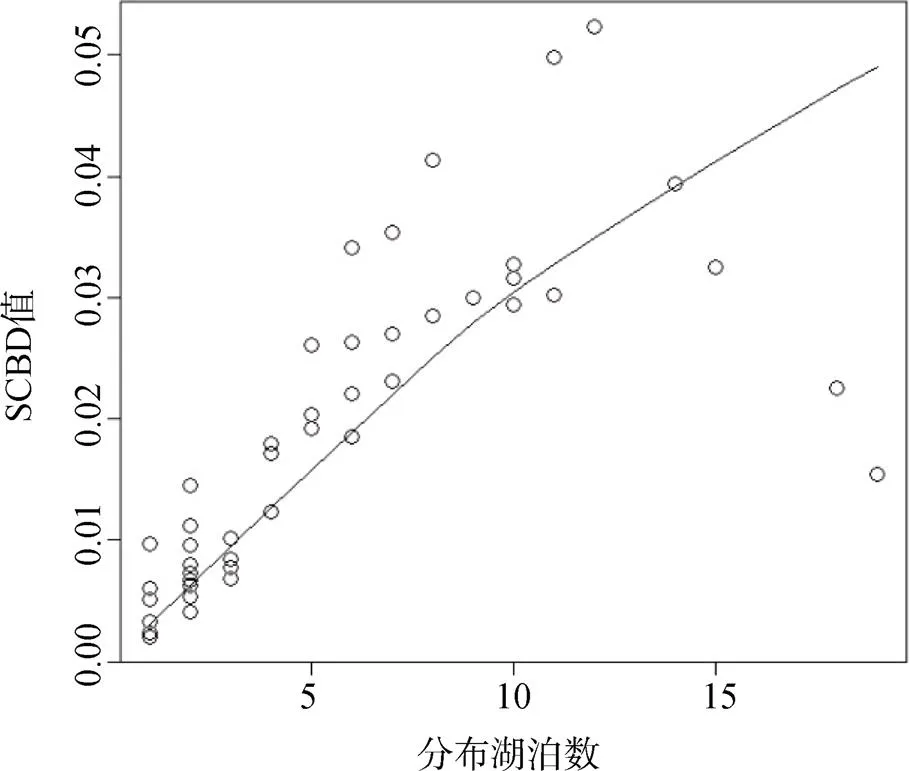
图3 SCBD值与分布湖泊数关系
3.2 周转(βsim)和嵌套(βnes)成分
根据Baselga[6]的分解方法, 首先采用多位点方法计算, βSOR、βSIM和βNES值分别为0.8779、0.7143和0.1636, 周转和嵌套成分在总β多样性中比例分别是81.4%和18.6%, 表明长江中下游湖泊中螺类总β多样性主要原因是物种在空间上的周转。
其次, 采用配对方法计算βsim、βnes和βsor。βsor最小值为0.2414, 最大值为0.8824, 平均值为0.5810。βsim最小值为0, 最大值为0.8571, 平均值为0.3272, βsim在βsor中的比例平均为57.46%。βnes最小值为0, 最大值为0.8113, 平均值为0.2538, βnes在βsor中的比例平均为42.54%(图5)。在βsim和βnes中均有0值出现, 说明配对的湖泊之间螺类分布变化存在着完全的周转(湖泊TH和NYH, LZH和NSHH, LZH和BAH, DATH和QDH, NSHH和BAH, DH和HMH, DHJH和HOUH之间, 嵌套部分βnes为0)以及完全的嵌套(湖泊PYH和CHH、LZH、CZH、DATH、QDH、DHJH、HOUH之间, DTH和DATH、HOUH之间, BAH和QLH之间, BDT和QLH、DHJH之间, 周转部分βsim值为0)。
分别根据配对计算的βsim、βnes和βsor的值进一步进行非度量多维尺度分析(NMDS)和聚类分析(单连接聚合聚类法)。利用βsim聚类分析表明, 长江中下游湖泊在0.10处分成3个类群, DH和HMH各为1群, 其余为一群。NMDS非约束排序分析的应力函数值为0.2317, 表明二维点阵图几乎是随机的, 不能很好解释原始距离。利用βnes聚类分析表明, 长江中下游湖泊在0.06处分成4个类群, DH和HMH为一群, PYH和DTH为一群, HH、BDT、TH、NYH为一群, 其余为第四群。其NMDS非约束排序分析的应力函数值为0.0827, 表明二维点阵图可以较好解释长江中下游湖泊螺类分布的关系。利用βsor聚类分析表明, 长江中下游湖泊在0.45处分成4个类群, 第一群只有NSHH, 第二群包含DH和HMH, 第三群包含PYH和DTH, 其余14个湖泊为一群。NMDS非约束排序分析的应力函数值为0.1594, 表明二维点阵图对原始距离解释能力一般(图6)。
4 讨论
长江中下游湖泊是我国水生生物多样性丰富地区, 也是人口密度比较大, 农业、工业和经济比较发达的地区, 水生生物多样性受到人类活动很大的干扰[7]。螺类由于运动能力不强, 更容易受到湖泊环境变化的影响, 围湖造田、江河阻隔、水质污染、水产养殖等都对螺类生存和分布造成很大影响, 加强螺类资源的保护是当前很迫切的任务[9]。
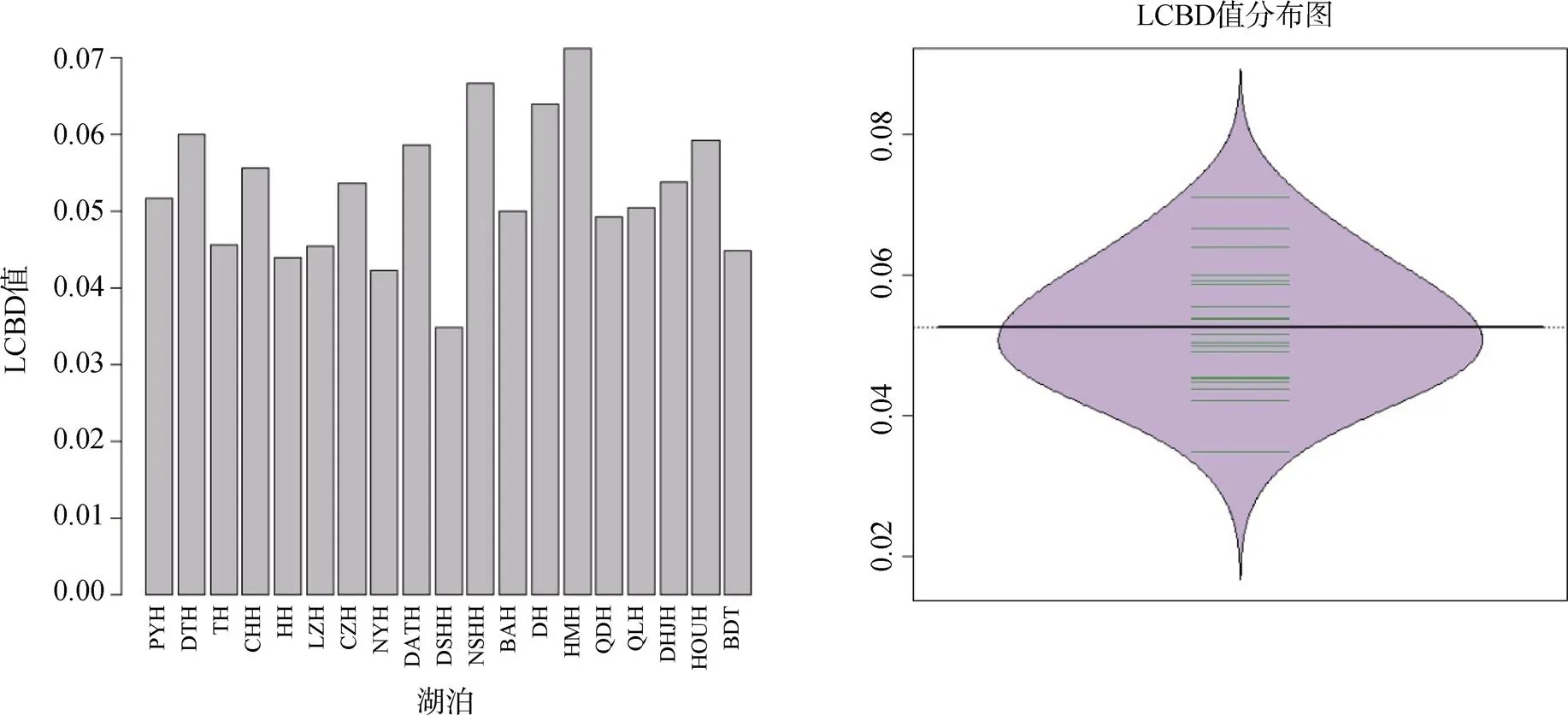
图4 LCBD值分布图
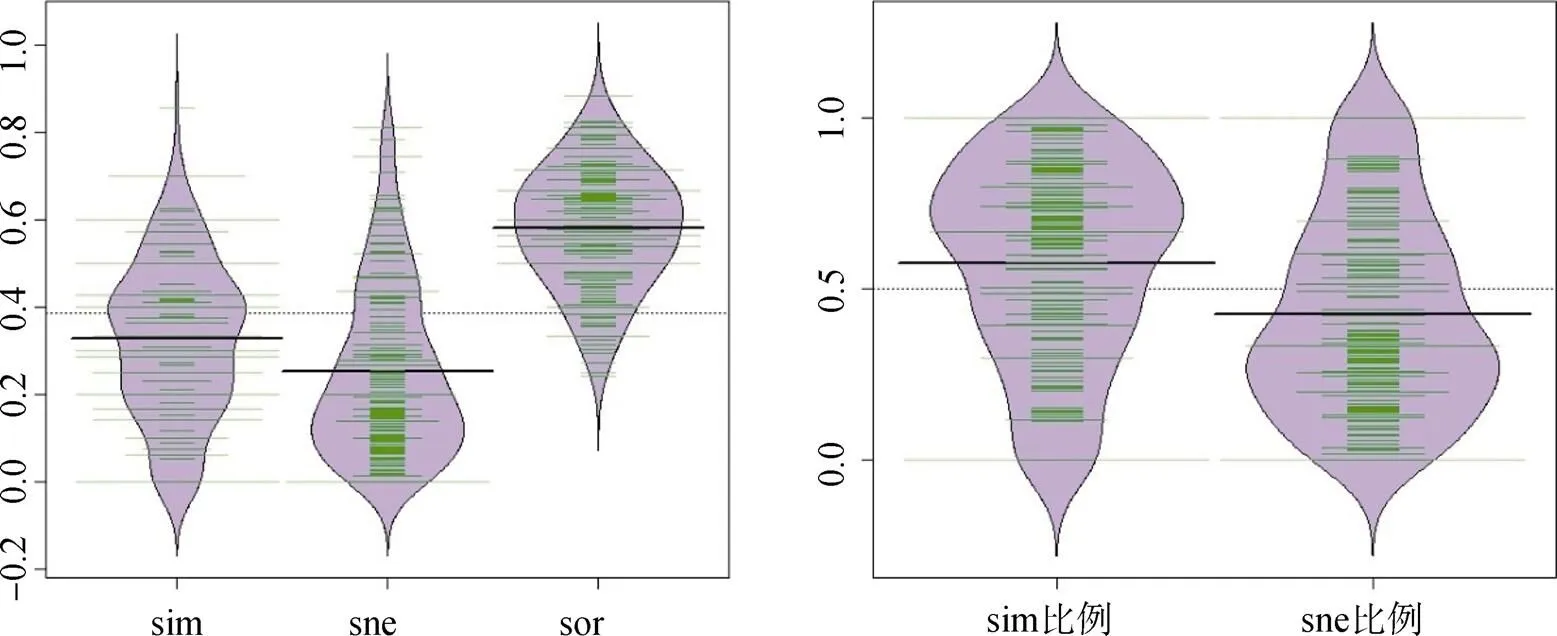
图5 βsim和βsne及其在βsor中所占比例分布
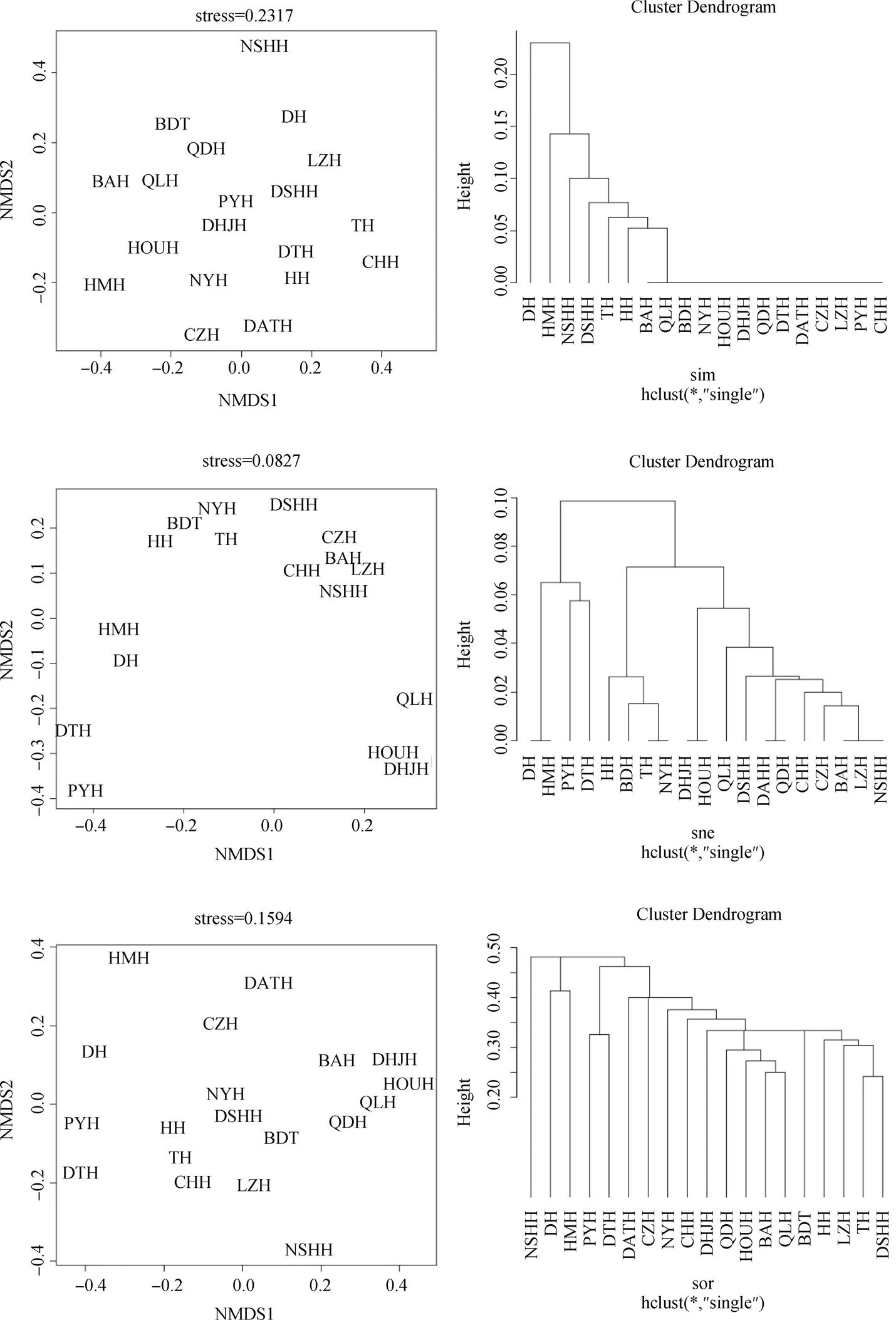
图6 βsim, βsne and βsor NMDS分析和聚类分析
由于分布数量居中的物种带来更多的变异(方差), 所以分布湖泊数量居中的螺类物种SCBD值应最大, 而分布湖泊数很少和很多的物种SCBD值会降低, 即呈现单峰的关系[31]。本次研究中, 可能由于分布广泛的螺类物种数很少而降低了其在相关分析中的作用, 因此检验表明各螺类物种SCBD值和该物种分布湖泊数有显著相关性(<0.001), 但从图3中的散点分布和拟合线可以看出, 二者并不是呈简单的线性相关, 如果分布广泛的螺类物种数增多, 这种趋势应该更加明显。螺类中的铜锈环棱螺在19个湖泊中都有分布, 直觉上该物种在19个湖泊中的β多样性贡献应该为0, 但在Legendre方法中其SCBD值为0.0154, 原因是该方法中原始数据在计算前进行了 “hellinger”转化, 转化后的数据和原始数据不是简单的线性关系, 因而转化后的值在不同湖泊不一样, 计算出的SCBD值不为0[32]。
在生态学上, LCBD的值反映了各湖泊螺类群落组成的独特性程度。经置换检验, 除牛山湖和花马湖外, 其它湖泊LCBD值差异均不显著, 说明螺类物种在这些湖泊中主要呈独立、随机的分布[5]。可能原因是螺类运动能力弱, 活动范围小, 物种之间相互作用、相互竞争影响不大, 因而成随机分布。LCBD和湖泊中螺类的物种数没有显著的线性相关性, 在这些湖泊中, 鄱阳湖的螺类物种数最多, 但LCBD值最大的为花马湖, 螺类种类数最少的是大黄家湖和后湖, 但LCBD值最小的是淀山湖。这可能和分布在湖泊中物种的稀有性有关, 在淀山湖由于分布了较多的广泛分布的物种反而降低了其LCBD值, 相反的, 分布较多的稀有物种则会增加该湖泊的LCBD值。
关于β多样性起源的假说一般包括3个方面, 一是由于生物之间的相互作用, 在很大区域范围内, 物种的组成是均匀分布的; 二是由于物种形成和扩散历史不同, 物种组成呈现为随机的和自相关的形式; 三是由于环境的筛选、控制, 物种的分布和环境相关。如果物种组成变化是随机的并且伴随自相关的生物过程, 那么物种组成变化就主要体现在不同物种的替换, 即β多样性可由周转, 即物种空间上的替换来解释[5]。利用Baselga的加性分解方法, 对长江中下游湖泊螺类β多样性分解表明, 物种周转成分在总β多样性中占很大的比例(81.4%), 表明螺类β多样性可能主要来源于物种随机分布和自相关的过程。可能原因是螺类的运动缓慢, 扩散能力现对较弱, 因而分布更多受物种形成历史以及扩散程度的影响。一般来说研究区域尺度不同, 影响β多样性的主要因素不同。在宏观尺度(不同进化历史的生物地理区域), 地球板块运动造成的地理隔离使得物种形成和灭绝等是β多样性主要推动力; 在微观尺度(环境异质的栖息地), β多样性主要受栖息地组成特性、物种生态位需求、干扰等因素影响; 本次研究是从中观水平来分析长江中下游湖泊螺类β多样性, 因此影响因素主要是区域内相对隔离的栖息地、气候、物种扩散能力等[33]。长江中下游湖泊螺类在宏观和微观层次β多样性变化规律有待进一步研究。
图5可以看出, Baselga配对的β多样性分析方法中周转和嵌套是两个对立的过程, 结果表明不同湖泊对的β多样性中周转和嵌套组成比例不同。βnes在螺类物种数相等的湖泊间值为0, 例如湖泊LZH、NSHH、BAH分布螺类均为10种, DATH和QDH均为7种, DH和HMH均为29种, DHJH和HOUH均为5种。原因是由前文βsim和βsor计算公式可知b/(a+b)=2b/(2a+2b), 所以在配对的β多样性分析中, βsim值和βsor值相等, 即这两个湖泊beta多样性完全是由于物种空间周转[6]。在湖泊PYH和CHH、LZH、CZH、DATH、QDH、DHJH、HOUH之间, DTH和DATH、HOUH之间, BAH和QLH, BDT和QLH、DHJH之间则βsim值为0, 原因是在这些湖泊间, 螺类物种数少的湖泊的螺类也全部在螺类多的湖泊中, 即前者螺类是后者螺类的一个子集部分, 因而形成一个完全的嵌套格局。
根据不同湖泊对计算的βsim、βnes和βsor的值进行聚类分析(单连接聚合聚类法), 结果显示长江中下游螺类可以分成3或4组, 主要反映了各湖泊中螺类分布种数的差异。利用βsim、βnes和βsor分别进行非度量多维尺度分析(NMDS), 应力函数结果显示β多样性不同组分二维点阵图对原始距离的解释能力不同, 利用βnes值NMDS分析的应力函数值最小, 对原始数据的距离解释能力最好。
理解一个区域内生物多样性如何分布才能更有效的保护该地区生物多样性。我们利用多年长江中下游湖泊螺类调查物种组成资料, 采用2种分析方法, 分析了长江中下游湖泊中螺类分布的β多样性, 表明不同湖泊、不同螺类物种对该区域螺类β多样性贡献度不同, 而且不同湖泊对之间螺类β多样性形成主要原因不同, 因而整个区域螺类多样性保护要采取不同的措施。例如, 在嵌套格局占优势的湖泊对中, 我们一般会保护物种数量多的湖泊, 但同时我们也要注意保护哪些面积不大但物种组成独特即LCBD贡献大的湖泊。因此, 将螺类分布的α多样性和β多样性结合起来, 可以为长江中下游地区湖泊螺类资源利用和生物多样性保护提供更合理的依据。
[1] WHITTAKER R H. Vegetation of the Siskiyou Mountains, Oregon and California[J]. Ecological Monographs, 1960(30): 279–338.
[2] LEGENDRE P, DE CACERES M. Beta diversity as the variance of community data: dissimilarity coefficients and partitioning [J]. Ecology Letters, 2013(16): 951–963.
[3] TUOMISTO H. A diversity of beta diversities: straightening up a concept gone awry, Part 1. Defining beta diversity as a function of alpha and gamma diversity [J]. Ecography, 2010(33): 2–22.
[4] ANDERSON M J, CRIST T O, CHASE J M, et al. Navigating the multiple meanings of beta diversity: a roadmap for the practicing ecologist[J] . Ecology Letters, 2011(14): 19–28.
[5] LEGENDRE P, BORCARD D, PERES-NETO P R. Analyzing beta diversity: partitioning the spatial variation of community composition data[J]. Ecological Monographs, 2005, 75(4): 435–450.
[6] BASELGA A. Partitioning the turnover and nestedness components of beta diversity[J]. Global Ecology and Biogeography, 2010(19): 134–143.
[7] 王洪铸, 王海军, 刘学勤, 等. 实施环境-水文-生态-经济协同管理战略, 保护和修复长江湖泊群生态环境[J]. 长江流域资源与环境, 2015, 24(3): 353–357.
[8] 舒凤月, 王海军, 崔永德, 等. 长江流域淡水软体动物物种多样性及其分布格局[J]. 水生生物学报, 2014, 38(1): 19–26.
[9] 舒凤月, 王海军, 潘保柱, 等. 长江中下游湖泊贝类物种濒危状况评估[J]. 水生生物学报, 2009, 33(6): 1051– 1058.
[10] JACOB B S, JAMES J G, WILLIAM E K, et al. How should beta-diversity inform biodiversity conservation? [J]. Trends in Ecology & Evolution, 2016, 31(1): 67–80.
[11] Dray S, Blanchet G, Borcard D, et al. adespatial: Multivariate Multiscale Spatial Analysis [EB/OL]., 2016.
[12] CRIBARI-NETO F, ZEILEIS A. Beta Regression in R[J]. Journal of Statistical Software, 2010(34): 1–24.
[13] ANDRÉS B, DAVID L O C. betapart: an R package for the study of beta diversity[J]. Methods in Ecology and Evolution, 2012(3): 808–812.
[14] RDEVELOPMENT CORE TEAM. R: A Language and Environment for Statistical Computing [EB/OL]. R Foundation for Statistical Computing, Vienna, Austria. http://www. R-project. org/, 2016.
[15] KAMPSTRA P, BEANPLOT: a boxplot alternative for visual comparison of distributions[J]. Journal of Statistical Software, 2008(28): 1–9.
[16] OKSANEN J, F. BLANCHET G, KINDT R, et al. Vegan: community ecology package[EB/OL]. https://cran. r-project. org/web/packages/vegan/index. html, 2016.
[17] 吴小平, 梁彦龄, 王洪铸, 等. 长江中下游湖泊淡水贝类的分布及物种多样性[J]. 湖泊科学, 2000, 12(2): 111–118.
[18] 张铭华, 徐亮, 谢广龙, 等. 鄱阳湖流域淡水贝类物种多样性、分布与保护[J]. 海洋科学, 2013, 37(8): 114–124.
[19] 陈晔光. 鄱阳湖及其周围水域的淡水螺类[J]. 动物学集刊, 1988(6): 69–75.
[20] 胡自强. 洞庭湖及其周围主要水域的螺类[J]. 湖南师范大学自然科学学报, 1993, 16(1): 80–86.
[21] 蔡永久, 龚志军, 秦伯强. 太湖大型底栖动物群落结构及多样性[J]. 生物多样性, 2010, 18 (1): 50–59.
[22] 吴庆龙. 东太湖的贝类及其生物学[J]. 海洋湖沼通报, 1993(4): 68–74.
[23] 胡菊英, 姚闻卿. 巢湖底栖动物调查[J]. 安徽大学学报(自然科学版), 1981(2): 159–173.
[24] 李恒德, 吕代钧. 洪湖底栖动物调查报告[J]. 淡水渔业, 1985(2): 25–29.
[25] 徐小雨, 周立志, 朱文中, 等. 安徽菜子湖大型底栖动物的群落结构特征[J]. 生态学报, 2011, 31(4): 0943–0953.
[26] 陈立婧, 彭自然, 孙家平, 等. 安徽南漪湖大型底栖动物群落结构[J]. 动物学杂志, 2008, 43(1): 63–68.
[27] 李德亮, 张婷, 余建波, 等. 典型养殖湖泊大通湖软体动物的时空分布格局[J]. 水生生物学报, 2011, 35(1): 946– 954.
[28] 由文辉, 尤力群. 淀山湖软体动物群落的研究[J]. 华东师范大学学报(自然科学版), 1998(1): 103–109.
[29] 陈其羽, 梁彦龄, 宋贵保, 等. 武昌东湖软体动物的生态分布及种群密度[J]. 水生生物学集刊, 1975, 5(3): 371– 379.
[30] 陈其羽. 湖北省花马湖软体动物的调查报告[J]. 海洋与湖沼, 1979, 10(1): 46–62.
[31] HEINO J, GRÖNROOS M. Exploring species and site contributions to beta diversity in stream insect assemblages[J]. Oecologia, 2017(183): 151–160.
[32] RICOTTA C. Of beta diversity, variance, evenness, and dissimilarity [J]. Ecology and Evolution, 2017(7): 4835– 4843.
[33] PHILIP S B, SAUL A C, ADRIAN D M, et al. The spatial scaling of beta diversity[J]. Global Ecology and Biogeography. 2013(22): 639–647.
Analysis of the beta diversity of snails in the lakes of mid-lower reaches of the Yangtze River
WANG Weigen
School of Biology and Food Engineering of Fuyang Teachers College, Fuyang 236037, China
In this study, two kinds of partitioning measures were used to analyze the beta diversity of the snails in the lakes of mid-lower reaches of the Yangtze River. The first method proposed by Legendre was to explore the individual species contribution to total beta diversity (SCBD) and the single lake contribution to total beta diversity (LCBD). The results showed that the snail distributed in middle number of lakes, such as the, had the highest SCBD value, and the relationship between the number of lakes occupied by the snail and its SCBD value was hump-shaped. The Huama Lake had the highest LCBD value. There were no significant correlations between the LCBD values and the number of snail species in the same lake. The second approach proposed by Baselga was to partition turnover and nestedness components of beta diversity. Based on multiple-site analysis method, the results indicated that the turnover was main reason contribute to total beta diversity. In the case of pairwise patterns, the proportion of turnover and nestedness was different depended on the pair of lakes. There were some complete turnover and complete nestedness patterns between two lakes.
lake; snail; beta diversity; turnover; nestedness
10.14108/j.cnki.1008-8873.2018.06.016
Q958
A
1008-8873(2018)06-122-09
2017-11-24;
2018-01-18
安徽高校省级自然科学研究一般项目(2015KJ004); 阜阳师范学院自然科学研究项目(2015FSKJ01ZD)
王魏根(1975-), 男, 安徽宣城人, 硕士, 讲师, 主要从事水生动物学研究. E-mail: wweigen@163.com
王魏根. 长江中下游湖泊螺类beta多样性分析[J]. 生态科学, 2018, 37(6): 122-130.
WANG Weigen. Analysis of the beta diversity of snails in the lakes of mid-lower reaches of the Yangtze River[J]. Ecological Science, 2018, 37(6): 122-130.
