硝普钠(SNP)浸种对渗透胁迫下不同紫花苜蓿种子萌发生理特性的影响
2019-01-09魏小红马文静骆巧娟宿梅飞
赵 颖,魏小红,马文静,骆巧娟,宿梅飞
(甘肃农业大学生命科学技术学院,甘肃 兰州 730070)
紫花苜蓿(Medicagosativa)是我国西北地区广泛种植的优质豆科牧草,具有广泛的生态适应性,被誉为“牧草之王”[1],对我国畜牧业的可持续发展起到重要作用[2-3]。尽管紫花苜蓿对水分适应性强,但在种子萌发期干旱会抑制其萌发[4],进而对生长发育后期的生物量造成严重的影响。因此,探讨紫花苜蓿种子萌发过程中的适应机制显得至关重要。
NO是一种重要的信号分子,可以缓解非生物胁迫下植物体内ROS的积累,减少各种胁迫造成的氧化损伤,从而增强植物的适应能力[5];同时还可以促进种子萌发、下胚轴伸长[6],影响植物组织的生长[7],并参与调节干旱胁迫、盐害及抗病能力[8],对植物的生长发育具有重要影响。在植物体内NO主要通过一氧化氮合酶(NOS,EC1.6.6.1/2)和硝酸还原酶(NR,EC1.6.61/2)催化形成[9-10],内源NO的产生受植物物种、组织、细胞类型及环境条件等多种因素影响[11]。硝普钠(SNP)是一种重要的NO供体,Delledonne等[12]报告0.5 mmol·L-1SNP释放约2.0 μmol·L-1NO。增施外源NO可提高内源NO水平,有关研究表明外源NO对细胞凋亡、激素调控、光合作用和各种胁迫响应等许多重要生理过程具有调节作用[13-15],同时还可以诱导抗氧化活性,增加相关基因的转录本[16]。
植物的抗逆能力随个体发育阶段不同而发生变化[17],种子萌发期往往是对逆境胁迫十分敏感的时期[18],这一时期的特性决定了该植物在某一地区是否能够成功建苗。有关苜蓿生态适应性的研究和报道已有很多,研究方向也逐渐从形态水平过渡到生理生化及分子水平[19-22]。研究表明植物胁迫耐受性幅度与内源性NO的水平呈正相关,抗性强的品种PEG胁迫后NO产生量较大,而抗旱敏感型相反[23]。目前,渗透胁迫下外源NO对不同品种紫花苜蓿萌发期的影响还未见报道。本研究以紫花苜蓿品种阿尔冈金、金皇后和三得利为材料,研究外源NO对干旱胁迫下紫花苜蓿种子萌发过程中渗透调节物质、抗氧化酶活性的变化规律,探讨干旱胁迫下NO对苜蓿种子萌发的调控机制,以期为干旱地区紫花苜蓿的选种栽培、应用化学途径提高耐旱性提供理论依据。
1 材料与方法
1.1 试验材料与处理
供试材料为紫花苜蓿,分别为品种A:阿尔岗金,品种B:金皇后,品种C:三得利,购于甘肃省农业科学院。
试验选取均匀饱满的苜蓿种子,用20% NaClO溶液消毒10 min,去离子水冲洗5次,分别用去离子水和0.1 mmol·L-1SNP溶液在黑暗条件下浸泡48 h。将预处理后的种子置于垫有双层滤纸的培养皿(φ=9 cm)中,每皿50粒种子,每处理重复三次,2 d后进行干旱胁迫,共设置以下4个处理:蒸馏水为空白对照(CK);0.1 mmol·L-1SNP(SNP);10% PEG-6000 (PEG);0.1 mmol·L-1SNP+10% PEG-6000 (SNP+PEG)。按试验设计每天10∶00更换4 mL处理液以确保浓度一致。所有培养皿培养条件为:(25±1)℃;80%相对湿度;光照/黑暗:12 h/12 h;光照强度400 μmol·m-2·s-1。分别在处理的0、2、4、6 d测定相关生理指标。
1.2 测定指标与方法
1.2.1 丙二醛(MDA)含量 采用硫代巴比妥酸(TBA)比色法测定[24]。
1.2.2 渗透调节物质 脯氨酸(Pro)含量采用酸性水合茚三酮法[25],可溶性糖含量采用蒽酮比色法[24],可溶性蛋白含量采用考马斯亮蓝G-250法[26]测定。
1.2.3 抗氧化酶的活性 超氧化物歧化酶(SOD)活性参照Liu等[27]的方法测定;过氧化物酶(POD)活性参照Shi等[28]的方法测定;抗坏血酸过氧化物酶(APX)活性参照Nakano和Asada[29]的方法测定;过氧化氢酶(CAT)活性参照Aebi[30]的方法测定。
1.3 数据分析
试验数据采用Microsoft Excel 2010进行处理及作图,用SPSS 19.0软件Duncan法进行统计学分析,数据显示均为“平均值±SE”表示,字母不同表示差异有统计学意义。
2 结果与分析
2.1 SNP溶液浸种对PEG胁迫下紫花苜蓿种子MDA含量的影响
如图1所示,PEG胁迫下3个品种紫花苜蓿种子中MDA含量随着胁迫时间的延长均逐渐升高,SNP+PEG能有效抑制MDA的增加。在第6 d时,C品种MDA含量有最大值14.35 μmol·g-1,是品种A和B的1.32倍,与PEG处理相比,SNP+PEG处理下A、B、C品种MDA含量分别下降了23.11%,21.81%和30.38%。由此可见,渗透胁迫下品种C中MDA积累量最大,抵御渗透胁迫能力较弱,但SNP浸种对其氧化损伤的缓解作用最强。
2.2 SNP溶液浸种对PEG胁迫下紫花苜蓿种子渗透调节物质含量的影响
由表1可知,0 d时各处理之间脯氨酸含量无显著差异,随PEG胁迫时间的延长,3品种紫花苜蓿种子萌发过程中脯氨酸含量先增后降。处理第4 d时,脯氨酸含量达到最大值,A、B和C含量分别为460.95,262.68 μg·g-1和277.18 μg·g-1,SNP+PEG比PEG处理A、B、C品种脯氨酸分别增加了13.71%、16.46% 和 17.87%。
从表1可知,与CK相比,PEG胁迫下可溶性糖含量降低,紫花苜蓿种子萌发过程中可溶性糖含量呈先增后降的变化趋势。SNP浸种提高了紫花苜蓿种子中可溶性糖含量。处理第2 d时,品种A可溶性糖含量最高,为27.48 mg·g-1,分别是品种B和C的4.82倍和2.42倍,SNP+PEG与PEG处理相比,A、B、C品种可溶性糖含量分别增加了15.78%、16.84%和17.52%。处理第6 d时,SNP+PEG比PEG处理使A、B、C 3个品种可溶性糖含量分别提高了40.24%、20.34%和14.24%。
可溶性蛋白含量的变化与可溶性糖相似。由表1可知,各品种紫花苜蓿种子萌发过程中可溶性蛋白含量呈先增后降趋势,金皇后与三得利在第2 d达到最大值,阿尔岗金在第4 d达到最大值。PEG胁迫比CK可溶性蛋白含量显著降低,在第2,4,6 d的下降幅度均为品种A>品种B>品种C。SNP+PEG与PEG处理相比显著增加了可溶性蛋白的含量,且在第6 d增加量最大,A、B、C品种可溶性蛋白含量在SNP+PEG处理下分别是PEG处理下的2.25、1.31、1.16倍。
2.3 SNP溶液浸种对PEG胁迫下紫花苜蓿种子抗氧化酶活性的影响
2.3.1 SOD活性 如图2所示,苜蓿种子萌发期SOD活性随干旱胁迫时间的延长呈先增后降趋势,且在处理第4 d活性最大。SNP处理下苜蓿种子萌发过程中SOD活性最大,SNP+PEG比PEG处理显著提高了SOD活性。在处理第4 d,A、B、C品种SNP+PEG比PEG处理SOD活性分别显著提高了12.84%、8.65%和35.49%,说明品种C中 SOD活性受外源NO影响较大。
2.3.2 POD活性 如图3所示,苜蓿种子POD活性变化趋势与SOD活性相似,呈先升后降趋势且于处理第4 d达到最大值。与CK相比,PEG处理使POD活性降低,施加外源NO缓解了该抑制作用。处理第4 d,A、B、C品种POD活性分别较CK增加了53.99%,54.24%和65.56%,说明SNP对POD活性调控作用较大。
2.3.3 CAT活性 如图4所示,CAT活性随着发芽时间的延长逐渐升高,在处理第4 d达到最大值。品种A在第2 d和6 d时处理间无差异,在处理第4 d,SNP+PEG处理与CK相比无显著差异,但较PEG处理CAT活性提高了17.31%。品种B在处理第2 d和第4 d SNP+PEG与SNP处理CAT活性差异不显著,与PEG处理相比分别提高了19.96%和17.35%。品种C在处理第4 d和第6 d SNP+PEG比PEG处理CAT活性提高了12.80%和40.86%。

注:同一处理时间不同字母表示差异显著(P<0.05),下同。Note:The different letters in the same treatment time group mean significant difference at P<0.05,the same below.图1 SNP溶液浸种对PEG胁迫下紫花苜蓿种子萌发过程中MDA含量的影响Fig.1 Effects of SNP acid on MDA contents during seed germination of alfalfa under PEG stress

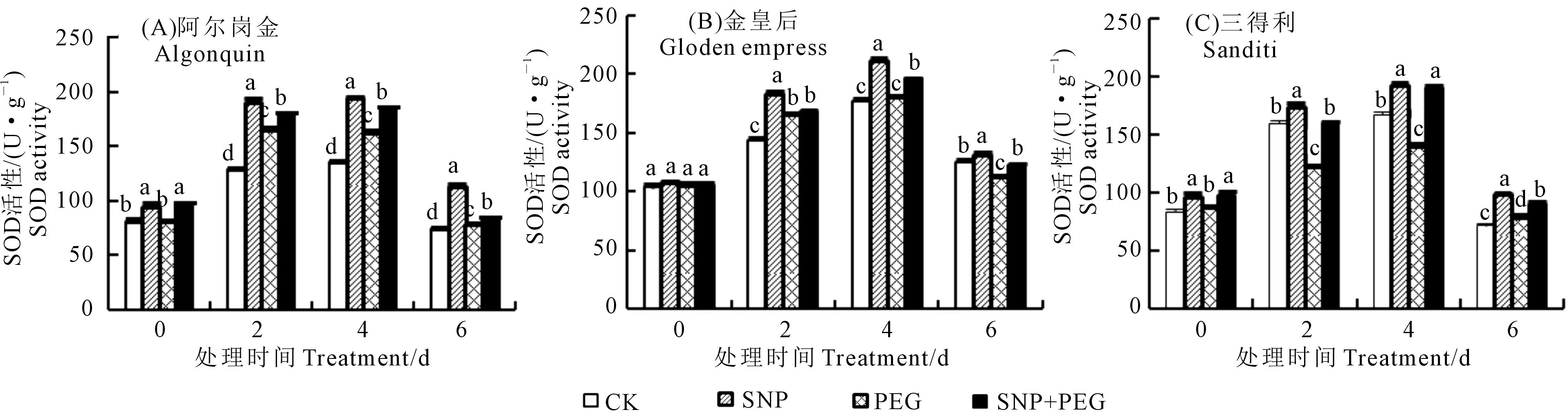
图2 SNP溶液浸种对PEG胁迫下紫花苜蓿种子萌发过程中SOD活性的影响Fig.2 Effects of SNP acid on SOD activity during seed germination of alfalfa under PEG stress

图3 SNP溶液浸种对PEG胁迫下紫花苜蓿种子萌发过程中POD活性的影响Fig.3 Effects of SNP acid on POD activity during seed germination of alfalfa under PEG stress
2.3.4 APX活性 由图5可知,紫花苜蓿种子萌发过程中APX活性呈先增高后降低的变化趋势,CK除外,SNP+PEG处理APX活性最高。在处理第2 d,品种A中APX活性在SNP、PEG、SNP+PEG处理下是CK的1.58、2.16倍和2.33倍,处理第4 d,SNP+PEG较PEG处理APX活性提高了37.72%。品种B在处理第4 d SNP+PEG比PEG处理APX活性提高了47.09%。品种C在处理第4 d SNP与PEG处理间差异不显著,SNP+PEG比PEG处理APX活性提高了34.87%。
2.4 不同处理及不同PEG胁迫时间对3个品种紫花苜蓿抗性的影响
通过对各品种紫花苜蓿不同处理、不同PEG胁迫时间下各生理指标进行多因素方差分析可知,在紫花苜蓿种子萌发过程中经SNP处理后,3个苜蓿品种中可溶性糖、可溶性蛋白含量及SOD、POD、CAT活性最高。SNP+PEG较SNP处理,可溶性蛋白含量、SOD、POD、CAT活性均显著下降;MDA含量变化表现为:阿尔岗金和三得利品种为PEG>SNP+PEG>SNP,且差异显著;而金皇后品种表现为PEG处理时MDA含量最高,施加外源NO缓解了MDA积累。阿尔岗金与金皇后中脯氨酸含量各处理间差异显著,而三得利中脯氨酸含量与前两种含量变化趋势相同。APX酶活性在SNP+PEG处理下最高。通过以上分析可知,施加外源NO能够显著提高干旱胁迫下紫花苜蓿种子抗氧化酶活性,缓解膜脂过氧化,提高种子的抗旱性。

图5 SNP溶液浸种对PEG胁迫下紫花苜蓿种子萌发过程中APX活性的影响Fig.5 Effects of SNP acid on APX activity during seed germination of alfalfa under PEG stress
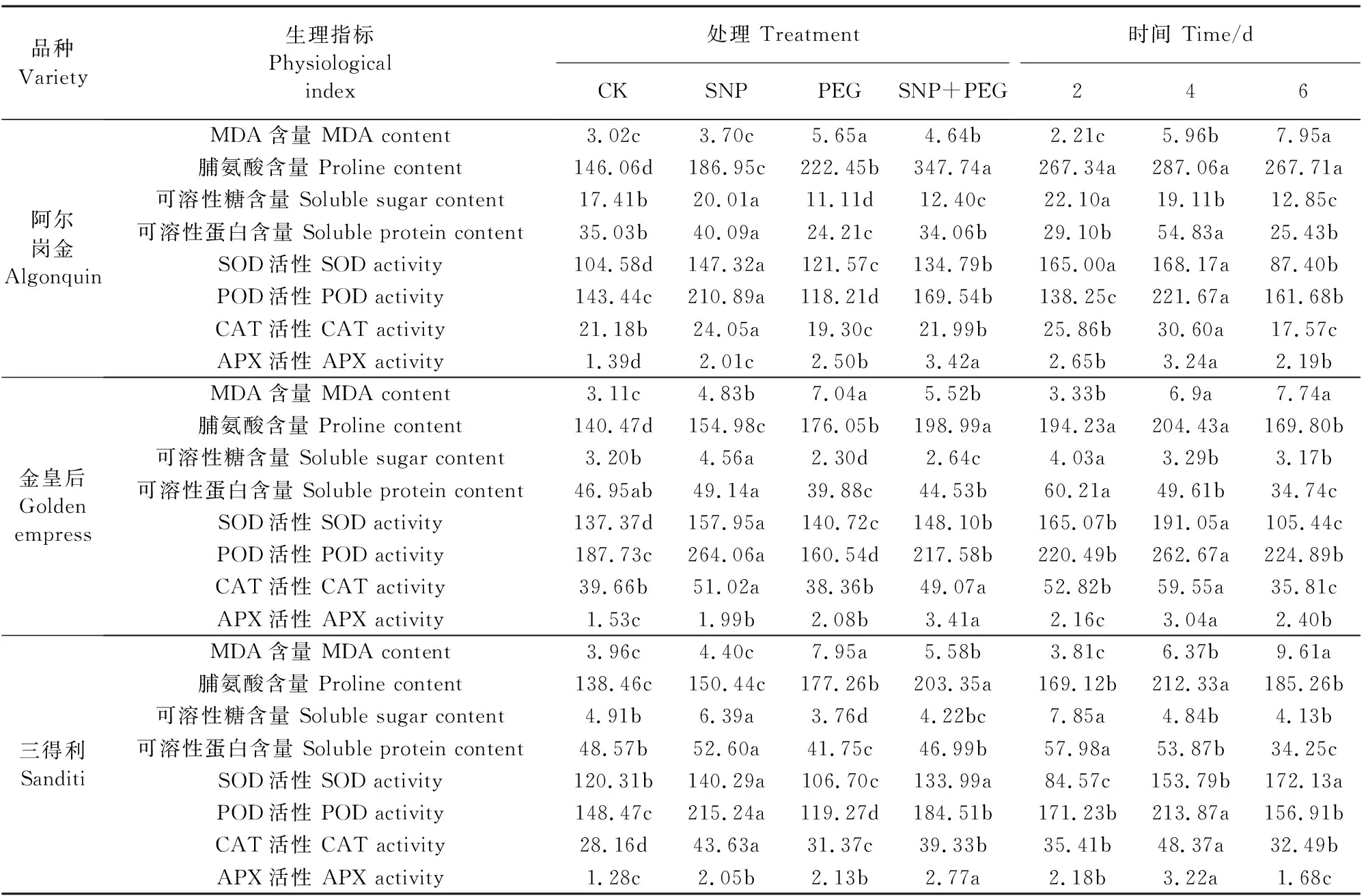
品种Variety生理指标Physiologicalindex处理 TreatmentCKSNPPEGSNP+PEG时间 Time/d246阿尔岗金AlgonquinMDA含量 MDA content3.02c3.70c5.65a4.64b2.21c5.96b7.95a脯氨酸含量 Proline content146.06d186.95c222.45b347.74a267.34a287.06a267.71a可溶性糖含量 Soluble sugar content17.41b20.01a11.11d12.40c22.10a19.11b12.85c可溶性蛋白含量 Soluble protein content35.03b40.09a24.21c34.06b29.10b54.83a25.43bSOD活性 SOD activity104.58d147.32a121.57c134.79b165.00a168.17a87.40bPOD活性 POD activity143.44c210.89a118.21d169.54b138.25c221.67a161.68bCAT活性 CAT activity21.18b24.05a19.30c21.99b25.86b30.60a17.57cAPX活性 APX activity1.39d2.01c2.50b3.42a2.65b3.24a2.19b金皇后GoldenempressMDA含量 MDA content3.11c4.83b7.04a5.52b3.33b6.9a7.74a脯氨酸含量 Proline content140.47d154.98c176.05b198.99a194.23a204.43a169.80b可溶性糖含量 Soluble sugar content3.20b4.56a2.30d2.64c4.03a3.29b3.17b可溶性蛋白含量 Soluble protein content46.95ab49.14a39.88c44.53b60.21a49.61b34.74cSOD活性 SOD activity137.37d157.95a140.72c148.10b165.07b191.05a105.44cPOD活性 POD activity187.73c264.06a160.54d217.58b220.49b262.67a224.89bCAT活性 CAT activity39.66b51.02a38.36b49.07a52.82b59.55a35.81cAPX活性 APX activity1.53c1.99b2.08b3.41a2.16c3.04a2.40b三得利SanditiMDA含量 MDA content3.96c4.40c7.95a5.58b3.81c6.37b9.61a脯氨酸含量 Proline content138.46c150.44c177.26b203.35a169.12b212.33a185.26b可溶性糖含量 Soluble sugar content4.91b6.39a3.76d4.22bc7.85a4.84b4.13b可溶性蛋白含量 Soluble protein content48.57b52.60a41.75c46.99b57.98a53.87b34.25cSOD活性 SOD activity120.31b140.29a106.70c133.99a84.57c153.79b172.13aPOD活性 POD activity148.47c215.24a119.27d184.51b171.23b213.87a156.91bCAT活性 CAT activity28.16d43.63a31.37c39.33b35.41b48.37a32.49bAPX活性 APX activity1.28c2.05b2.13b2.77a2.18b3.22a1.68c
对处理时间进行多因素方差分析可知,3品种紫花苜蓿种子SOD、POD、CAT和APX酶活性均在第4 d时最强,而三得利种子SOD活性在萌发的第6 d表现最强;MDA含量随着干旱胁迫时间增加而逐渐增大,不同时间点差异显著,三得利品种MDA含量最大。脯氨酸含量变化表现为:3个品种都在第4 d时有最大值,但阿尔岗金在各时间点无差异显著性。金皇后和三得利品种在可溶性糖和可溶性蛋白含量上差异显著性表现相同,在处理第2 d值最大。
3 讨 论
本试验研究外源NO对干旱胁迫下不同紫花苜蓿的调控及其与抗性的关系。结果表明,0.1 mmol·L-1SNP浸种可明显降低干旱胁迫下紫花苜蓿种子萌发过程中MDA的含量,且随着干旱胁迫时间的增加MDA含量增大,各处理MDA含量差异增大。三得利品种MDA含量最大,说明其抗旱性最弱,阿尔岗金抗旱性最强,这与穆怀彬等[31]的研究一致。在萌发的第4 d三个品种各处理间均差异显著,渗透胁迫下施加SNP对三得利MDA含量缓解作用最强。综上所述,三得利比其他两个品种能更加敏感地感知外源NO。脯氨酸的积累是植物对逆境胁迫的一种重要保护机制,能够清除ROS并提高抗氧化能力[32]。刘文瑜等[5]研究表明盐胁迫下蒺藜苜蓿种子萌发过程中脯氨酸含量显著上升,不同浓度SNP处理能够缓解盐胁迫对种子的伤害,提高脯氨酸含量,其中以0.1 mmol·L-1SNP缓解效果最佳。本试验0.1 mmol·L-1SNP能显著缓解干旱胁迫下紫花苜蓿萌发过程中的氧化损伤,干旱胁迫下阿尔岗金品种脯氨酸含量最多,金皇后次之,三得利最少,但PEG胁迫下施加SNP后脯氨酸含量的提高率相反。这说明阿尔岗金自身渗透调节能力较强,能够很好地抵御外界环境伤害。三得利自身调节能力弱于阿尔岗金,但其渗透调节物质受外源SNP影响较大,此结果与MDA含量变化相一致。
种子萌发的过程需要大量的能量维持其生命活动[33],种子的营养成分主要包括糖类、脂肪和蛋白质,当种子发芽时这些贮藏物质转化为小分子物质,为胚的生长发育提供所必须的养料和能量[34-36]。本试验中可溶性糖和可溶性蛋白含量呈先增后降趋势,反映了种子萌发过程中消耗能量的过程,不同品种紫花苜蓿萌发过程中可溶性糖和可溶性蛋白所占比例不同,阿尔岗金种子可溶性糖含量是另两个品种的3~4倍,可能与种子自身营养物质组成有关,但可溶性蛋白含量相比较低,这说明种子萌发过程中先消耗糖类物质,能量不足时才会消耗蛋白质。可溶性糖和可溶性蛋白作为渗透调节物质其含量变化在一定程度上反映了植物体内代谢变化情况,逆境胁迫下可溶性糖和可溶性蛋白含量的增加有利于植物抵御胁迫造成的伤害。干旱胁迫下施加SNP后,阿尔岗金可溶性蛋白含量增加的最多,可溶性糖含量增幅少;金皇后品种可溶性蛋白含量增幅少,但可溶性糖含量增幅最多;三得利品种的变化均介于其它两个品种之间。说明SNP调节种子萌发过程中抵御逆境的能力受品种自身营养成分构成的影响。
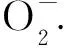
综上所述,紫花苜蓿种子的萌发过程MDA、Pro、可溶性糖和蛋白质、抗氧化酶的变化证明了种子萌发的系统性。SNP浸种能够在一定程度上拮抗PEG,减少逆境伤害,但不同品种紫花苜蓿对SNP的敏感性存在一定的差异。SNP对种子萌发过程的影响是一个复杂的体系,单一指标很难说明某个品种对NO信号的敏感性,对此本研究综合多个与抗旱性密切相关的指标做多因素方差分析,结果表明阿尔岗金抗旱性最强,但其对外源NO的响应能力最弱,三得利品种抗旱性最弱,其对NO的感知敏感性最强。推测这是因为不同品种对干旱作出应答的灵敏度和准确性不同,而植物细胞中內源NO的产生水平也会干扰外源NO信号的传递。本研究初步确定外源NO对紫花苜蓿萌发期抗性的调控作用与品种自身特性有关,但各品种在不同生育阶段对某一具体指标的耐性反应不一定相同,今后可对各品种不同生育期外源NO的调控机理进行研究和探讨, 为旱区紫花苜蓿栽培提供理论依据。
