烟草中蛋白激酶基因NtCIPK3的表达载体构建及表达分析
2019-01-09杨尚谕李佳皓李立芹
陈 倩,杨尚谕,卓 维,李佳皓,彭 双,王 静,李立芹
(1.四川农业大学 农学院,四川 成都 611130;2. 作物科学国家级实验教学示范中心,四川 成都 611130)
Ca2+是植物细胞中普遍存在的第二信使,当植物受到外界刺激后,使细胞内Ca2+的浓度发生变化,形成钙信号。在与钙传感蛋白结合后,能够将钙信号转导到下游效应蛋白,引起植物细胞的生理生化反应,从而参与到植物的生长发育及胁迫应答等过程[1]。类钙调磷酸酶B亚基蛋白CBL(Calcineurin B-like proteins)是其中一类钙传感蛋白,能够高效地与Ca2+结合,并引起构象变化,但该蛋白缺乏其他必要的协助结构域,因此,其必须与目标蛋白CIPK(CBL-interacting protein kinase)结合形成CBL-CIPK 复合体才能实现钙信号的转导[2]。
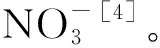
CIPK 家族是植物特有的一类丝氨酸/苏氨酸蛋白激酶[11],该类蛋白由N-末端激酶结构域和C-末端调控结构域组成。N-末端行使催化功能,C-末端调控CIPK的激活功能。同时,C-末端还具有与CBLs相互作用所需的保守NAF/FISL基序,少数还存在与2C型蛋白磷酸酶(PP2C)互作所需的PPI结构域[12]。CIPK作为细胞内钙信号系统的一员,在植物逆境应答[13]、ABA 信号转导[14]、营养吸收和生长发育过程中具有重要作用[15-16]。
CIPK家族的研究目前主要集中在模式植物和主要农作物上,如拟南芥[17]、水稻[18]、玉米[19]。随着更广泛的基因组序列研究,CIPK家族已经在各种植物的基因组中被分离和鉴定。如在木薯中,共鉴定了CIPK家族中的25个成员[20],在大豆中发现52个CIPK家族基因[21]。但是,目前关于烟草CIPK基因的鉴定和研究较少。
为此,本研究根据同源克隆的方法,从普通烟草K326中克隆到1个CIPK3基因,运用生物信息学方法对序列特征、进化规律等进行了分析。同时,运用qRT-PCR技术,对该基因的组织表达、逆境响应进行了系统分析。并利用双酶切法成功构建了pBI121-NtCIPK3过表达载体,旨在为进一步揭示CIPK3基因在烟草抗性机制中的生物学功能奠定基础。
1 材料和方法
1.1 试验材料及试剂
供试烟草品种为普通烟草品种 K326。采用漂浮育苗的方法进行育种,生长60 d后,分别对烟株的根、茎、叶进行取样。待其生长至盛花期,再对花进行取样。所有采集的样品均需在液氮中速冻1 min后,放置-80 ℃冰箱中以供后续使用。
将烟草品种K326种子进行表面消毒,均匀地布种到MS培养基上,15 d后将幼苗置于不同的培养基上进行试验处理,试验共设对照(MS培养基,CK)、低钾处理(含钾量为10 μmol/L的MS培养基)、模拟干旱(含5% PEG-6000的MS培养基)、盐胁迫(含200 mmol/L NaCl的MS培养基)、ABA处理(含1 μmol/L ABA的MS培养基)、H2O2处理(含10 mmol/LH2O2的MS培养基)。低温处理(MS培养基)是将15 d龄的幼苗置于 4 ℃光照培养箱中。上述处理,在处理后0,3,6,12,24 h对烟草幼苗进行整株取样。立即放入液氮中速冻1 min后,保存在-80 ℃冰箱备用。
选用宝生物工程(大连)有限公司的TRIzol试剂、高保真酶、限制性内切酶、PrimeScript RT reagent Kit、cDNA合成试剂盒、SYBR Green Master mix等,通用型DNA纯化回收试剂盒购自天根生化科技(北京)有限公司,DH5α大肠杆菌感受态购于北京全式金生物技术有限公司,引物合成与测序由上海生工生物工程有限公司完成。
1.2 试验方法
1.2.1 烟草NtCIPK3基因的克隆及过表达载体构建 参考GenBank收录的林烟草CIPK3序列(XM_009774691.1),根据同源物种的保守区域,利用Primer 5.0软件设计引物NtCIPK3-F:5′-TCTAGAAT GAATCGGGCAAAAATCAA-3′(划线部分为XbaⅠ酶切位点)和NtCIPK3-R:5′-CCCGGGTTATTTTGGA AGTTTAGCCG-3′(划线部分为SmaⅠ酶切位点)。扩增体系及程序按文献[22]进行,对目的基因进行克隆。
PCR扩增目的片段经纯化后与过表达载体pBI121用XbaⅠ和SmaⅠ进行双酶切,在16 ℃下连接过夜,将连接产物通过热激法转入大肠杆菌DH5α感受态,随后在含有卡那霉素的LB平板上进行抗性筛选,挑取阳性单克隆,进行菌落PCR检测验证,并将所对应的阳性克隆送至上海生工生物工程有限公司进行测序。
1.2.2 烟草NtCIPK3基因生物信息学分利用Prot Param在线工具分析NtCIPK3基因编码蛋白的理化性质;蛋白同源性比对以及疏水性分析,运用DNAMAN软件进行;蛋白跨膜结构,利用TMHMM Server v. 2.0工具进行分析;蛋白保守结构分析,利用NCBI的CDD结构域分析工具;蛋白二级结构预测,应用IBCP的在线工具SOPMA;蛋白的三级结构特性,利用SWISS-MODEL软件在线预测,结果在Ras Top软件中查看;应用在线程序PSORT预测NtCIPK3的亚细胞定位;利用NLS Mapper软件在线预测该基因的核定位信号;利用Clustal 2.1和MEGA 5软件,使用邻近法模式构建系统进化树,具体参数设置见参考文献[23]。
1.2.3 烟草NtCIPK3基因的表达分析 根据NtCIPK3基因测序结果作为依据,设计qRT-PCR引物NtCIPK3-qF:5′-ATGAATCGGGCAAAAATCAAGCGT A-3′和NtCIPK3-qR:5′-CGTTTCTCGCTTGAATCCCT-3′,选用烟草组成型表达基因18S rRNA作为内参,以烟草不同组织和不同处理下的幼苗cDNA为模板,进行基因表达模式分析,内参引物序列参照文献[24]。反应程序如下:50 ℃反应2 min,95 ℃预变性3 min;95 ℃变性10 s,65 ℃延伸45 s,共39个循环。所有的样品均设置3次生物学重复,基因的相对表达水平用2-ΔΔCt方法计算,运用Excel 2013进行统计学分析。
2 结果与分析
2.1 NtCIPK3基因的克隆及过表达载体的构建
以烟草总RNA反转录合成的cDNA为模板进行PCR扩增,琼脂糖凝胶电泳结果显示,在1 000~1 500 bp的位置上有清晰明亮的条带(图1-A),经测序结果显示,该目的片段长度为1 272 bp,与预期的目的片段大小相符。
将PCR扩增产物纯化后和pBI121载体分别进行双酶切,将连接产物通过热激法转入大肠杆菌DH5α感受态。挑取阳性克隆,对连接产物进行菌落PCR验证,结果显示,在1 000~1 500 bp的位置上有清晰的条带(图1-B)。将筛选出的阳性克隆提取质粒送至上海生工生物工程有限公司进行测序,测序结果显示,该目的片段大小为1 272 bp,表明pBI121-NtCIPK3过表达载体构建成功。

A.NtCIPK3基因PCR产物电泳;B.NtCIPK3基因菌落PCR电泳。M.Marker;1-8.NtCIPK3基因。A. NtCIPK3 PCR product electrophoresis; B.NtCIPK3 gene colony PCR electrophoresis.M.Marker; 1-8.NtCIPK3 gene.
2.2 目的基因的生物信息学分析
2.2.1NtCIPK3编码蛋白的理化性质及跨膜结构分析 运用ExPASy ProtParamtool软件,对NtCIPK3蛋白的理化性质进行在线分析,结果如表1所示,NtCIPK3蛋白由20种氨基酸组成,共包含423个氨基酸残基,总的疏水性平均系数为-0.417。平均疏水系数小于0,可以预测该蛋白是亲水性蛋白。蛋白的不稳定系数是34.04,说明它是一个稳定蛋白。运用TMHMM 2.0对目的基因编码蛋白的跨膜区进行预测分析,结果表明(图2),该基因所编码的蛋白在197-214位氨基酸残基间含有1个跨膜区,推测NtCIPK3为膜蛋白。
2.2.2 NtCIPK3蛋白的亚细胞定位、核定位信号及磷酸化位点分析 通过在线PSORT工具,对NtCIPK3蛋白的亚细胞定位进行预测。结果显示,定位在细胞核中的概率为39.1%,在线粒体中的概率为26.1%,在细胞质中的概率为21.7%,分别有4.3%的概率定位于液泡、囊泡分泌系统以及过氧化物酶体。表明NtCIPK3定位于细胞核的可能性最大。所以,利用NLS Mapper软件进一步分析,在线预测该基因的核定位信号,在第5和第53个氨基酸之间有双分型的NLS序列KIKRRVGKYEVGRTIGEGTFAKV KFARNS、EGTFAKVKFARNSETGENVAIKILDKDKVL KHK,说明该蛋白能通过主动转运进入细胞核,初步说明该蛋白是核蛋白。利用NetPhos 3.1 Server在线工具对NtCIPK3蛋白中存在的Ser、Thr和Tyr残基的磷酸化位点进行预测分析,结果显示(图3),NtCIPK3中包含15个Ser磷酸化位点、7个Thr磷酸化位点和3个Tyr磷酸化位点。这些氨基酸磷酸化位点可能在维持 NtCIPK 蛋白的空间结构及参与一系列生理生化过程的调控中起关键作用。

表1 NtCIPK3蛋白理化性质分析Tab.1 Analysis of physicochemical properties of NtCIPK3
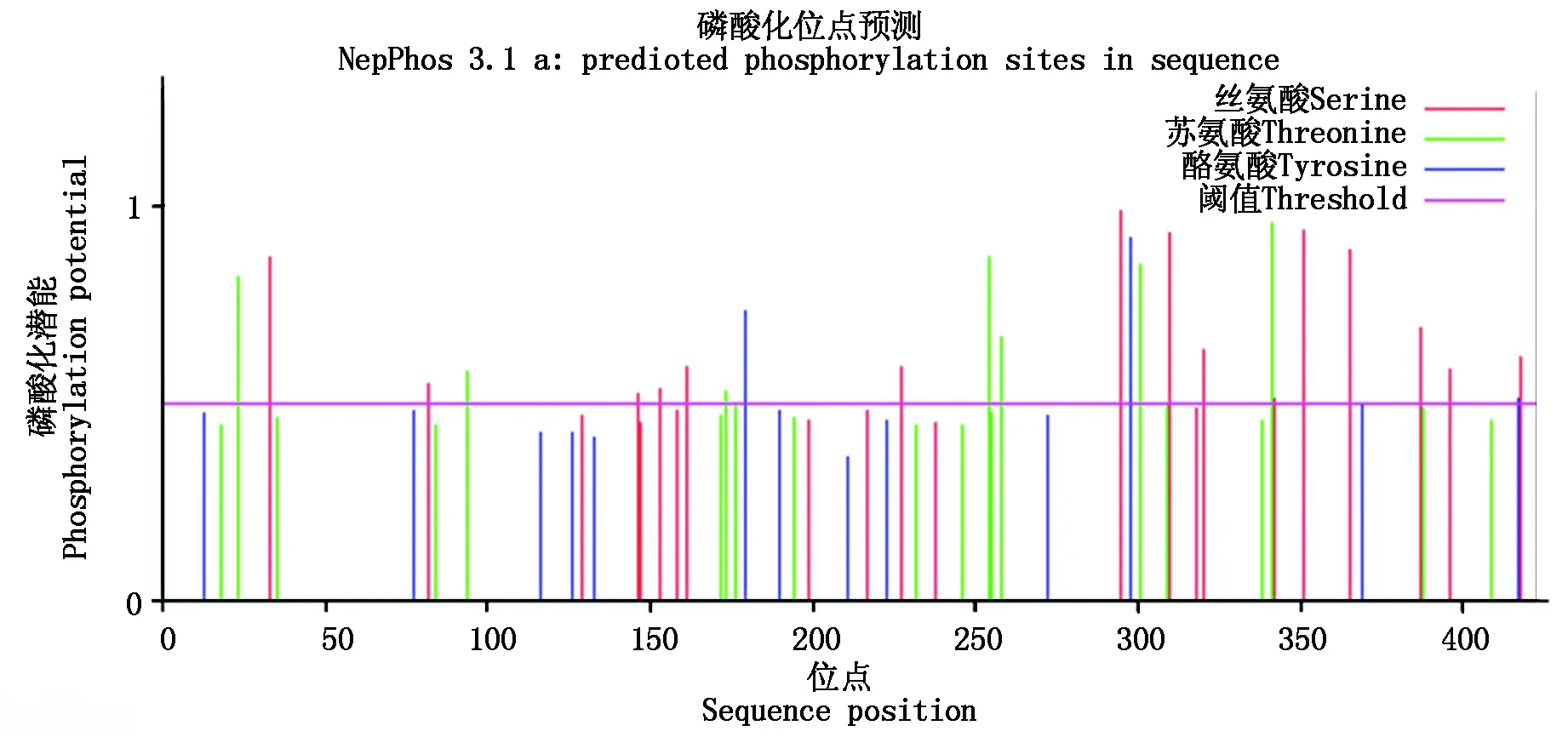
图3 NtCIPK3中的磷酸化位点分析Fig.3 Predicted phosphorylation site in NtCIPK3
2.2.3 NtCIPK3蛋白二级结构及三级结构分析 运用IBCP的在线工具SOPMA对NtCIPK3蛋白二级结构进行预测,结果表明(图4-A),该蛋白所含二级结构单元从高到低依次为α-螺旋37.35%,无规则卷曲29.79%,延伸链20.33%,β-转角所占比例最低为12.53%。由此推测,α-螺旋以及无规则卷曲是构成NtCIPK3蛋白的主要结构,β-折叠含量较少。利用SWISS-MODEL和RasTop在线软件对NtCIPK3的三级结构进行预测,结果显示(图4-B),该蛋白三级结构较为复杂,预示着蛋白功能的复杂性。
2.2.4 NtCIPK3同源性分析及保守结构域分析 将NtCIPK3氨基酸序列与其他植物中CIPK3蛋白序列进行同源性进化分析,结果表明(图5-A),NtCIPK3与野生烟草CIPK3、绒毛状烟草CIPK3、辣椒CIPK3等氨基酸序列同源性较高,分别为99%,99%和96%,与梅花CIPK3的同源性最低,为84%。由图可知,烟草与马铃薯、番茄等聚成一类,而梅花等单独一组,NtCIPK3与茄科植物的亲缘关系较近且进化同步,表明该基因在物种进化中可能较为保守。保守结构域分析表明(图5-B),该蛋白的第13-268位氨基酸区域是蛋白激酶结构域,其中155-185位氨基酸区域是激活环区域;从288-421位氨基酸区域是该蛋白的调控结构域,其中310-331位氨基酸区域是NAF结构域,这个结构域是CIPK家族蛋白与CBL蛋白相互作用的部位。
A.NtCIPK3蛋白二级结构预测;B.NtCIPK3蛋白三维结构预测。A. NtCIPK3 protein secondary structure prediction; B. NtCIPK3 protein three-dimensional structure prediction.

A.NtCIPK3蛋白系统进化树;B.NtCIPK3蛋白保守结构域分析。A.NtCIPK3 protein phylogenetic tree;B.NtCIPK3 protein conserved domain analysis.
2.3 NtCIPK3的组织表达分析
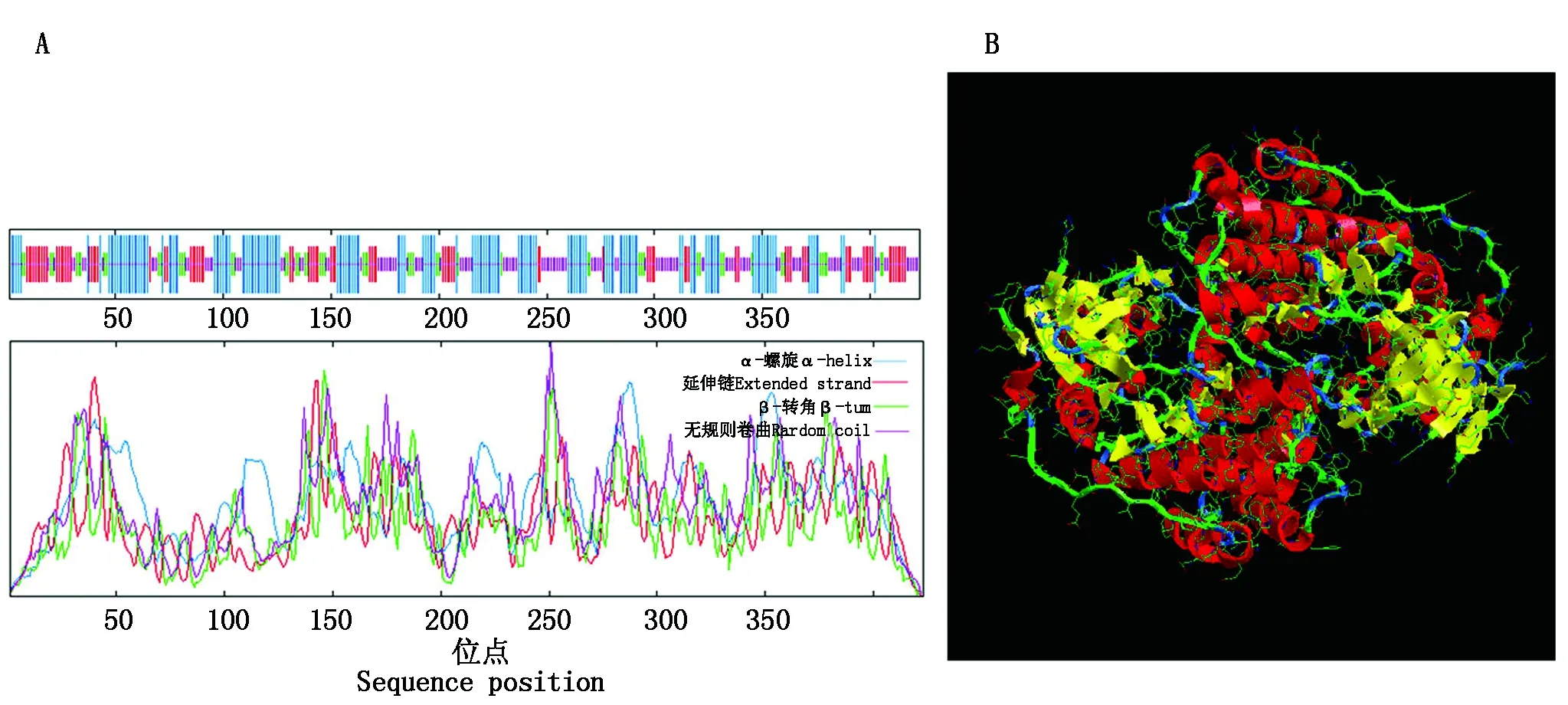
通过qRT-PCR技术,研究该基因在烟草K326品种不同组织中的表达情况,结果显示(图6),NtCIPK3的表达量大小依次为叶>茎>根>花,在叶中的表达量为花中表达量的6.32倍,根中表达量的5.61倍,茎中表达量的3.56倍。表明NtCIPK3基因在烟草的各个组织中均有表达,但在叶中表达水平最高,推测可能主要在叶中行使功能。
2.4 逆境胁迫及信号分子处理下NtCIPK3的表达分析
采用qRT-PCR对NtCIPK3在低钾(10 μmol/L K+)、5% PEG、NaCl(200 mmol/L)、低温(4 ℃)处理后,及信号分子H2O2(10 mmol/L)及ABA(1 μmol/L)处理下的表达动态进行实时检测。该基因在低钾及低温处理下,3 h表达量上升至最大,分别为对照(0 h)的2.33倍(图7-A)和4.27倍(图7-D)。在PEG和H2O2处理下,都是24 h时表达量达到最大,分别为对照(0 h)的15.32倍(图7-B)和8.37倍(图7-E)。在NaCl 和ABA处理下,12 h该基因的表达水平最高,分别为对照(0 h)的4.21倍(图7-C)和6.22倍(图7-F)。
不同小写字母表示差异显著(P<0.05)。图7同。Different letters indicate significant differences(P<0.05).The same as Fig.7.
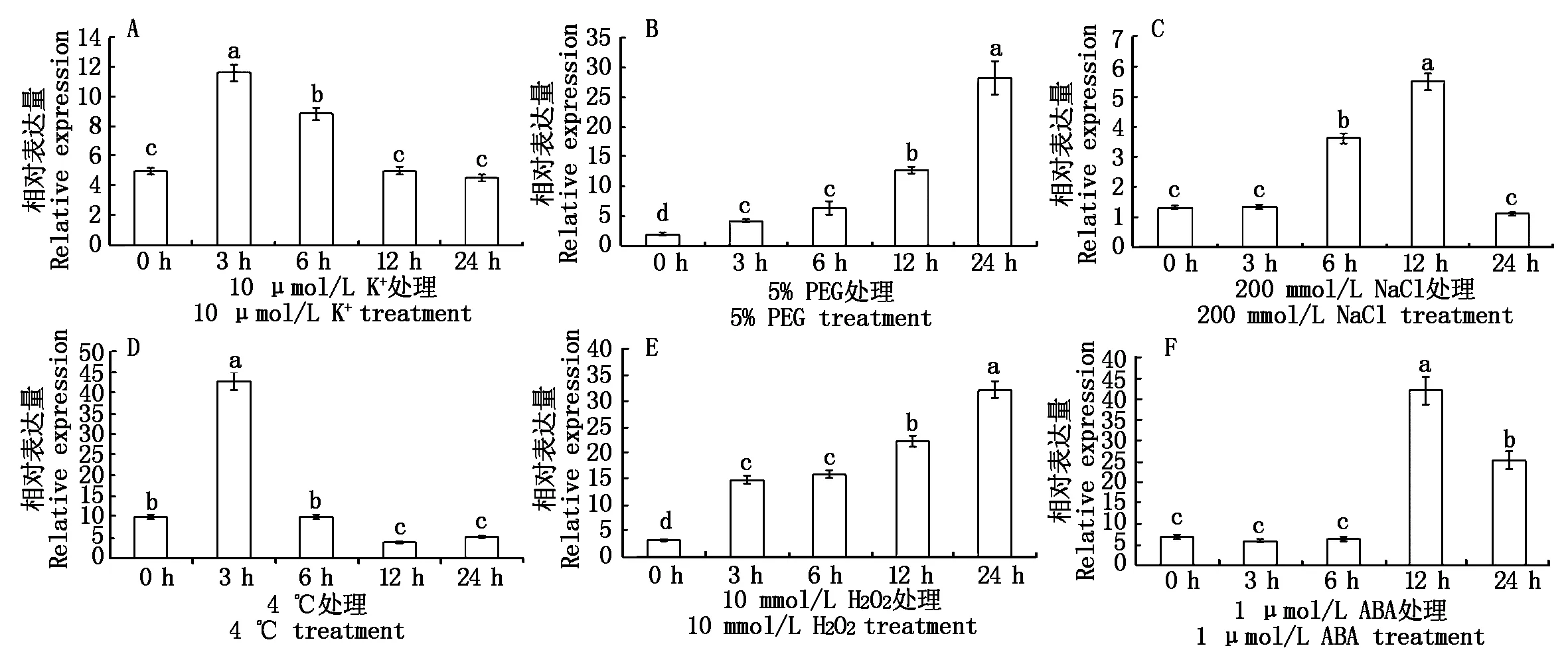
图7 非生物逆境胁迫及信号分子处理下NtCIPK3的表达分析Fig.7 Expression of NtCIPK3 under abiotic stress and signal molecule processing
3 讨论与结论
钙离子在植物的信号转导通路中起着重要的作用。钙离子传感器,CBLs,能与它们的靶蛋白CIPKs形成蛋白复合体,共同调节植物的生长发育及响应环境胁迫[25]。大部分CIPK家族的功能研究集中在模式植物,如拟南芥、水稻上,但在烟草中的研究鲜有报道。为此,在本研究中通过同源克隆的方法,从普通烟草品种K326中克隆得到NtCIPK3基因。通过序列比对及保守结构域分析发现,NtCIPK3蛋白包含保守的N末端激酶结构域和C末端调节结构域,这与拟南芥和其他物种的CIPKs的结构特征一致[26]。N-末端催化激酶结构域具有ATP结合位点和激活环。C末端调节结构域含有介导CIPK和CBL之间相互作用的NAF/FISL基序,以及介导CIPK和2C型蛋白磷酸酶(PP2C)之间的相互作用的PPI基序[27]。通过亚细胞定位预测,NtCIPK3蛋白主要定位于细胞核,这在拟南芥中也有相同发现,拟南芥CIPK3与ABA抑制子基因ABR1共定位于细胞核,共同参与ABA信号通路的调控[10]。
组织表达分析结果表明,NtCIPK3基因在选取的各个组织中均有表达,但各组织间的表达水平不同,在叶中表达量最高,茎和根次之,在花中的表达量最低。葡萄CIPK14基因的组织表达情况与之相似[28]。暗示这些基因在植物发育过程中可能发挥相似的功能。推测在烟草生长过程中,叶是最重要的光合作用器官,NtCIPK3基因的高表达可能有助于植物快速的营养生长以及响应环境胁迫。但这与大豆中的表达模式不同,大豆CIPK3在花中表达量最高[21]。推测是因为大豆与烟草的进化关系较远,CIPK 的功能在进化过程中可能发生了歧化。
qRT-PCR分析结果表明,在各种非生物逆境胁迫及信号分子处理下,NtCIPK3基因相对表达水平均出现显著变化,表明该基因的表达受各种非生物胁迫因子的影响,推测NtCIPK3基因可能参与植物各种非生物逆境胁迫的应答反应及信号转导过程。在低温处理下,NtCIPK3基因的表达在3 h时受到显著诱导,这与在油菜中CIPK3基因的表达情况相同[29]。拟南芥中也有相似研究,AtCIPK3基因在低温响应中具有重要作用,可能通过调控CBF/DREB1转录因子基因来调控冷响应基因RD29A的表达[30]。在低钾和PEG处理下,该基因的表达水平受到显著诱导,这在葡萄CIPK3基因的研究中也有相同发现[31]。在水稻和玉米中也发现大量 CIPK 基因响应PEG、低钾等胁迫应答过程[32-33]。在高盐处理下,NtCIPK3基因在12 h时表达受到显著诱导,这与拟南芥及沙梨中多个CIPK基因在高盐处理下的表达模式一致[34-35]。但与玉米CIPK3的表达模式不完全相同,玉米CIPK3在盐胁迫下,根中表达量降低,叶中表达量升高[33]。这可能是因为NtCIPK3基因表达量检测的是整株表达水平,而该基因在叶中表达量最高,所以,在叶中的表达情况占主导作用。NtCIPK3在ABA处理下,表达上调,这在拟南芥中有相似的研究结果。拟南芥CIPK3的表达受ABA诱导,进一步的研究表明该基因在ABA信号转导中起着重要作用[36]。以上研究为进一步探索NtCIPK3蛋白激酶基因的功能及机制提供了重要的依据。
根据同源物种基因的保守性,参考林烟草CIPK3序列设计引物,从普通烟草K326中克隆到1个蛋白激酶基因NtCIPK3,序列长度为1 272 bp。生物信息学研究表明,NtCIPK3为碱性亲水性蛋白,主要定位于细胞核。含有CIPK蛋白保守结构域,且具有多个Ser、Thr和Tyr磷酸化位点。qPT-PCR分析结果表明,NtCIPK3基因在烟草根、茎、叶、花中均有表达,但在叶中表达量最高。NtCIPK3基因在不同时间点的表达,分别受到低钾、PEG、ABA、NaCl、H2O2及低温胁迫的显著诱导,表明NtCIPK3基因可能在植物多种非生物胁迫应答中行使功能。
